FDA今日加速批准PARP抑制剂新药,用于晚期卵巢癌

今天,Clovis Oncology公司宣布美国FDA加速批准(accelerated approval)了其新药Rubraca(rucaparib)片剂、首个PARP抑制剂作为单一疗法用于治疗携带有害BRCA突变(生殖系和/或体细胞)的晚期卵巢癌,这些妇女患者已经接受过两种或更多种化疗治疗手段。

根据美国国家癌症研究所(the National Cancer Institute)估计,2016年度约有2.2多万名妇女被诊断为卵巢癌,1.4万病人会因此而死亡。其中,大约15%至20%的卵巢癌患者携带BRCA基因突变。BRCA基因主要参与修复损伤的DNA,通常以此机制来防止肿瘤进一步发展。然而,这些基因的突变也可直接导致包括卵巢癌在内的某些癌症。
▲Rucaparib的分子结构(图片来源:NIH)
Clovis Oncology公司的新药Rubraca是一种靶向聚ADP-核糖聚合酶(PARP)的抑制剂,可阻断参与修复受损DNA的PARP酶活性。当PARP的功能得到抑制,那些同时具有受损BRCA基因的癌细胞DNA不太可能得到修复,于是可导致癌细胞死亡,并可能减缓或停止肿瘤生长。
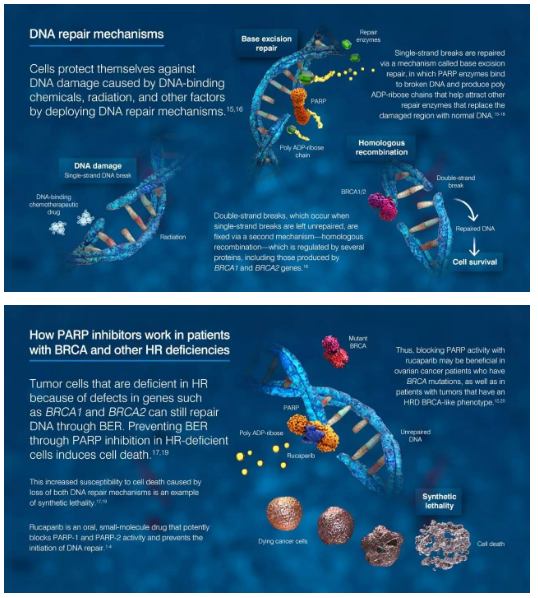
▲Rucaparib的作用机理(图片来源:ARIEL clinical trials官网)
今天,FDA也同时批准了Foundation Focus CDxBRCA伴随诊断试剂盒与Rubraca一起使用,它也是美国FDA批准的第一个基于下一代测序(NGS)的伴随诊断。药明康德合作伙伴Foundation Medicine公司与Clovis公司共同开发了伴随诊断测试Foundation Focus CDxBRCA,这是一种基于病人组织的基因组测定工具,可检测卵巢癌中的肿瘤BRCA1和BRCA2突变(生殖系和/或体细胞)。

FDA在其加速批准项目下批准了Rubraca,该监管机构还曾授予了Rubraca突破性疗法认定和优先审查资格。Rubraca也获得了孤儿药资格认定。
Rubraca的NDA申请是基于来自两个多中心、单臂、开放标签临床试验的积极结果,研究人员在晚期BRCA突变卵巢癌妇女中评估了客观反应率(ORR)和持续时间(DOR),她们接受两个或更多化疗后病情有所恶化。所有106名患者每日两次口服600毫克Rubraca作为单一疗法,直到疾病进展或不可接受的毒性。
基于独立放射学评审(IRR)的反应评估为42%(95%CI:32,52),中位DOR为6.7个月(95%CI:5.5,11.1)。研究者评估的ORR在铂敏感患者中为66%(52/79; 95%CI:54,76),在铂耐药患者中为25%(5/20; 95%CI:9,49),在铂难治性患者中为0%(0/7; 95%CI:0,41)。BRCA1或BRCA2基因突变的患者具有相似ORR。
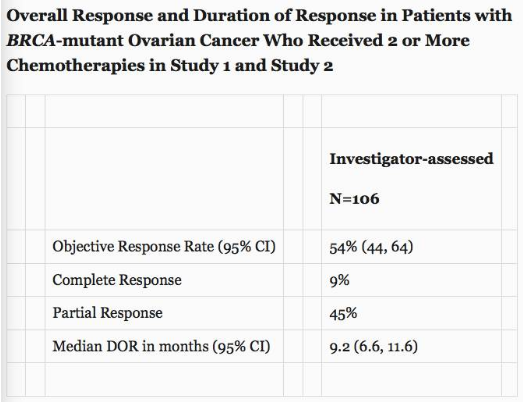
▲Rubraca的临床良好数据(图片来源:Clovis Oncology官网)
“我们相信,今天Rubraca的获批为两种或多种化疗后生殖系或体细胞BRCA突变的晚期卵巢癌患者提供了一种重要的创新疗法,”Clovis Oncology的首席执行官兼总裁Patrick J. Mahaffy博士说道:“我们期待在美国市场推出Rubraca,尽快为晚期卵巢癌女性患者提供这种急需的精准医学治疗方案。”
参考资料:
[1] FDA grants accelerated approval to new treatment for advanced ovarian cancer
[2] Clovis Oncology Announces FDA Accelerated Approval of RUBRACA™ (rucaparib) for the Monotherapy Treatment of Advanced Ovarian Cancer in Women with Deleterious Germline or Somatic BRCA Mutations Treated with Two or More Chemotherapies
[3] Clovis Oncology官方网站