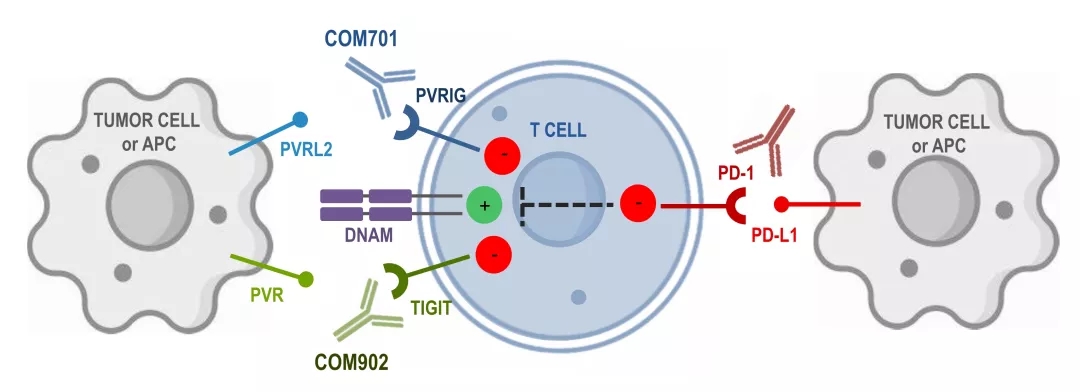
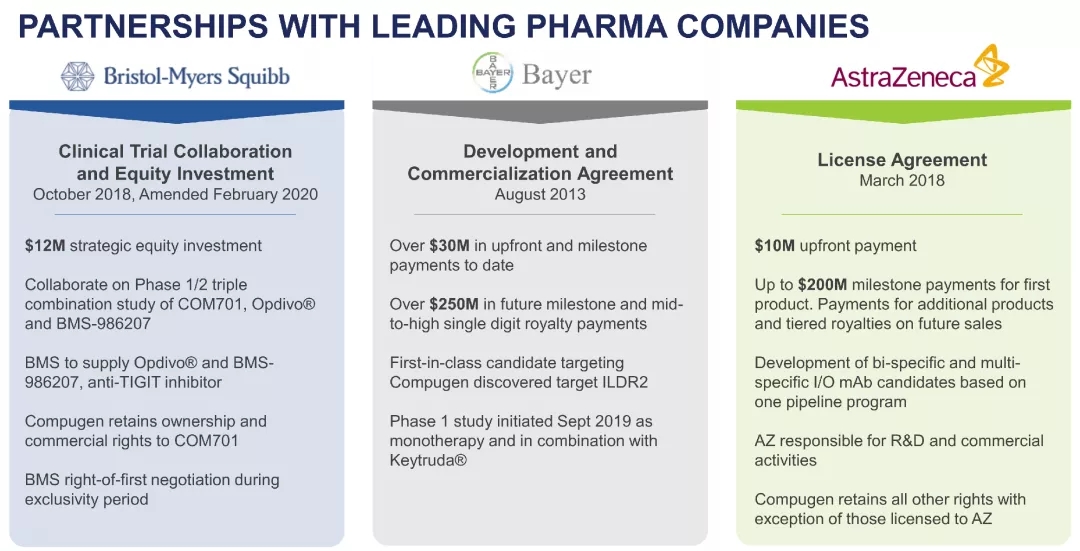
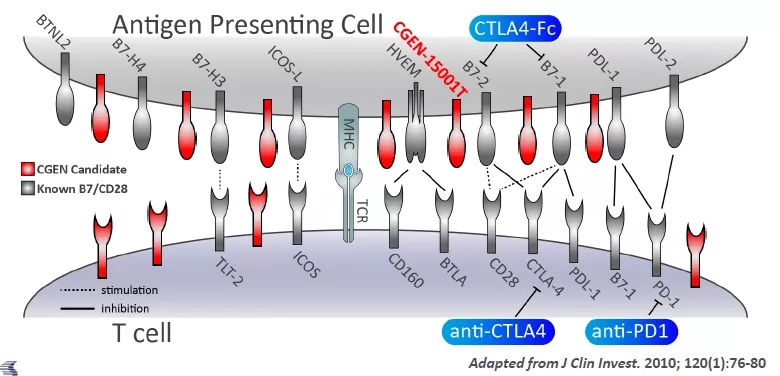
ILDR2:新一代免疫检验点
以PD-1/PD-L1为代表的免疫检验点引领了肿瘤免疫的蓬勃发展,一方面围绕各种已知免疫检验点的竞争已经如火如荼,另一方面一些生物技术公司则致力于发现新的肿瘤免疫靶点。如陈列平教授创办的NextCure即通过FIND-IO技术平台,具体而言是通过原代免疫细胞或细胞系,基于蛋白相互作用和高通量筛选技术鉴定引起特定免疫反应的蛋白,以发现新靶点。
NextCure的FIND-IO技术仍然基于深厚的免疫学框架背景,新靶点的鉴定具有一定的方向性。如通过GSRA(genome-scale receptor array)发现LAG-3的新配体FGL1,颠覆了MHC-II作为LAG-3主要配体的认知,也就发现了新的潜在靶点。但还有一些公司如以色列Compugen或华大基因,鉴定新靶点的方式更加“粗暴”,更加类似于大数据或人工智能的概念。这两家公司最初都是基因测序背景,掌握了大量健康人和不同疾病患者的基因数据。华大基因转型生物制药(华大吉诺因),主要是通过基于新抗原neoantigen的T细胞疗法(Neo-T)。Neoantigen的概念已经为大家熟知,Neo-T在形式上类似于TCR-T,不过后者倾向于选择一些不依赖于HLA基因型的靶点,Neo-T则为针对每个患者特定抗原的特异性TCR-T细胞疗法。概念上,Neo-T类似于个体化的T细胞疗法。但在具体实施过程,如何快速扩培出特异性的T细胞,相比于传统的TCR-T这中间有太多的技术瓶颈和风险。
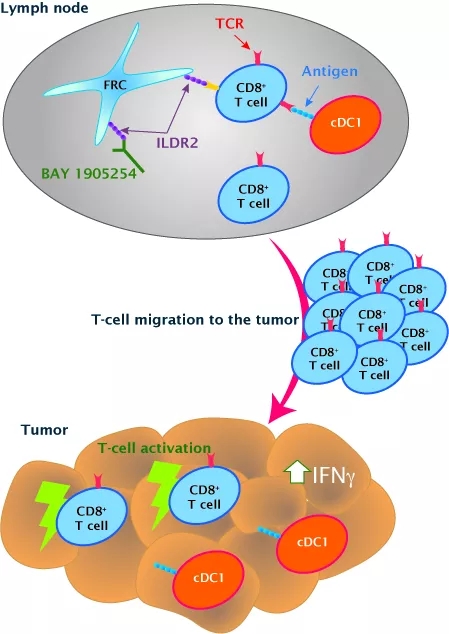
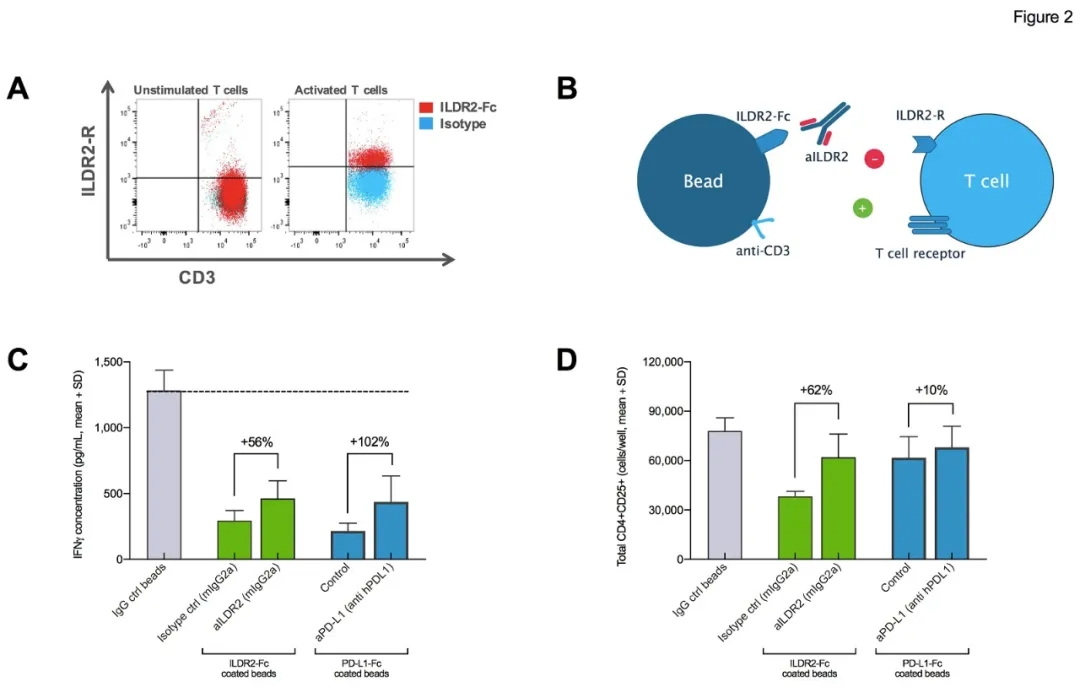
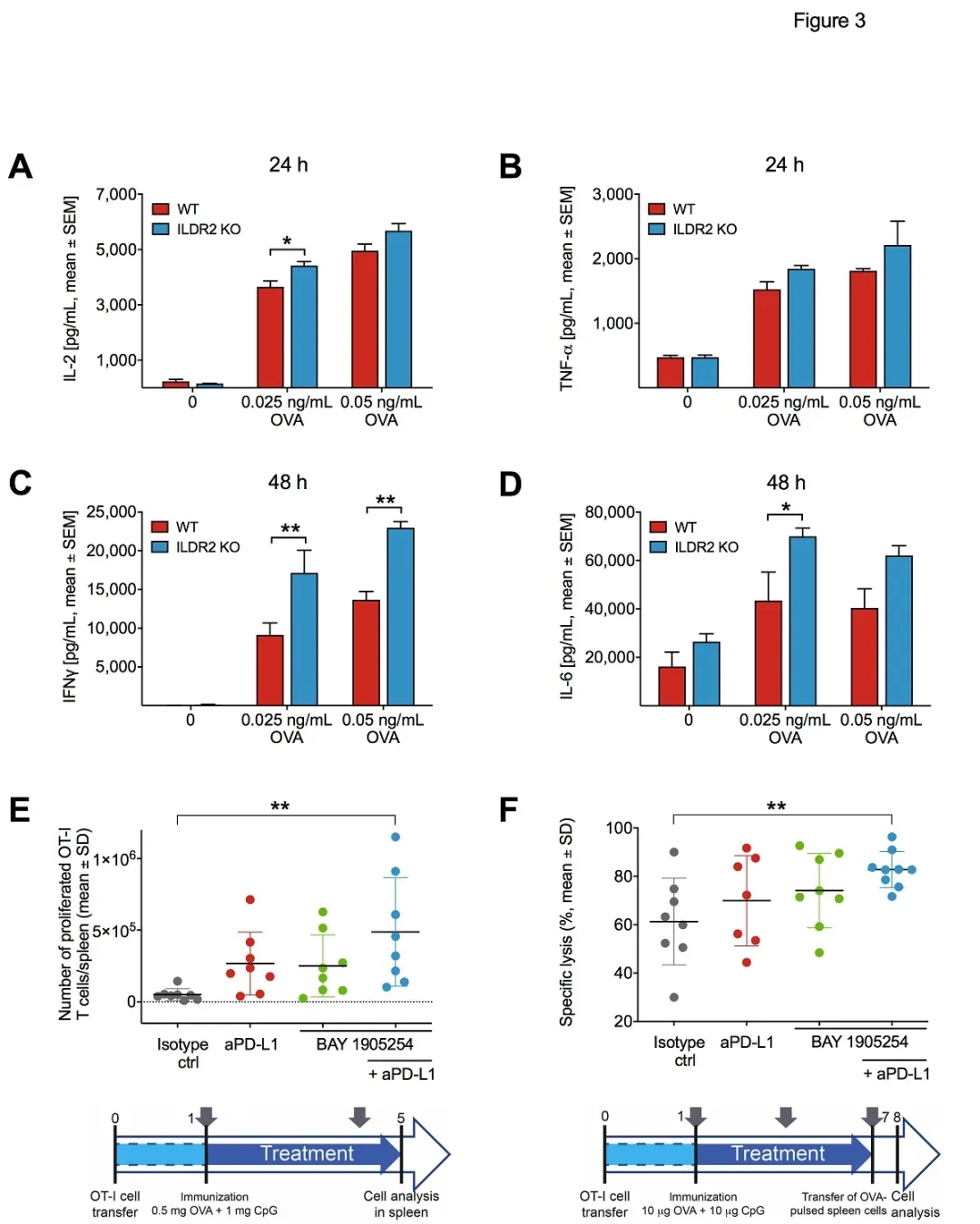
ILDR2作为新发现靶点,到目前为止其受体仍未知。2020年4月20日,拜耳ILDR2抗体BAY 1905254的临床前研究发表在Cancer Immunology Research期刊上。文章题目为“Characterization of BAY 1905254, an immune checkpoint inhibitor targeting the immunoglobulin-like domain containing receptor 2 (ILDR2)”。ILDR2被证实具有抑制T细胞激活的效应,ILDR2还表达淋巴结的成纤维网状细胞(FRC)上,可能影响到T cell Priming。
ILDR2抗体BAY1905254则促进效应T细胞的增殖。
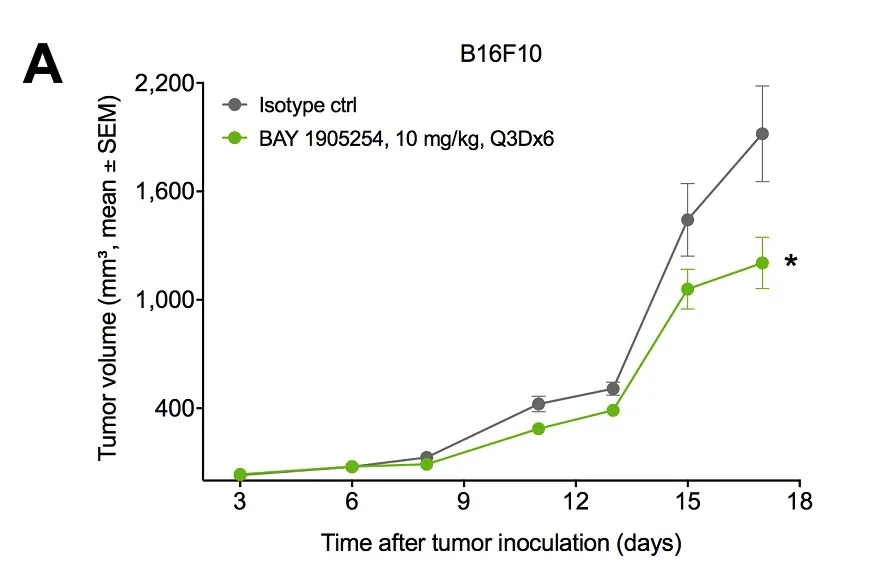
小鼠肿瘤模型中,BAY1905254单药治疗表现出抑制肿瘤生长的活性。
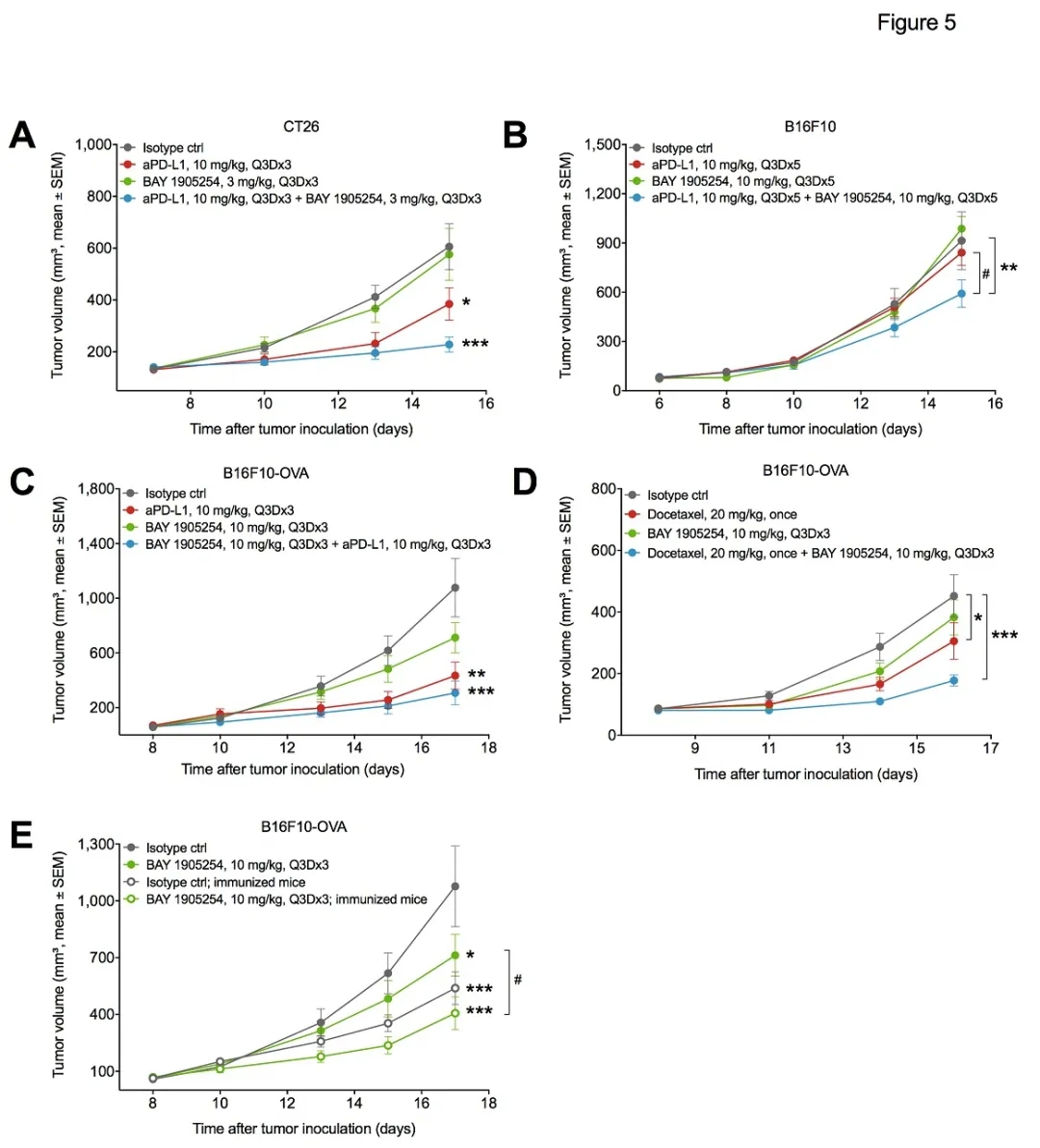
BAY1905254与PD-L1抗体联用时,也表现出明显的协同效应。
拜耳科学家认为,ILDR2抗体可能主要影响淋巴结中T cell Priming的过程,而PD-1抗体或PD-L1抗体则在肿瘤微环境中直接解除对效应T细胞的抑制。因此,ILDR2与PD-1抗体有不同的作用位置和机制,表现出协同作用make sense。
小编总结
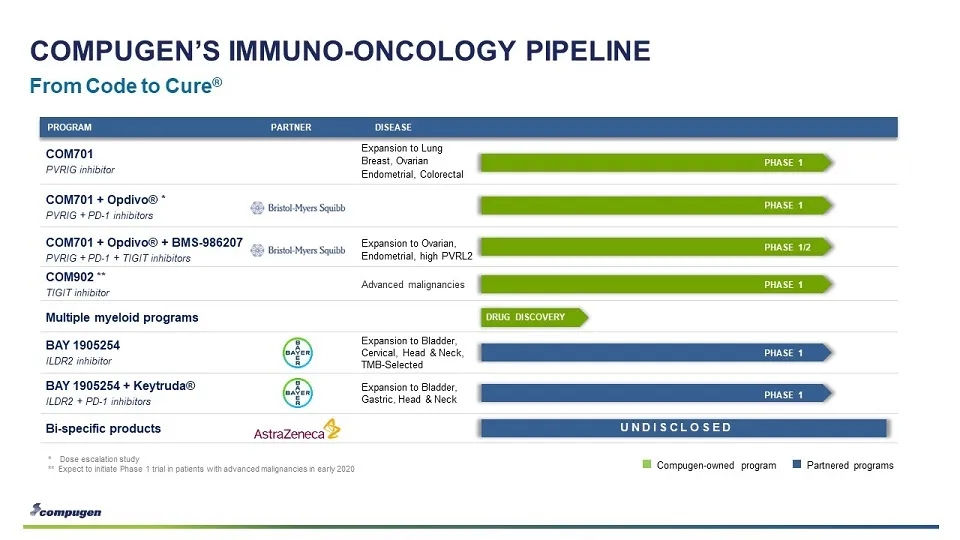
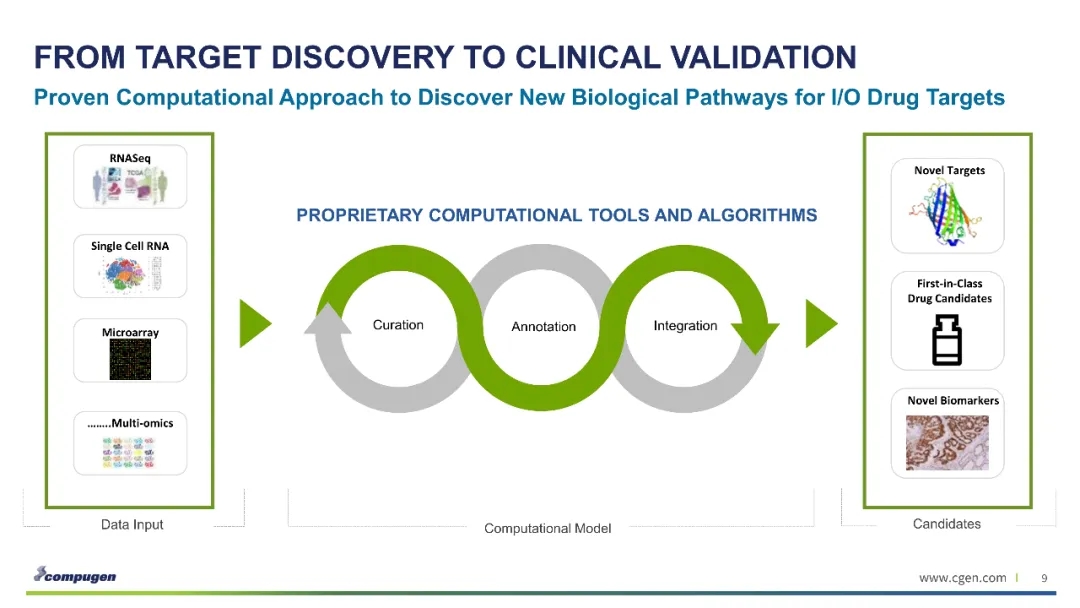
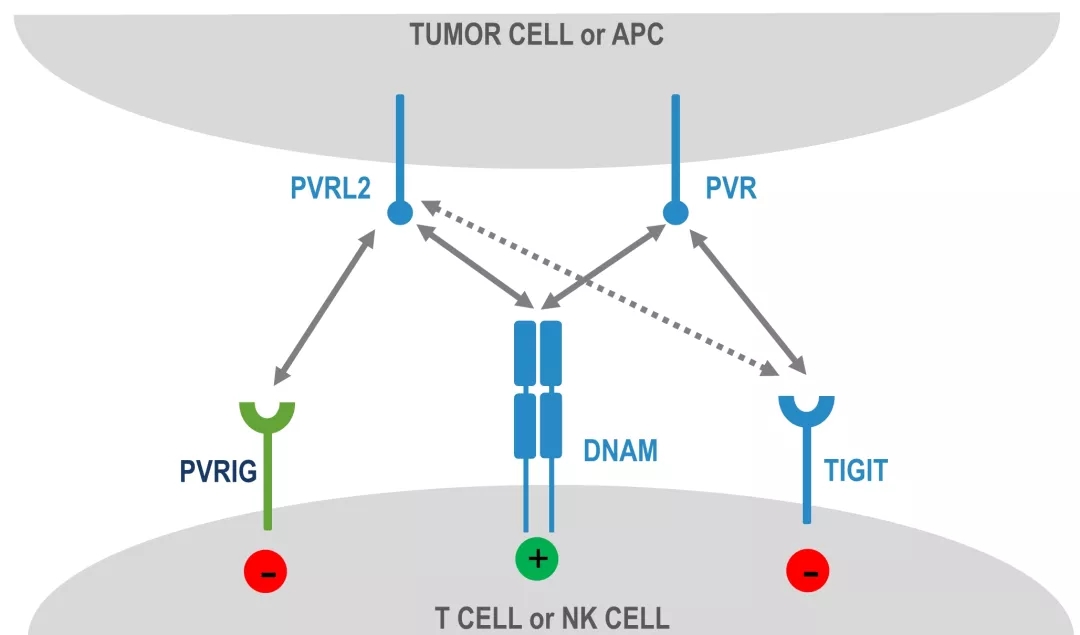
Compugen公开资料中并未过多介绍其靶点预测系统的细节,但从已经公开的PVRIG、ILDR2等靶点来看,仍集中于特定的panel如B7/CD28 family等,对特定家族免疫检验点的特点进行了归纳和总结。
传统的转化研究中,新靶点的发现是个极其艰苦和漫长的过程。Compugen这类公司致力于整合既有的数据和知识,建立预测新靶点的系统。从目前的的进展来看,还是发现了一些有潜在价值的靶点,但仍需大量的概念验证的机制探索工作以提高成功概率。Compugen与NextCure的新靶点发现平台有些共通之处,但在理念和方法上也有很大的差异。不过,正是这些努力改变了肿瘤免疫的研发模式。传统的转化研究是从基础研究发现候选靶点开始,而Compugen、NextCure则通过高通量方法预测和筛选具有特定免疫调节功能的潜在靶点。