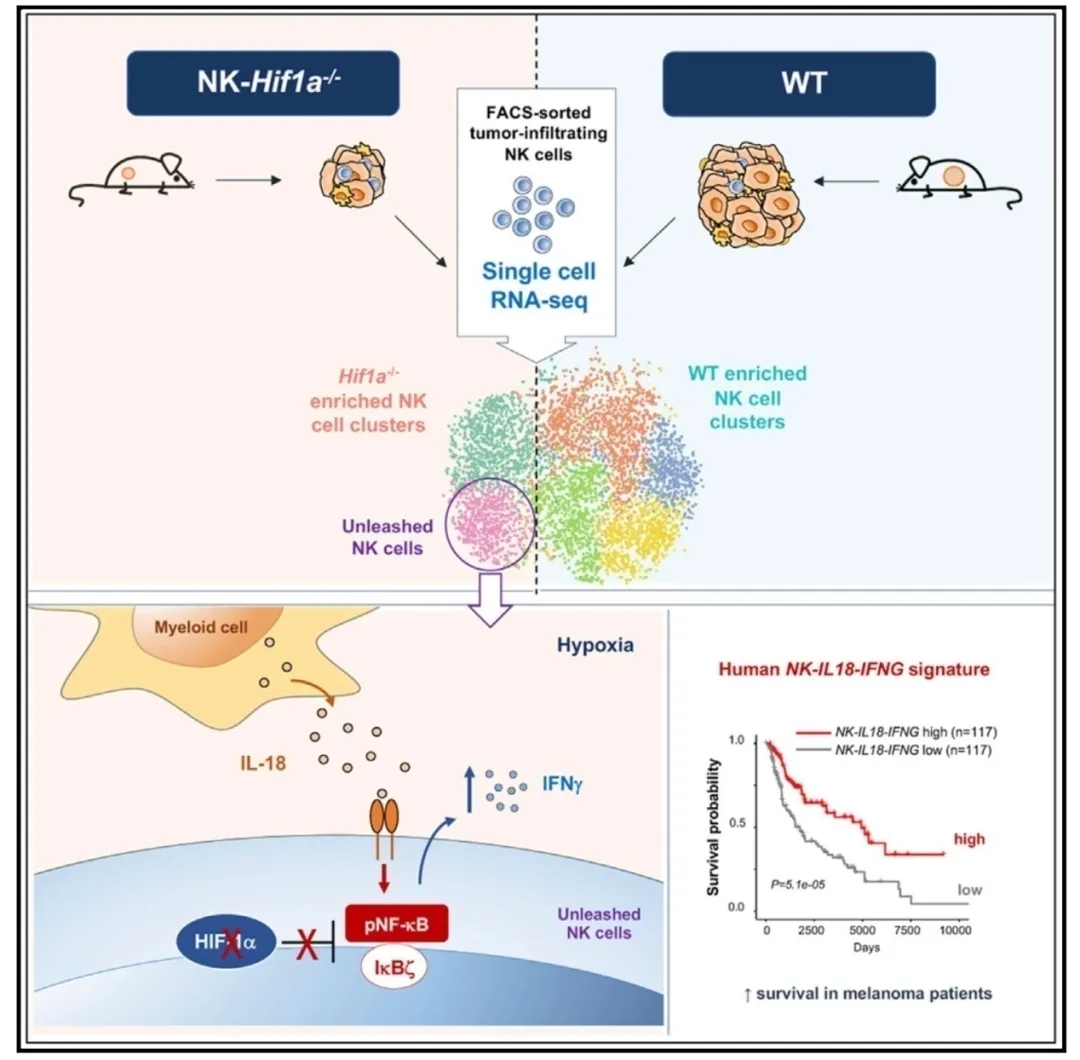
Immunity: 肿瘤浸润NK细胞的单细胞测序显示,转录因子HIF-1α的抑制释放了NK细胞的活性
自然杀伤(NK)细胞是一种天然的细胞溶解和细胞因子产生的效应细胞,能有效杀伤多种肿瘤靶细胞。NK细胞是在激活NK受体的信号整合后被激活的,这些信号被潜在靶细胞上针对自MHC I类分子的特定抑制受体所抵消。因此,NK细胞能有效杀死MHC I类低表达的肿瘤细胞,MHC I类在许多肿瘤中都有报道(例如,在高达43%的黑色素瘤患者中),这强调了NK细胞的抗肿瘤潜能。然而,在实体肿瘤中,肿瘤浸润的NK细胞常常表现出功能失调的表型,表达激活受体水平的降低和抑制受体水平的升高,是细胞因子IFN-γ的不良产生者,细胞毒性较低。这种功能障碍是否适用于所有肿瘤浸润的NK细胞,或者是否存在分子异质性,迄今为止还没有得到很好的解决。此外,如何预防和克服肿瘤组织中的NK细胞功能障碍,充分发挥NK细胞的抗肿瘤潜能,仍是一个具有挑战性的课题。
简介:
2020年5月20日,来自德国海德堡大学Department of Immunobiochemistry, Mannheim Institute for Innate Immunoscience的Adelheid Cerwenka教授课题组在Immunity(IF: 21.522)杂志上发表题为“Single-Cell RNA Sequencing of Tumor-Infiltrating NK Cells Reveals that Inhibition of Transcription Factor HIF-1a Unleashes NK Cell Activity”的文章[1]。该研究表明HIF1A低表达与IFNG在人肿瘤浸润NK细胞中的高表达有关,而实体瘤中NK-IL18-IFNG信号的富集与患者总体生存期的增加有关。因此,抑制HIF-1α释放了NK细胞抗肿瘤活性,可用于癌症治疗。IL-18与NK细胞特异性HIF-1a靶向治疗相结合的方法有望改善NK细胞敏感性实体肿瘤的治疗策略。
主要结果:
缺乏HIF-1α的NK细胞表现出强大的抗肿瘤活性并抑制肿瘤生长。
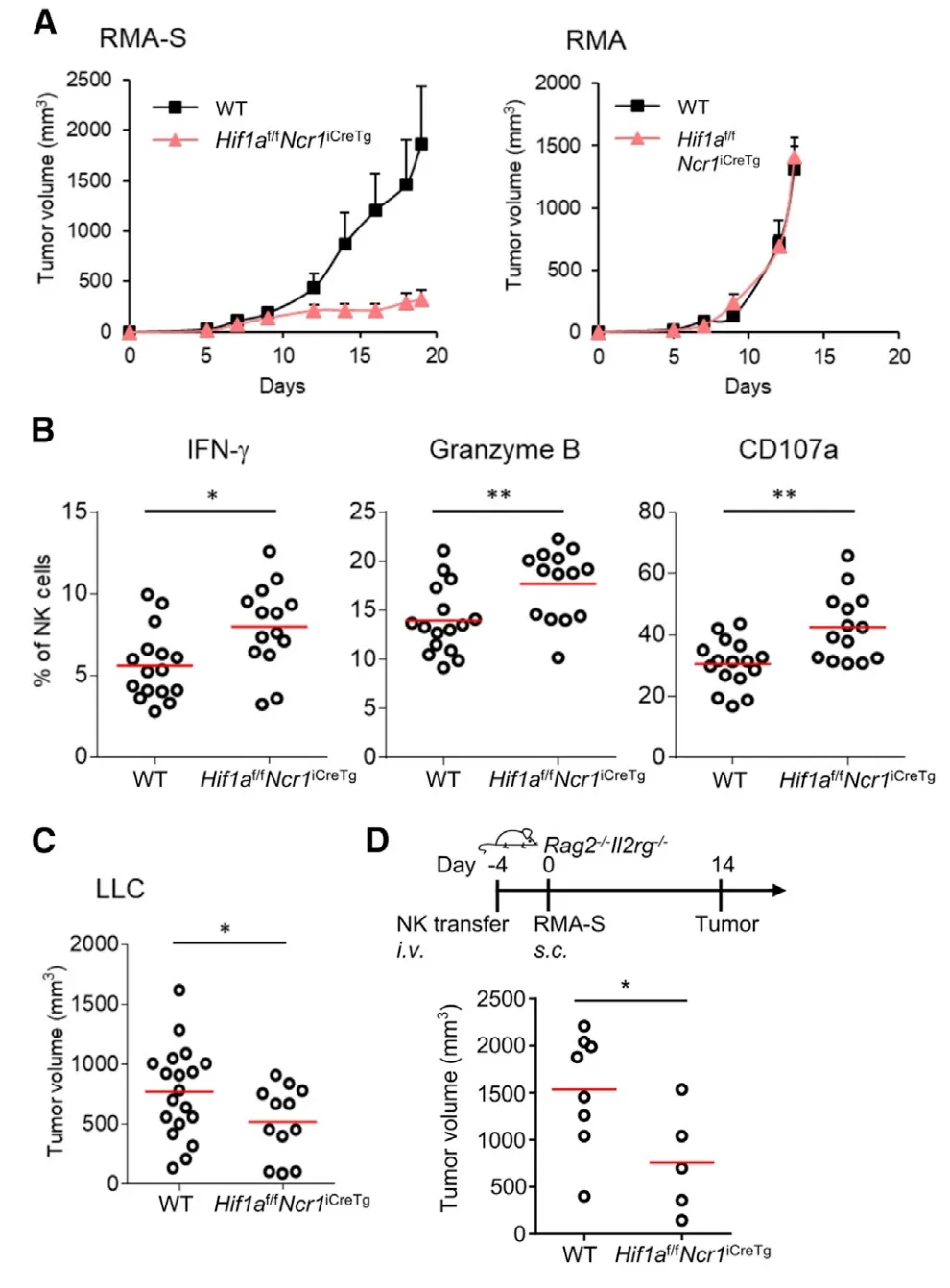
为探讨HIF-1α在长时间缺氧和在实体肿瘤组织中对NK细胞反应的调控作用,研究人员利用Hif1af/fNcr1iCreTg小鼠。这些动物在NKp46+细胞中有条件地缺失Hif1a。其他免疫细胞在Hif1a的表达与对照组Hif1af/f小鼠相似,在整个研究中被称为野生型(WT)。Hif1a的缺失并没有改变不同器官中NK细胞的数量,也没有改变脾脏成熟和分化标记CD27和CD11b的表达。在正常氧条件下,WT和Hif1a-/-小鼠NK细胞(经过激活受体NK1.1和NKp46,与肿瘤细胞共培养或者细胞因子IL-12和IL-18刺激4h)的脱颗粒和IFN -γ的产生类似。为研究Hif1a-/- NK细胞在体外的抗肿瘤活性,作者利用了不同肿瘤模型。皮下注射106个RMA-S淋巴瘤细胞,MHC I类表达缺失,导致WT小鼠肿瘤生长,而Hif1af/fNcr1iCreTg动物肿瘤大小明显减小。当小鼠接种表达MHC I类的RMA细胞并被NK细胞杀死时,未发现肿瘤生长的变化。
图1:NK细胞缺乏Hif1a会导致肿瘤生长减弱
肿瘤浸润NK细胞的高通量ScRNA-Seq揭示了Hif1af/fNcr1iCreTg小鼠中一个明显的NK效应亚群。
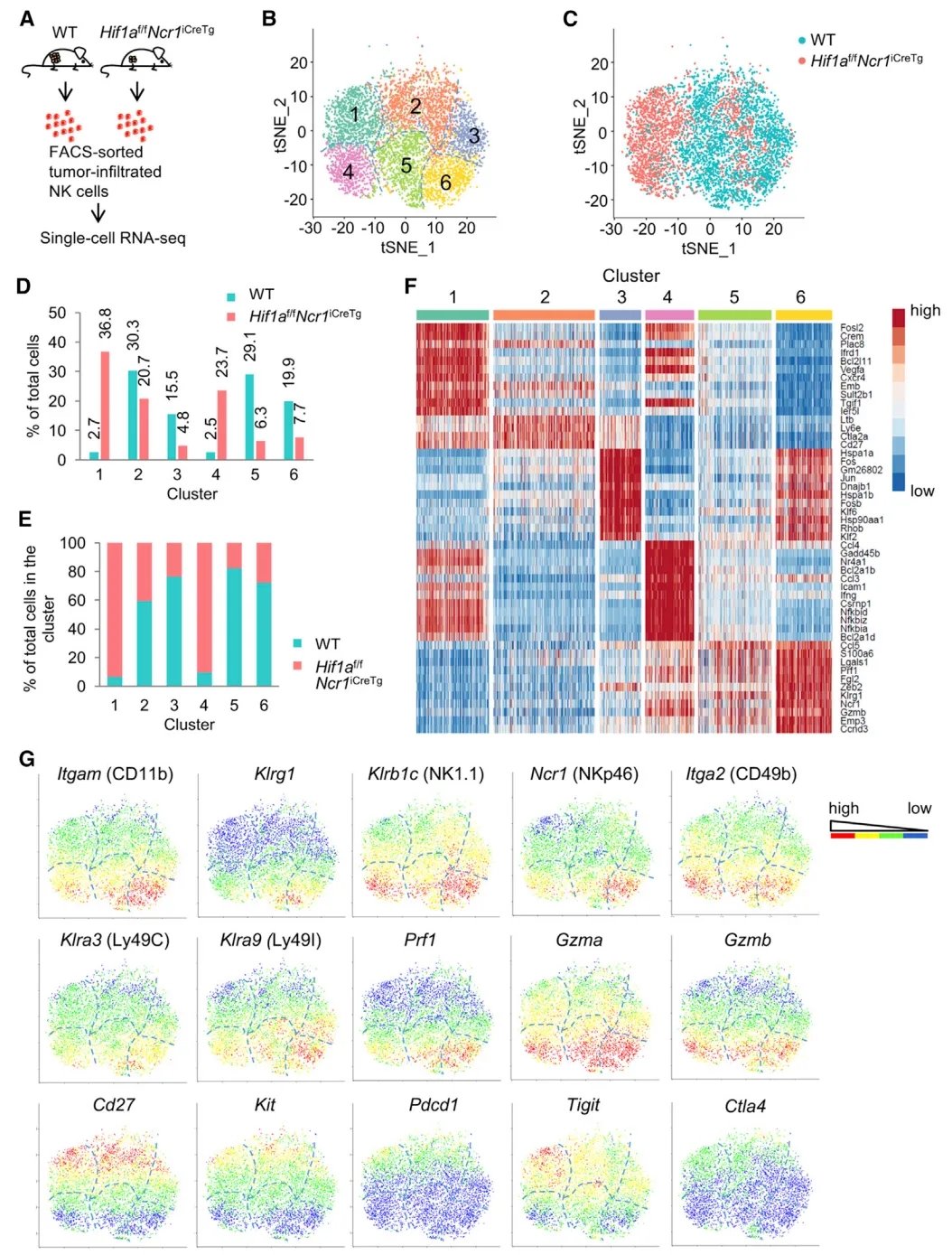
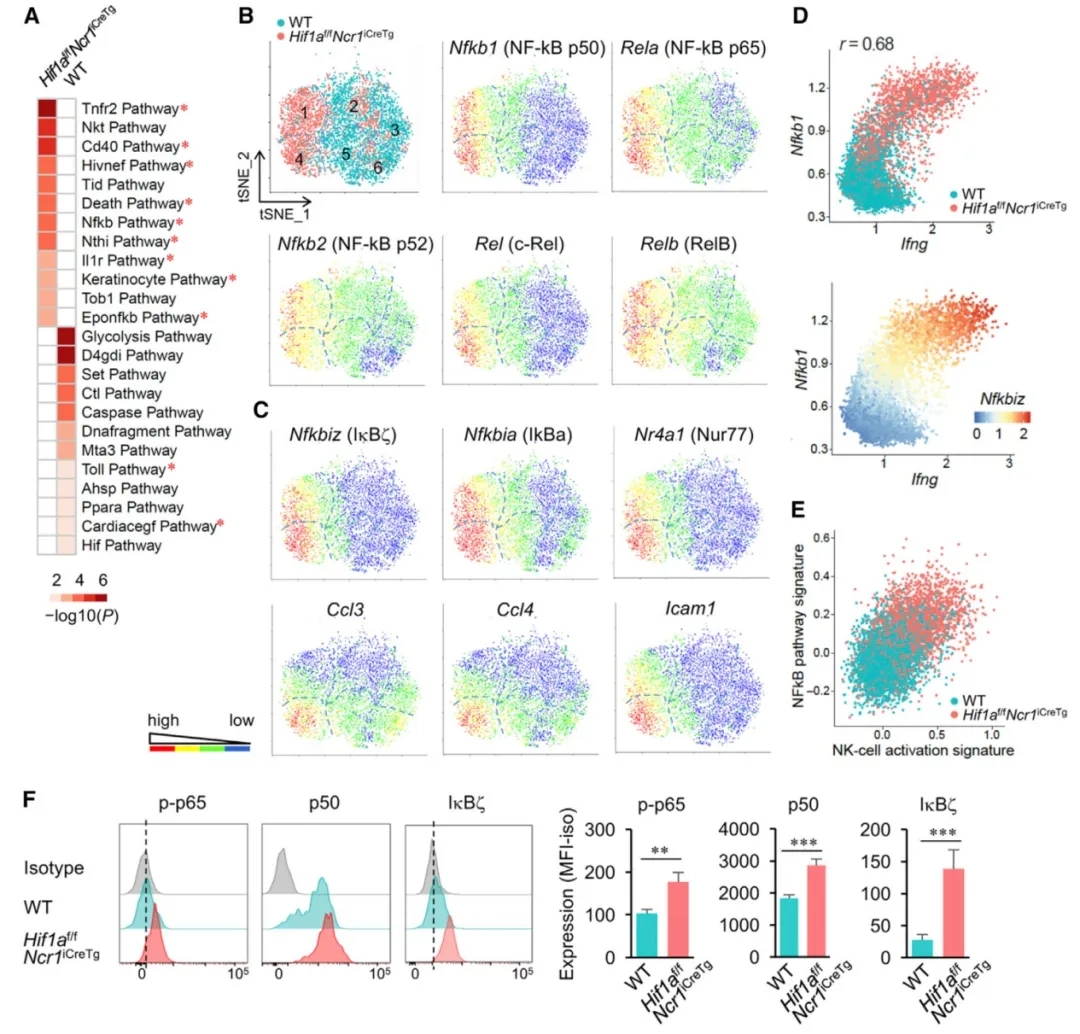
为了以无偏倚的方法确定Hif1af/fNcr1iCreTg和WT小鼠肿瘤浸润NK细胞的转录谱,作者进行了scRNA-seq (10X基因组学)研究。对来自两种小鼠的所有NK细胞进行无监督聚类,结果显示基于转录特征的六个不同的聚类。Hif1a-/- 和WT NK细胞显示不同的聚类分布。60%的Hif1a-/- NK细胞分布在第1和4簇,而相比而言只有5.2%的WT NK细胞。在所有的第1和4簇细胞中,超过90%的细胞是Hif1a-/- NK细胞。相反,WT NK细胞的大多数分布在第2,3,5和6簇。来源第1,2和3簇的细胞为Cd11blowCd27high,区别于第4,5和6簇细胞的表达特征Cd11bhighCd27low。Prf1、Gzma、Gzmb的表达,分别编码胞溶分子穿孔素和颗粒酶A、B,在Cd11bhighCd27low细胞中也高表达。细胞因子IFN-γ (Ifng)和活化标记CD69 (Cd69)在Hif1a缺陷的NK细胞中显着上调(cluster 4)。在cluster 4中,WT NK细胞占总细胞的比例小于10%,Hif1a也低表达。在WT NK细胞中,Hif1a及其靶基因低表达与Ifng转录增加相关,说明HIF-1a在调节NK细胞激活和效应功能方面的负作用。WT和Hif1a-/-肿瘤浸润性NK细胞之间差异表达的转录本的通路分析表明,Hif1a-/- NK细胞以及簇1和4中NF-kB通路和其他涉及NF-kB活性的通路均显着富集。
图2:肿瘤浸润性NK细胞的高通量单细胞RNA-Seq显示Hif1a-/-簇具有不同转录特征
Hif1a-/- NK细胞的抗肿瘤活性依赖于髓系细胞来源的IL-18。
为研究驱动肿瘤浸润性Hif1a-/- NK细胞中NF-κB活性增强的因素,作者从整体肿瘤组织中分析细胞因子和趋化因子的转录图谱。与scRNA-seq数据一致,与野生型小鼠相比,Ifng是Hif1af/fNcr1iCreTg小鼠肿瘤组织中上调最高的转录本。与Ifng一起,编码细胞因子IL-18的mRNA,在Hif1af/fNcr1iCreTg小鼠肿瘤组织中检测到较高的丰度。肿瘤组织中相似的IL-18蛋白表达与基因型无关,提示IL-18在这些肿瘤中并无差异。然而,与WT NK细胞相比,Hif1-a缺陷的IL-18通路(IL-18 receptor, IL-18R)下游信号分子,包括IkB等NF-kB家族成员,在Hif1-a缺陷细胞中具有较强的富集。因此,作者通过单克隆抗体注射中和IL-18,研究了IL-18在RMA-S肿瘤控制中的作用。在WT小鼠中,IL-18的中和作用没有改变肿瘤的生长。同样,注射重组IL-18也不影响Rag2缺陷小鼠的RMA-S肿瘤进展。与此相反,抗IL-18单克隆抗体的应用可消除Hif1af/fNcr1iCreTg小鼠的肿瘤延迟生长。与对照组小鼠相比,IL-18中和降低了Hif1af/fNcr1iCreTg肿瘤浸润NK细胞中p-p65和p50的表达,并抑制了IkB的上调。进一步发现,在小鼠NK细胞中抑制HIF-1α可增强效应细胞功能,促进细胞代谢。
图3:单细胞RNA-Seq鉴定肿瘤中Hif1a-/- NK细胞活化亚群
抑制HIF-1α可导致激活的人类NK细胞的效应反应增强。
为研究抑制HIF-1a是否以类似的方式增强人NK细胞的效应功能,研究人员利用小分子化合物KC7F2处理纯化的人外周血NK细胞。在有IL-2存在的条件下,KC7F2对人NK细胞进行7天的扩增处理,可显着促进脱颗粒,并产生IFN-γ和TNF-α(肿瘤坏死因子),以响应NK细胞的原型靶细胞K562。这些发现突出了报道的HIF-1a抑制剂诱导高功能人类NK细胞的潜力。为了研究HIF-1a是否可能影响癌症患者的NK细胞抗肿瘤反应,作者从已发表的数据集中分析了单个NK细胞浸润非小细胞肺癌(NSCLC)和肿瘤周围组织的转录谱。观察到,与肿瘤周围的NK细胞相比,肿瘤浸润的NK细胞HIF1A表达升高,这与HIF1A的靶基因表达升高和IFNG转录水平降低有关。NK细胞效应因子在肿瘤中的负调控作用进一步通过NK细胞周围区NK-ILl18-IFNG信号降低得到支持,这与单个NK细胞中HIF1A的表达呈负相关。
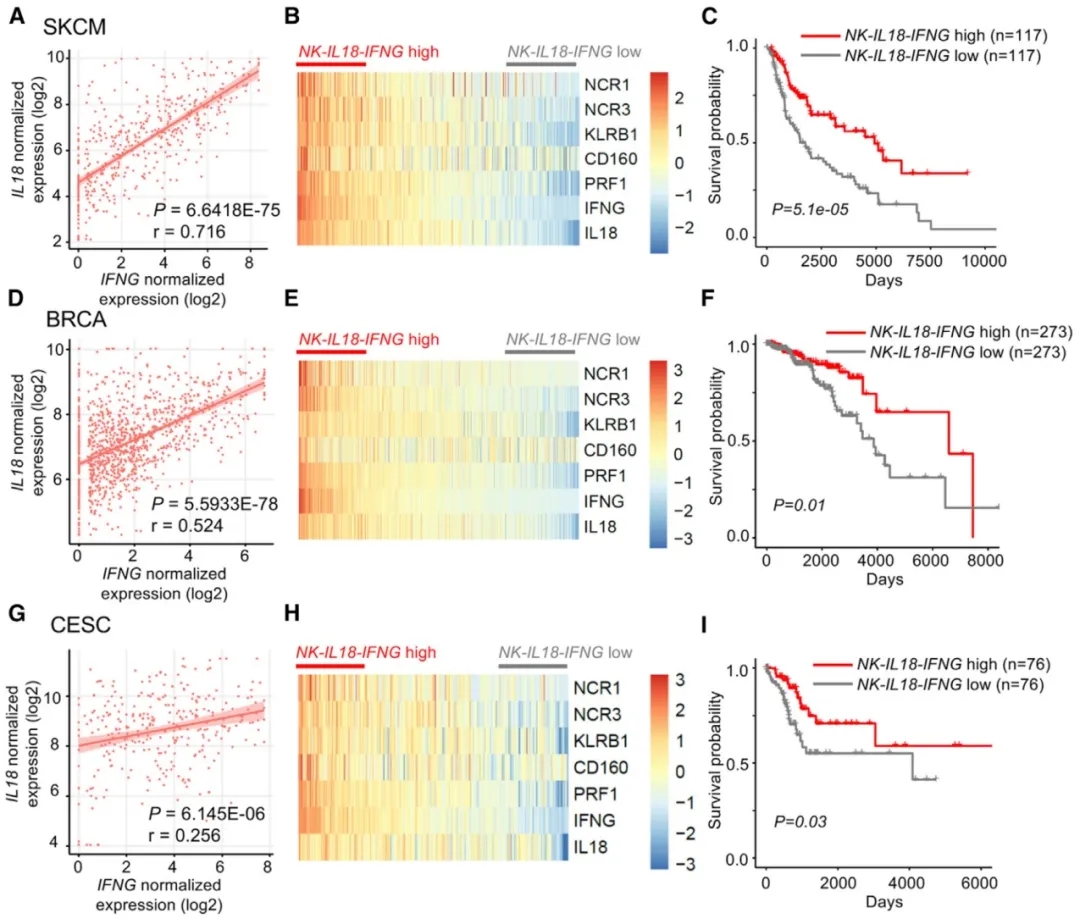
NK-IL18-IFNGhigh特征预测了不同癌症实体中患者的总体生存率的改善。
单个人肿瘤浸润NK细胞NK-ILl18-IFNG信号与HIF1A表达呈负相关。因此,进一步的目的是分析在人类肿瘤样本中整体的NK-IL18-IFNG信号是否可以预测癌症患者生存率的提高。的确,对来自癌症基因组图谱(TCGA)数据集的皮肤皮肤黑色素瘤(SKCM)的469例患者样本的分析显示,IL18和IFNG基因在SKCM肿瘤中的表达之间存在正相关关系。此外,作者发现NK细胞相关基因(NCR1、NCR3、KLRB1、CD160、PRF1)的表达与IL18-IFNG基因表达呈正相关。重要的是,在SKCM患者中与NK-IL18-IFNGlow相比,NK-IL18-IFNGhigh信号与更好的总体患者生存相关。在乳腺癌(乳腺浸润性癌[BRCA],n=1093)和宫颈癌(宫颈鳞癌[CESC],n=304)中也发现了类似的相关性。
图4:NK-IL18-IFNG信号与不同肿瘤实体中患者总体生存的改善有关
结论:
综上所述,作者的研究结果促进了对在NK细胞微环境中HIF-1α介导的NK细胞效应功能调控机制的理解。该结果表明,IL-18与NK细胞特异性HIF-1a靶向治疗相结合的方法有望改善NK细胞敏感性实体肿瘤的治疗策略。
原文链接:doi: 10.1016/j.immuni.2020.05.001
参考文献:
1. Ni J, Wang X, Stojanovic A, Zhang Q, Wincher M, Bühler L, Arnold A, Correia MP, Winkler M, Koch PS et al: Single-Cell RNA Sequencing of Tumor-Infiltrating NK Cells Reveals that Inhibition of Transcription Factor HIF-1α Unleashes NK Cell Activity. Immunity 2020.