优时比抗FcRn抗体Rozanolixizumab临床获NMPA受理
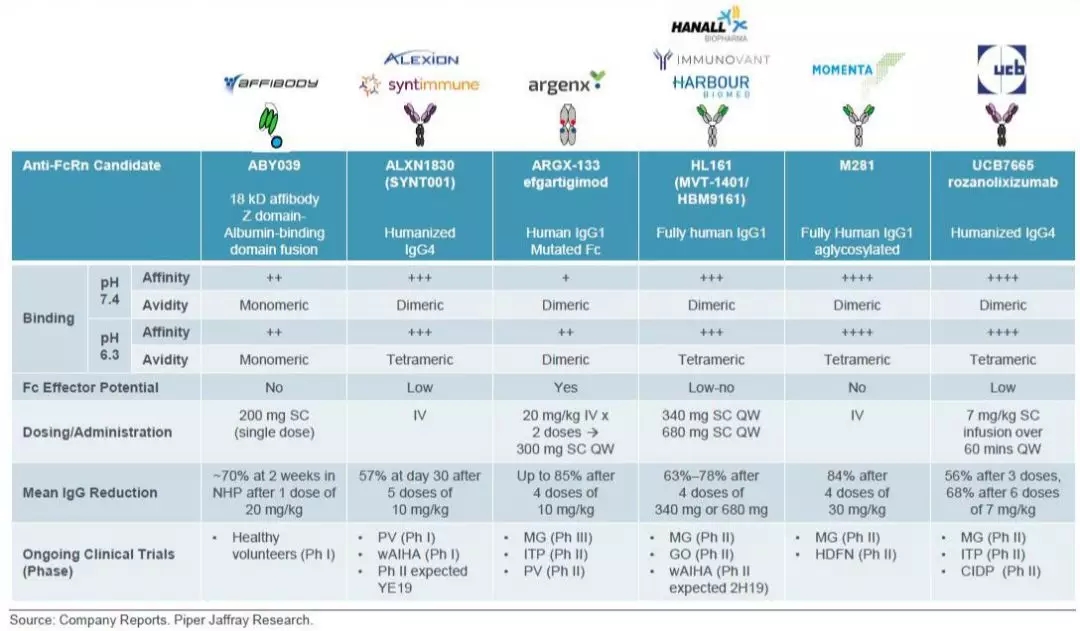
抗FcRn抗体竞争格局
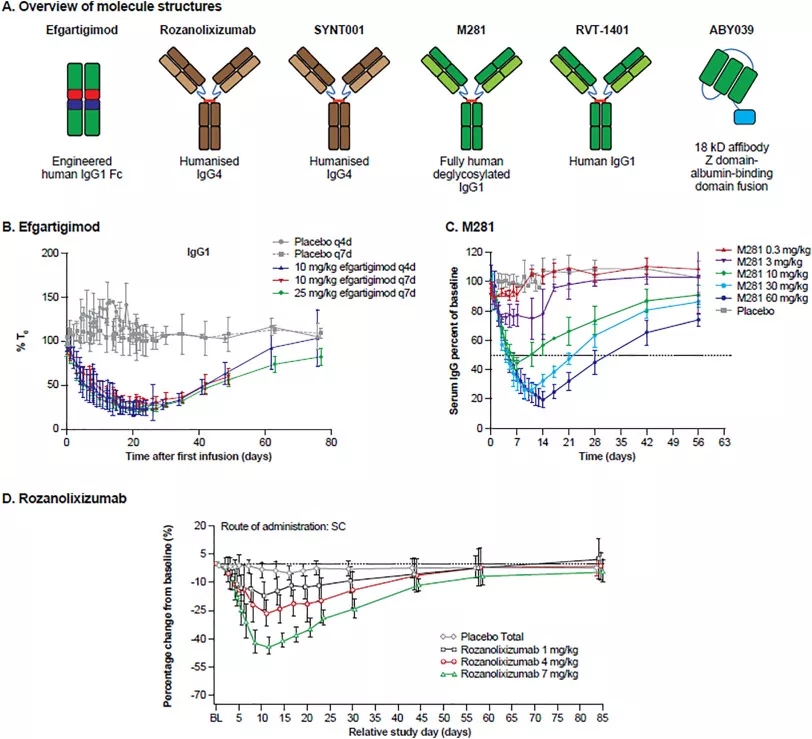
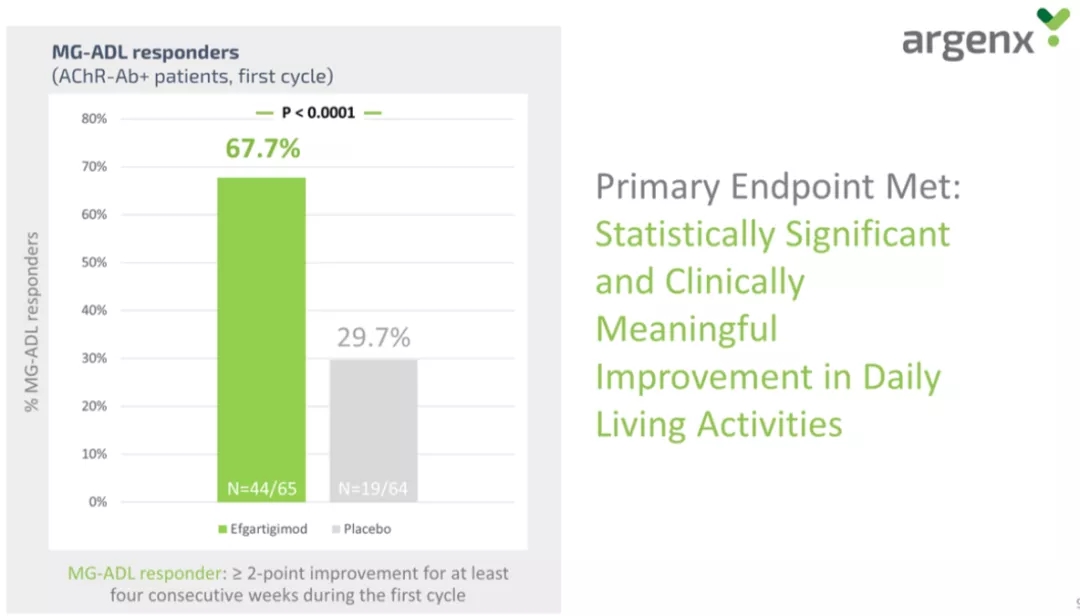
目前,除了UCB的rozanolixizumab外,还有多个企业涉足抗FcRn领域,包括Affibody旗下ABY039,亚力兄/Syntimmune旗下ALXN1830(SYNT001),Argenx旗下ARGX-133 efgartigimod,Hanall/Immunovant/和铂旗下HL161( MVT-1401/HBM9161),Momenta旗下M281。
图片来源:Next-generation Fc receptor–targeting biologics for autoimmune diseases
Rozanolixizumab已有的临床结果
2019年12月7-10日,在佛罗里达州奥兰多举行的美国血液病学会(ASH) 年会上,优时比公布了其抗FcRn抗体Rozanolixizumab的最终II期临床研究结果。
此次开放标签II期临床研究(NCT02718716)的目的是评估rozanolixizumab治疗原发免疫性血小板减少症的安全性和有效性。主要终点是rozanolixizumab的安全性和耐受性,次要终点是临床疗效(血小板计数的改变)和药效动力学指标(IgG水平的改变)。
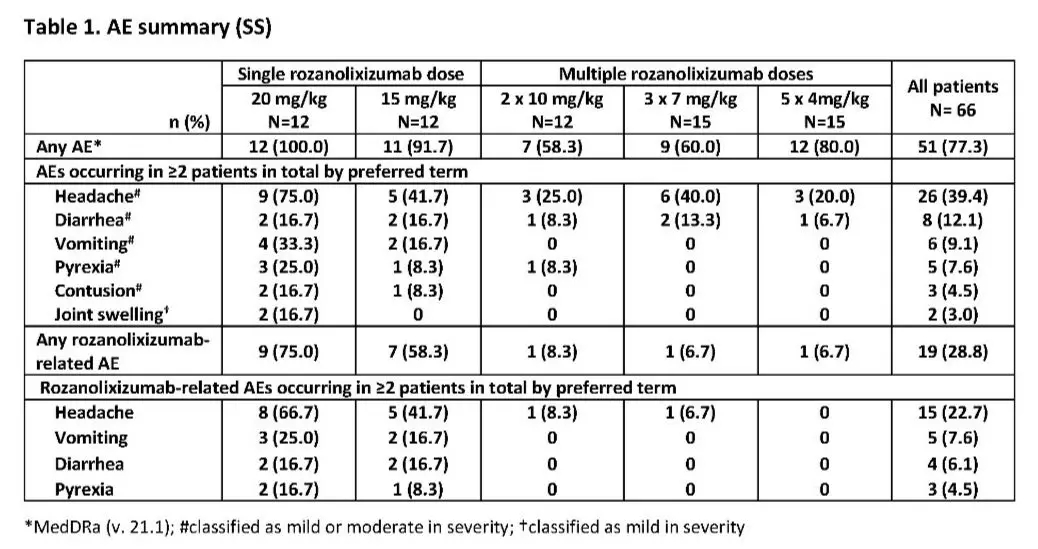
主要安全性终点方面,66名受试者中,65人完成了研究(1人疗效不佳而终止,属于4mg/4kg 多剂量队列)。总体而言,77.3%(51/66)的患者遭遇了一次或以上的不良事件,主要为轻至中度头痛(26/66 39.4%)。4名遭遇严重不良事件的患者均与治疗无关:1例生殖道出血(4mg/kg组)、1例血小板减少症(10mg/kg组)、1例血小板减少症(15mg/kg组)和1例血小板计数降低(15mg/kg)。每个多剂量组中的一个患者、15mg/kg组中7/12的患者、20mg/kg组中9/12的患者,报告了与治疗相关的不良事件(多为头痛)。研究中未观察到严重感染。
△不良事件总结
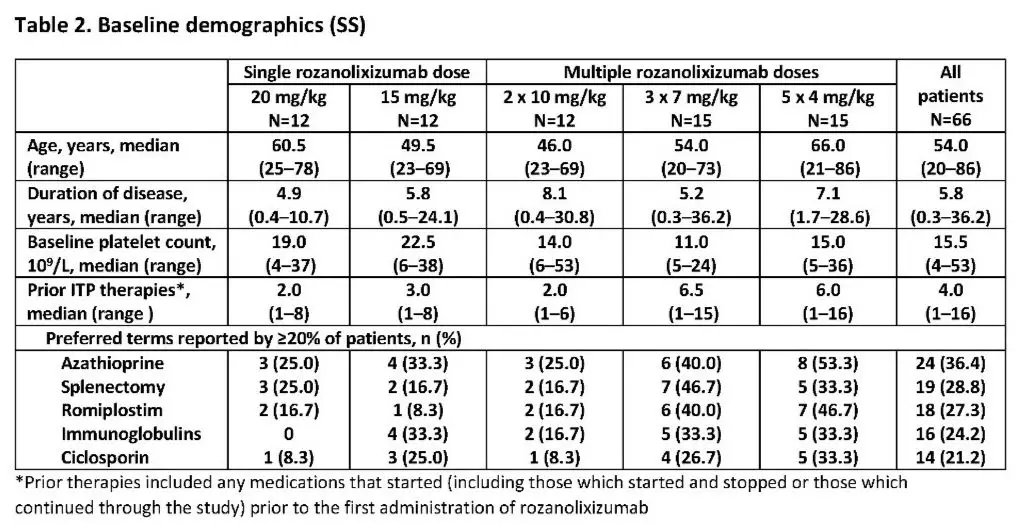
基线疾病特征展现了一个难以治疗的患者群体,这些患者ITP的中位持续时间为5.8年,接受过大约4种ITP疗法治疗。其中30%患者接受过血小板生成素受体激动剂治疗。
△受试者基线基线疾病特征
次要临床疗效终点方面,大多数接受过一剂rozanolixizumab SC输注(15和20mg/kg)的患者血小板计数达到了≥50x109/L (15mg/kg组:8/12 [66.7%]; 20mg/ kg组:6/11 [54.5%; 一位患者除外] ) 。与之相比,接受多次SC输注的患者,血小板计数达到≥50x109/L水平的比例则较少(4mg/kg组:5/14 [35.7%]; 7mg/kg组:5/14 [ 35.7%,一位患者除外]; 10mg/kg组:5/11[45.5%])。
值得注意的是,相比较多次静脉输注组(4,7,10mg/kg组血小板计数水平达到达到≥50x109/L的中位时间分别为14天,14天和8天)来说,接受单剂量rozanolixizumab注射的患者血小板计数水平达到≥50x109/L水平的中位时间明显更短(15, 20mg/kg组血小板计数水平达到达到≥50x109/L的中位时间分别为7天和5天) 。第八天时,15, 20mg/kg组血小板计数达到≥50x109/L水平的人数分别为7/12(58.3%)和6/11(54.5%),其中13/23名患者接受单剂量输注。相比之下,4, 7, 10mg/kg组数据分别为1/14(7.1%),2/14(14.3%)和3/11(27.3%),其中6/39名患者接受多次输注。
结果显示,在15和20mg/kg组中,观察到了血小板计数呈剂量依赖性增加,峰值中位计数为>100x109/L。
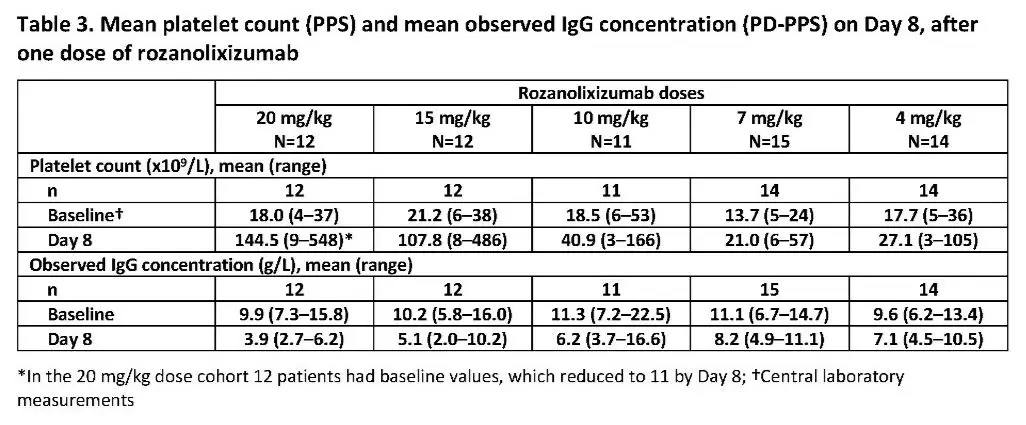
此外,本次研究还观察到了第八天时血清IgG平均浓度呈剂量依赖性下降。20mg/kg单剂量组血清IgG水平在第八天达到最低(平均IgG浓度:3.9g/L,较基线下降5.9g/L[60%])。而5x4mg/kg多次注射组血清IgG水平在第29天才达到最低水平(平均IgG浓度:5.6g/L,较基线下降4.0g/L[43.6%])。
探索性分析显示,根据基线与第8天数据,血清IgG降低幅度与相应的血小板升高有关。
△注射一剂rozanolixizumab后第八天平均血小板计数和平均IgG浓度
总而言之,rozanolixizumab在所有剂量组中均展现了良好的耐受性,高剂量组出现轻中度头痛副作用,但没有患者因为副作用而中断试验。所有剂量组中都观察到了血小板计数的上升和IgG水平的下降,而单次SC输注组相比多次输注组在达到这些疗效终点时时间更快,频繁更高并且数字上的改善水平更好。这些安全性、耐受性和有效性数据支持了未来开展rozanolixizumab治疗ITP的III期临床研究。
参考资料:
1. NMPA,CDE
2. Rozanolixizumab, an Anti-FcRn Antibody: Final Results from a Phase II, Multiple-Dose Study in Patients with Primary Immune Thrombocytopenia, Tadeusz Robak, MD, Maciej Kaźmierczak, Isidro Jarque, et al., ASH.
3. UCB Presents Final Results from Phase II Study of Rozanolixizumab in Primary Immune Thrombocytopenia (ITP) at 2019 ASH Annual Meeting
4. Next-generation Fc receptor–targeting biologics for autoimmune diseases, Adrian W.Zuercher, RolfSpirig, AdrianaBaz Morelli, TonyRowe, FabianKäsermann, et al., Autoimmunity Reviews.