CAR-NK细胞疗法技术与研发现状
自然杀伤细胞(Naturekiller cell,NK细胞)由Ronald Heberman于1975年发现。NK细胞对靶细胞的杀伤并不需要特异性的激活,仅凭对靶细胞的识别便可启动杀伤过程,这也是其名称“自然杀伤”一词的由来:
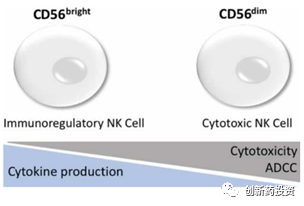
NK细胞主要来源于骨髓CD34+淋巴细胞,约占外周血淋巴细胞总数的10%~20%,NK细胞不表达特异性抗原识别受体,是不同于T细胞、B细胞的第三类淋巴细胞。目前NK细胞的定义为TCR-、mIg-、CD56+、CD16+的淋巴细胞,根据CD56表达水平的高低可将NK细胞分为2个细胞亚群:CD56dim和CD56bright,其功能有所不同:
CD56brightNK细胞亚群约占NK细胞总数的10%,主要聚集在次级淋巴组织及非淋巴组织中聚集,可分泌大量细胞因子如IFN-γ、IL-12、IL-15和IL-18等发挥免疫调节作用;而CD56dim NK细胞亚群约占NK细胞总数的90%,高表达FcγⅢ受体,主要通过抗体依赖的细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity,ADCC)来直接杀伤靶细胞。
01
NK细胞的杀伤机制
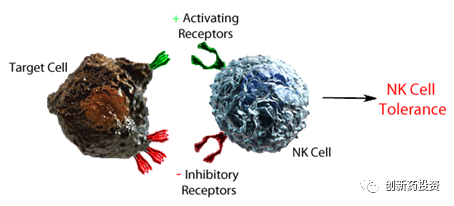
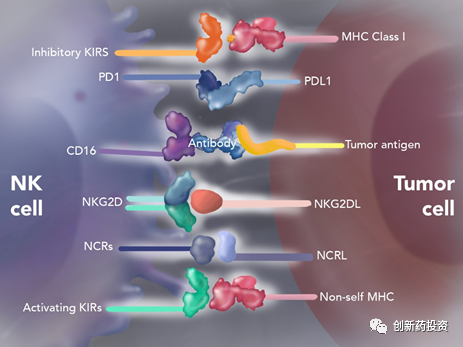
与T细胞的杀伤作用机制不同,NK细胞的杀伤活性受细胞表面的抑制性受体和激活性受体的共同调控,当激活与抑制的平衡被打破,NK细胞便会行使相应的功能。当靶细胞表面表达足够的抑制性配体时,此时NK细胞的功能是受到抑制的:
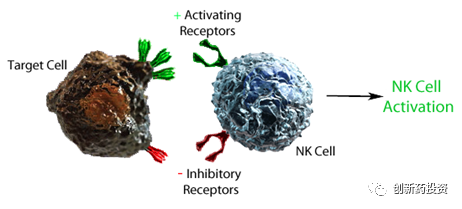
而当靶细胞表面的激活性配体表达量发生上调、或当靶细胞表面的抑制性配体的表达水平发生下调时,NK细胞的杀伤功能变得到激活:
具体来讲,NK细胞表面的抑制性受体(主要是抑制性杀伤性Ig样受体KIRs和异二聚体C型凝集素受体NKG2A)可与靶细胞表面的MHC I结合并传递抑制信号,从而使NK细胞进入“沉默”状态;而NK细胞表面的激活性受体(主要是NCRs、NKp46、NKp30、NKp44和NKG2D)与可与细胞表面的特异性激活配体结合,从而激活NK细胞:
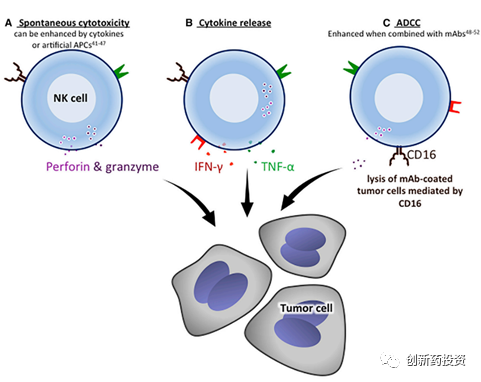
NK细胞主要通过三种机制杀伤靶细胞:
-
通过释放含有穿孔素和颗粒酶的细胞质颗粒直接杀伤靶细胞
-
释放细胞因子,如IFN-γ、TNF-α等,通过与肿瘤细胞表面相应受体的相互作用诱导肿瘤细胞凋亡。
-
Fc受体CD16与抗体的Fc段结合,可激发抗体依赖的细胞介导的细胞毒性(ADCC)来杀伤细胞。
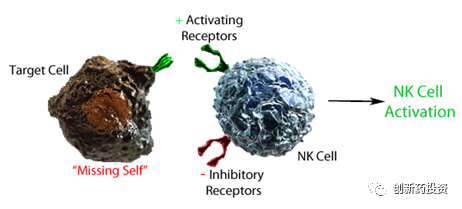
生理情况下,NK细胞抑制性受体识别正常组织细胞表面广泛表达的MHC-Ⅰ类分子而使NK细胞功能受到抑制,无法杀伤自身正常组织细胞。在肿瘤组织中,一方面肿瘤细胞表面MHC-Ⅰ类分子表达通常发生下调,另一方面活化受体的配体如NKp30、NKp44、NKp46等表达上调,这两方面的因素将导致NK细胞活化最终杀伤肿瘤细胞。
02
CAR-NK技术
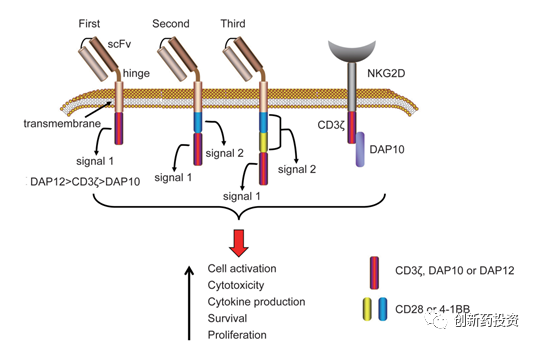
CAR-NK细胞的CAR结构通常也由三部分组成,即胞外抗原结合区(一般为scFv)、跨膜结构域以及胞内激活结构域,这与CAR-T细胞疗法中使用的CAR结构十分类似甚至雷同(事实上,目前的很多研究直接是把CAR-T中成熟的CAR结构在NK细胞系中表达来制备CAR-NK)。根据胞内区域的不同,CAR结构已经发展到第三代:
抗原结合区:抗原结合区决定CAR-NK的特异性和靶向性,通常该部分由单克隆抗体抗原结合区scFv构成,与靶细胞表面的特异性抗原结合,从而识别肿瘤细胞。目前为止,已有多种靶点展开临床试验,如CD19,CD20,CS1,EGFR/EGFRⅧ,ErBb2/HER2,CD3,CD138等。与CAR-T中常见的CAR结构相比,CAR-NK还可以选择NKG2D作为CAR结构的识别结构域,原因是肿瘤中普遍发生NKG2D的配体NKG2DL表达的上调。
跨膜区:跨膜区的作用是将胞外的信息传递到胞内,现在最常见的为CD3ζ跨膜序列,HLA-A2以及CD8也越来越多的作为跨膜序列应用。
胞内信号区:胞内信号区决定着活化信号的强弱,直接影响杀伤效果。第一代CAR结构使用CD3ζ做为胞内段。它由3个免疫受体酪氨酸激活基序构成。在第一代的基础上串联入1个或2个激活结构域,如:CD28,CD137,4-1BB等,形成第二代和第三代CAR结构。
03
NK细胞的来源
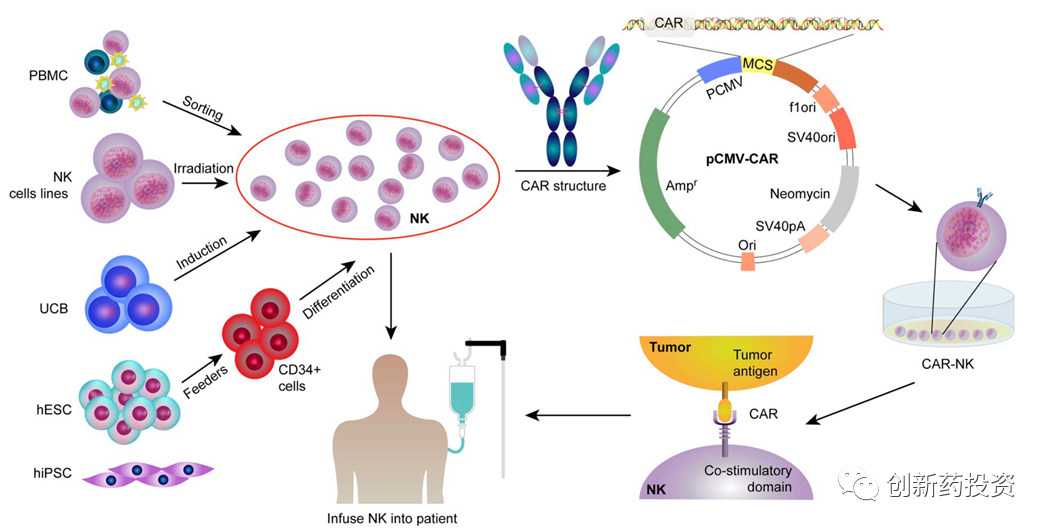
目前研究中使用的NK细胞有三种来源:外周血分离、NK细胞系培养、干性细胞分化:
外周血来源(自体或异体)
目前已有较为成熟有效的方法从外周血中纯化扩增足够量的NK细胞用于过继性免疫治疗。(近岸蛋白质:全人CD16单抗、IL-15/IL-12/IL-7/IL-21/IL-18, GMP级现货供应:400-600-0940)。自体NK细胞和异体NK细胞都可以进行CAR修饰,但它们的细胞特性并不相同:异体NK细胞供者血液中存在着以T细胞为主的其他淋巴细胞,这些杂细胞的存在会引起移植物抗宿主病(graft versus host disease,GvHD)。因此在用于治疗之前,必须要清除T细胞。但是,异体NK细胞由于表面杀伤细胞免疫球蛋白样受体(killer-cell immunoglobulin-like receptors,KIRs)与患者HLA-Ⅰ类分子并不匹配,因此并不会产生抑制信号引起干扰,所以异体NK细胞会保持较为持久的杀伤效果。自体CAR-NK细胞回输后,其抑制性受体与自体正常细胞表达的HLA-Ⅰ类分子结合而产生抑制信号,会抑制NK细胞的杀伤效应。虽然肿瘤细胞丢失了经典的HLA-Ⅰ类分子,但是非经典的HLA-Ⅰ类分子HLA-G、HLA-E等的表达,同样能够抑制NK细胞的活化。
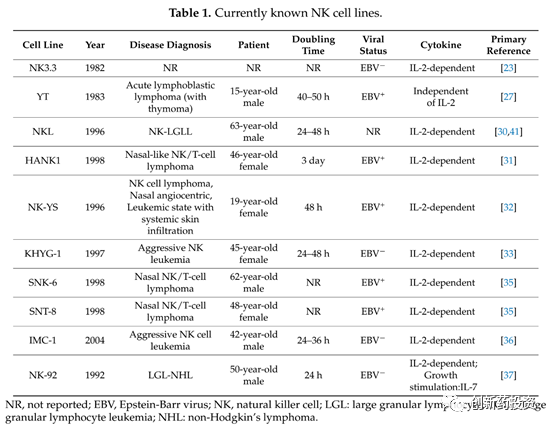
NK细胞系
NK细胞有许多成熟的细胞系,包括NK-92、NKG、YT、NK-YS、HANK-1、YTS和NKL等,NK细胞系体外扩增得到的细胞群体一致性更好,且NK细胞系并不涉及分选纯化步骤。目前已有的NK细胞系列表如下:
NK-92细胞系是目前在CAR-NK中研究最为广泛的细胞系,于1992年从1例50岁的非霍奇金氏淋巴瘤男性患者体内分离得到,生长呈IL-2依赖性。与原代NK细胞相比,NK-92细胞系最大的优势在于其表面的抑制性受体(如KIR)表达很低,抑制性受体信号的缺失使得其对多种肿瘤的杀伤能力要优于原代NK细胞或者经细胞因子活化的其他杀伤细胞。此外,NK-92在实体瘤治疗中也有一定的潜力。CAR-T在实体瘤中效果不佳的重要原因是肿瘤细胞高表达PD-L1与T细胞表面的抑制分子PD-1结合进而抑制了其杀伤活性,而NK-92表面抑制性受体的缺失使之能够避免类似抑制信号的干扰。但是NK-92也存在着一些明显的缺点,例如潜在的致瘤性和EB病毒易感性等,因此,NK-92必须经过辐照后才能够使用。
干性细胞分化的NK细胞
除了NK细胞系和外周血来源的NK细胞之外,诱导多能干细胞、脐带血和胚胎干细胞等干性细胞分化而来的NK细胞同样具有供CAR修饰的潜力。干性细胞分化而来的NK细胞的表型与外周血来源的NK细胞较为相近且其生长能力更强,且细胞纯度较高,是一种较好的NK来源。
不同来源的NK细胞对比如下:
04
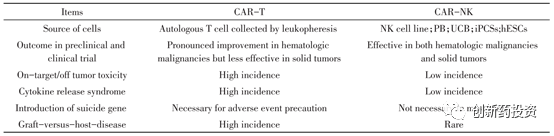
CAR-NK与CAR-T对比
目前所广泛研究和使用的CAR-T疗法为自体CAR-T细胞,具有许多局限性。如:
-
病人负担大:让病人提供自体CAR-T细胞产品所需的T细胞不仅会对病人造成负担,而且在临床使用中也具有很大的局限性。
-
制备时间长:CAR-T细胞的制备通常需要数周之久,这对于治疗病情迅速发展的病人显得不切实际。
-
可能无法获取足够的细胞:化疗、放疗等治疗会极大减弱病人的免疫系统,因此临床实践中并不总能收集到足够的T细胞。
虽然同种异体T细胞可以克服以上这些临床挑战,但仍有造成GVHD的极大风险。
与T细胞相比,NK细胞应用于过继细胞治疗有很多优势:
-
过继性转输自体或者同种异体的NK细胞在体内的持续时间较短,一般只有几天或几周,所以一些危害生命的毒性(如细胞因子释放综合征,CRS)几乎不可能发生。
-
目前的临床研究显示CAR-NK细胞不会产生GvHD(移植物抗宿主病),因此安全性较高
-
同种异体CAR-NK获取方便,质量均一且时效高,副作用小(即使是异体CAR-NK也不会产生明显的GvHD)。个人认为异体CAR-NK方便快捷且副作用小是CAR-NK最明显的优势之一
CAR-T与CAR-NK其它方面的对比如下:
05
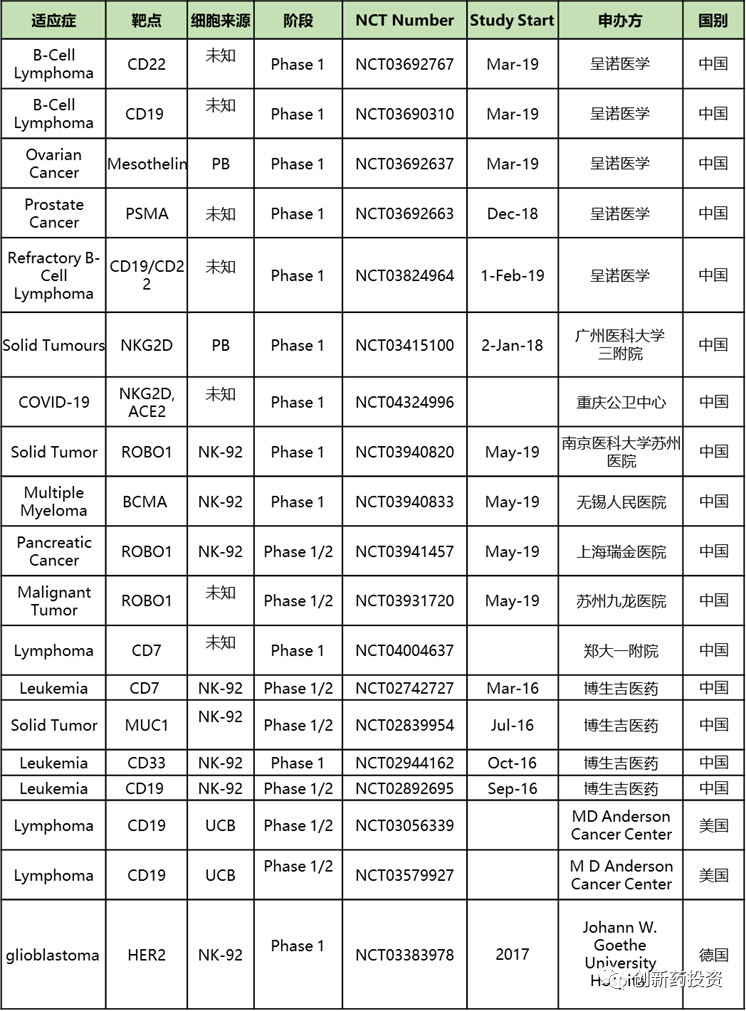
CAR-NK细胞的研究现状
目前尚未有上市的CAR-NK细胞产品,与CAR-T相比,CAR-NK细胞的研发管线数目较少。在clinicaltrials.gov以“CAR NK”为关键字进行检索可发现,目前共有19项CAR-NK相关的临床试验正在进行,其中中国进行的临床实验共19项,如下表所示。中国共有2家公司举办CAR-NK细胞疗法临床试验,分别是北京呈诺医学科技有限公司与博生吉医药科技(苏州)有限公司;美国只有MD Anderson Cancer Center的2项临床试验,德国有一家医院上榜。瘤种的选择上,仍以非实体瘤为主,但在多种实体瘤中已有尝试。细胞来源方面NK-92细胞系占了大头:
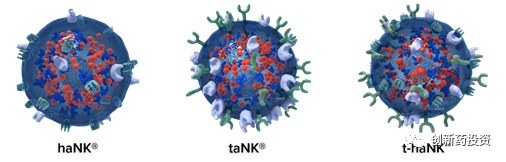
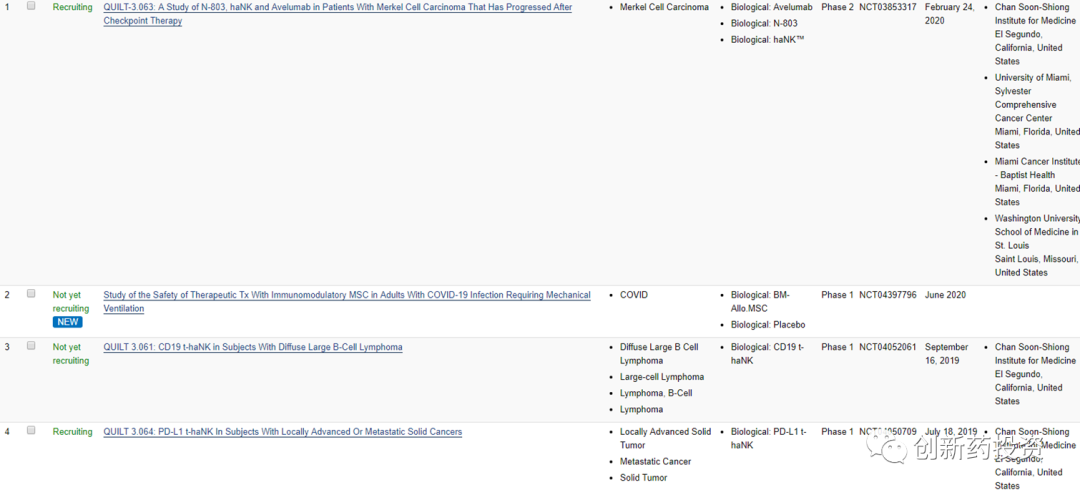
但是,但是,此处要注意,上列表格并不全面!原因在于,有些CAR-NK细胞疗法所使用的细胞名称中不含CAR-NK。。。比如NantKwest这家公司,看名字就知道是一家以研发NK细胞疗法为重点的公司,但人家的技术有自己的名字——haNK、taNK和t-haNK:
所以只以“CARNK”为关键字去检索是没用的,根本搜不到,要以haNK、taNK为关键字进行检索才能检索到NantKwest公司的临床试验:
然而不幸的是,目前大多数综述性论文都没有意识到这一点(如下图所示,反正我看过的每一篇关于CAR-NK的Review都漏掉了不少临床试验),这在宣传上肯定是要出偏差的:
做研究要慎重啊!
参考资料
Pfefferle A, Huntington N D. You Have Got a Fast CAR:Chimeric Antigen Receptor NK Cells in Cancer Therapy[J]. Cancers, 2020, 12(3):706.
Engineering Natural Killer Cells for Cancer Immunotherapy
Wang W, Jiang J, Wu C. CAR-NK for tumor immunotherapy:Clinical transformation and future prospects[J]. Cancer Letters, 2020, 472:175-180.
刘兵, 周美龄, 刘韬. CAR-NK 治疗肿瘤的研究与临床进展[J]. 中华细胞与干细胞杂志 (电子版), 2018 (5): 8.
Kloess S, Kretschmer A, Stahl L, et al. CAR-expressingnatural killer cells for Cancer retargeting[J]. Transfusion medicine andhemotherapy, 2019, 46(1): 4-13.
Hu Y, Tian Z, Zhang C. Chimeric antigen receptor(CAR)-transduced natural killer cells in tumor immunotherapy[J]. ActaPharmacologica Sinica, 2018, 39(2): 167-176.