NK细胞的“叛变”
无论是单克隆抗体的Fc区域的ADCC效应,还是近些年一直热度不减的NK细胞疗法,都是基于一个基本的观念:NK细胞是以肿瘤清除者的身份存在于肿瘤微环境的。但前段时间《Journal of Cell Biology》杂志的一篇文章告诉我们,NK细胞能够扮演的角色未必是简单纯粹的。
这篇文章报道的工作的出发点是深入探究乳腺癌细胞转移的过程及其机制。抑制性的肿瘤微环境对于癌细胞转移的发生自然是至关重要的前提,但之前的临床试验结果表明,免疫检查点的抑制并不能充分恢复肿瘤微环境对乳腺癌细胞的抑制。于是,他们把重点转向肿瘤免疫的重要组成部分、固有免疫系统的关键组分——NK细胞,尝试揭示乳腺癌细胞是如何逃脱NK细胞的免疫调控的。他们使用的癌细胞是K14+乳腺癌细胞(keratin-14蛋白的高表达定义了一小群能够集体侵袭、系统地扩散和远端定殖的乳腺癌细胞)。
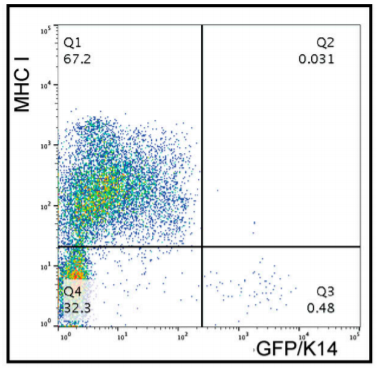
首先,他们从转基因小鼠中分离出K14+乳腺癌细胞和K14-乳腺癌细胞。在分离的过程中,他们发现癌细胞的K14+表达量和MHC I表达量呈现反相关关系,这意味着K14+细胞对NK细胞介导的细胞毒作用是易感的。
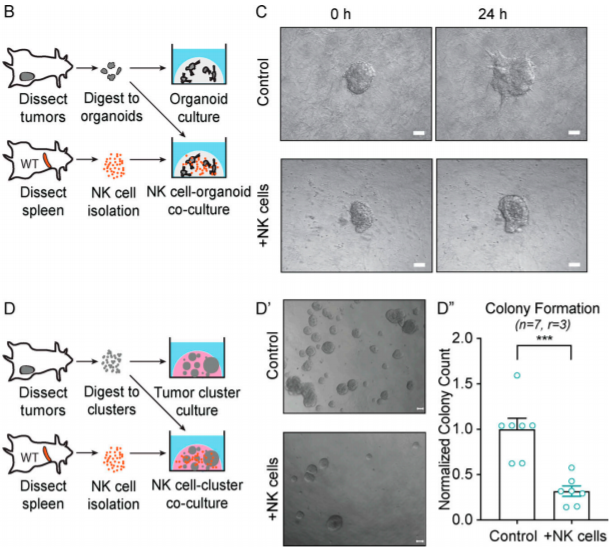
于是,他们基于体外共培养系统,检测从健康小鼠体内分离的NK细胞对K14+细胞的抑制作用。结果显示,NK细胞既能够抑制K14+肿瘤organoid的侵袭,又能够抑制K14+细胞的克隆形成。
并且,通过与K14-细胞的对比,他们证明NK细胞可以特异性地促进K14+细胞的凋亡,且促凋亡的作用能够通过ADCC作用增强。
但同时,它们发现,经过36-48小时的共培养后,有一部分迁移过程中的organoid和形成的克隆是能够在NK细胞的细胞毒作用下存活下来的。他们认为在这过程中,癌细胞在诱导NK细胞发生重编程。
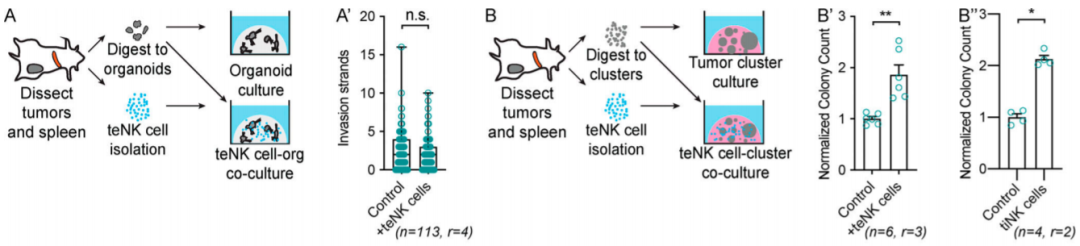
为了验证这个假设,他们从荷瘤小鼠体内分离NK细胞(称为“Tumor-exposed NK”,简称“teNK”),与癌细胞共培养。结果显示,这些teNK细胞不仅不能抑制肿瘤organoid的侵袭,甚至会促进癌细胞的克隆形成。
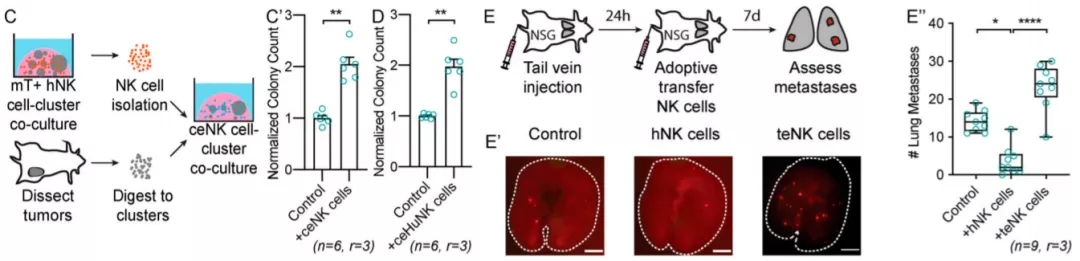
随后,他们从荷瘤小鼠中分离肿瘤浸润性NK细胞(“Tumor-infiltrating NK”,简称“tiNK”),与癌细胞共培养,得到了类似的结果。另外,他们将经过共培养的teNK分离出来,与癌细胞进行新的共培养实验,发现这些teNK细胞对癌细胞克隆形成的促进作用比NK细胞更为明显。体内实验也得到了相同的结果。这些实验充分证明了癌细胞对NK细胞的“education”。
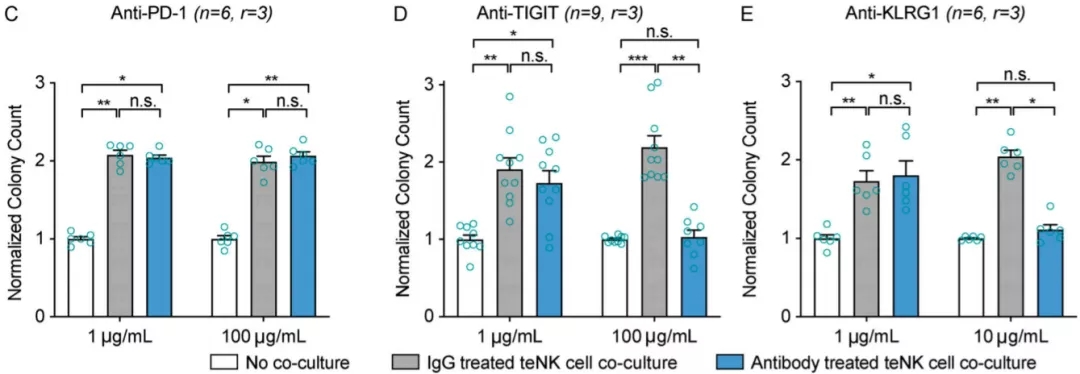
而为了能对药物开发和临床治疗有所启发,研究人员们必须尝试逆转癌细胞对NK细胞的改造现象。基于NK细胞和teNK细胞的RNA-seq数据,他们通过分析和推理,锁定了包括TIGIT和KLRG1在内的几个靶点。实验证明,anti-TIGIT或anti-KLRG1的单克隆抗体能够抑制teNK诱导的癌细胞克隆形成,而anti-PD-1的抗体则没有明显的效果。
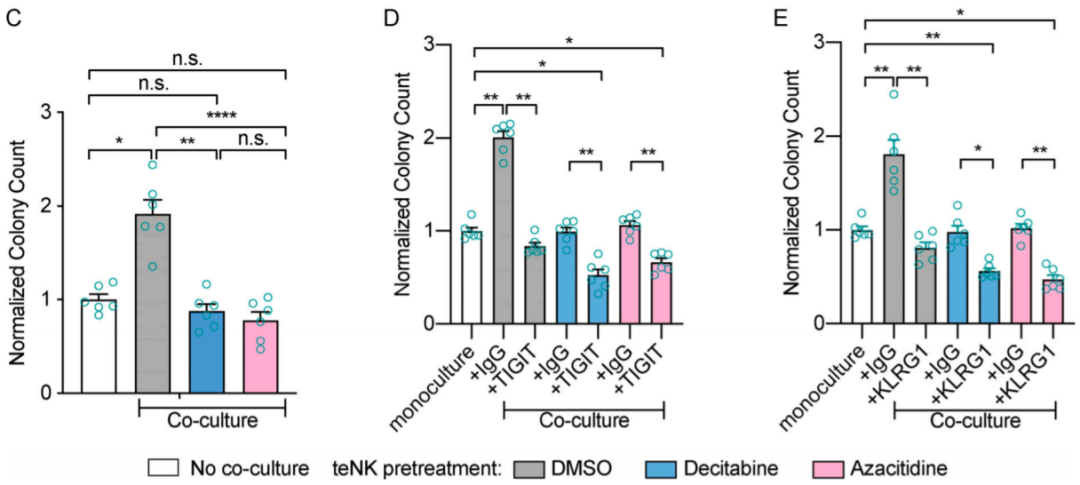
最后,他们还找到了NK细胞重编程过程的表观遗传层面的调控因子,3个DNA甲基转移酶,并用甲基转移酶抑制剂进行了验证,且进一步证明了甲基转移酶抑制剂与anti-TIGIT或anti-KLRG1抗体的协同作用。
总而言之,该工作揭示了乳腺癌细胞通过抑制NK的抗肿瘤作用进一步逃脱免疫系统的调控从而实现转移的可能机制,并为未来相应的治疗方法的开发做了初步的探索。
总结
虽然这份工作从科学机理到治疗方法的尝试距离真正临床还有距离,但极大丰富了我们对NK细胞的作用乃至整个肿瘤微环境有了一个全新的认识,对于今后的肿瘤治疗具有非常重要的指导意义。
另外,不得不承认,围绕NK细胞的肿瘤免疫时代不仅已经到来,而且仍然有足够的发展后劲。