基因治疗试验:2名儿童连续死亡,高剂量AAV毒性敲响警钟?
在2020年美国基因与细胞治疗学会(ASGCT)虚拟会议召开一周前,罕见疾病和基因治疗领域发生了一场悲剧:
5月6日,基因治疗公司Audentes(去年被安斯泰来收购)AT132用于治疗X连锁肌管肌病(XLMTM)的ASPIRO试验(NCT03199469)中,一名儿童死于败血症。FDA已经介入了这项调查,以确定是否与大剂量腺相关病毒(AAV)治疗有关。
不幸的是,6月23日,在同一队列中的另一名儿童,接受相同剂量的AAV,也因治疗而死于败血症。
不过,在此前,Audentes在MTM 2犬模型中产生了令人印象深刻的疗效研究,并在进入临床试验之前进行了非灵长类(NHP)安全性研究。而最初的6名MTM患者以1×1014基因组拷贝(GC)/ kg的剂量接受研究,结果也令人鼓舞。但是,此次所有6名患者均以高三倍剂量(即3×1014 GC / kg)给药出现了严重的肝毒性,且在其中2名患者中被证明具有致命性。
前车之鉴
基于腺伴随病毒(AAV)的产品Zolgensma于2019年获FDA批准用于治疗1型脊髓性肌萎缩症(SMA)婴儿的成功,支持了婴儿高达1×1014 GC / kg输注的安全性和有效性。然而,在一些参加杜氏肌营养不良症(DMD)基因治疗试验的受试者中,使用相似高剂量的AAV(Solid Bio,Sarepta和Pfizer),已经观察到潜在的剂量限制毒性。
SMA和三项DMD试验的一些受试者出现了血小板的急性但短暂的下降,少数患者需要进一步治疗。这些试验对象中的一些还出现了可逆性和无症状肝损害,在大多数情况下是轻度的。但是,Solid Bio试验中的两名受试者和Pfizer试验中的一名受试者由于溶血和肾衰竭而发展为贫血,与溶血-尿毒症综合征相关的补体疾病一致。两项DMD试验中的几名受试者均提供了补体激活的实验室证据。2名肾功能更严重的患者需要透析。幸运的是,所有受试者都康复了。
2018年初,报道了注入高剂量AAV(即2×1014 GC / kg)的非人类灵长类动物(NHP)的严重毒性。与SMA和DMD试验中的观察结果相似,NHP的血小板急性降低,转氨酶水平轻度升高。虽然大多数动物没有症状,而且实验室异常得以解决,但少数动物发展成严重的肝损伤综合征和凝血病,导致弥漫性出血和休克,需要安乐死。
目前,有关2名Audentes MTM受试者死亡的详细信息有限,尽管看起来所观察到的毒性更类似于NHP研究而不是DMD试验。不过导致这些毒性的确切机制仍是未知的,但一些假说集中于在载体注入后预先存在或迅速积累的抗AAV抗体的作用。载体-抗体复合物的形成可以通过经典途径激活补体,或者通过抗原呈递细胞中的Fc依赖性摄取来激活先天免疫。实际上,研究表明,在1999年将腺病毒载体输注到鸟氨酸转氨甲酰酶缺乏症患者Jesse Gelsinger中观察到致命的全身性炎症,部分原因是由于存在预先存在的抗腺病毒抗体与注入的载体形成免疫激活复合物。
在基因治疗方兴未艾的关键时刻,我们必须迅速而冷静地查清真相,这一点很重要。并采取保护措施以防止类似事件再次发生。
疾病:XLMTM
XLMTM是新生男童中罕见的神经肌肉疾病。患者会出现严重的肌肉无力和肌张力低下,从而导致呼吸衰竭和进食困难。XLMTM通常是致命的。XLMTM是由MTM1基因突变引起,该基因编码肌管蛋白,后者是正常骨骼肌功能的必需蛋白。
衣壳:AAV8
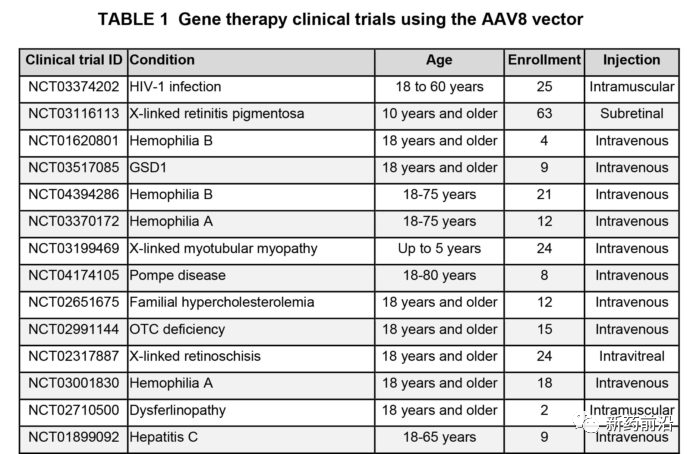
表达治疗性MTM1有效载荷的实验基因治疗药物AT-132包装在AAV8衣壳中用于治疗XLMTM。这是基因治疗中非常常用的衣壳血清型。根据ClinicalTrials.gov的资料,迄今为止进行的180项AAV基因介入治疗试验中,有14例使用了AAV8(表1)。重要的是,迄今为止,已有近250例接受AAV8治疗的患者有各种适应症,没有发生这种级别事故的其他严重不良事件,突显了该衣壳迄今为止良好的安全性。
剂量:3×<span 14vg/kg
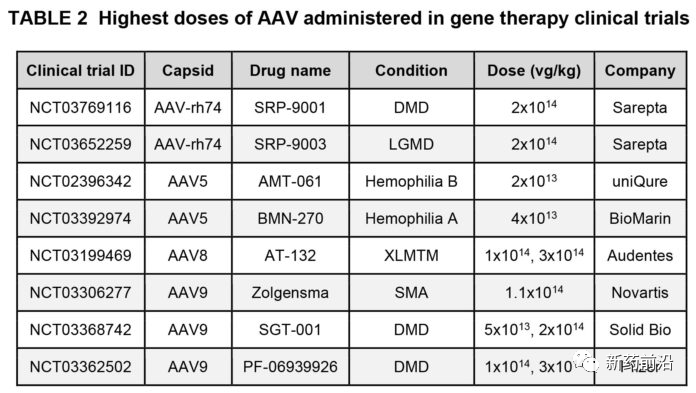
死亡的2名男孩都是ASPIRO试验的大剂量组。通过静脉内给药,他们每千克体重接收3×1014vg/kg个载体基因组(vg/kg)。这是有史以来对成人或儿童施用的最高AAV剂量之一(见表2)。根据试验申办者的声明,两名男孩均处于年龄的上限(小于5岁)。
举例来说,如果我们假设这些男童是4岁,并且在给定的情况下处于该年龄段的正常体重的较低范围内,那么他们可能重约13.5千克,并且将接受过量的剂量4×1015vg。换句话说,这就是4千万亿病毒。这是对含有基因组的颗粒的测算。AT-132批次中的空衣壳数量尚未公开,这将使“AAV8”的剂量负荷进一步增加。(基因治疗领域尚无通用的标准化方法来滴定AAV载体,因此应将这些(以及所有AAV剂量)视为近似值)。
严重不良事件:败血症死亡
大剂量AT-132队列中的3名男孩患有严重的肝胆疾病。其中2名男孩死于细菌感染和败血症。尽管XLMTM是骨骼肌疾病,但医疗并发症通常包括许多其他器官系统,包括肝脏。据报道,2名死亡的男童都有某种形式的既往肝胆疾病(未指明)。这可能是相关的,因为不管最终的靶器官是什么,几乎所有的AAV疗法都是通过静脉内输送到肝脏。因此,肝脏必须处理这些大剂量的病毒,这肯定会引起毒性,特别是如果肝脏事先受损。
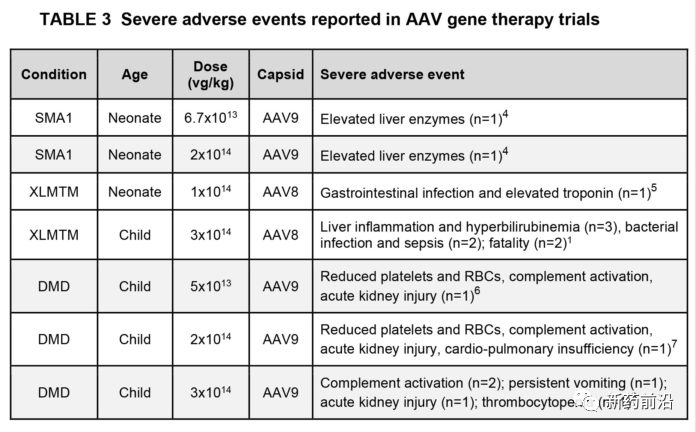
相关地,接受高剂量全身AAV的患者中还发生了其他几种严重不良事件(严重程度不同)(表3)。这些在很大程度上是由于先天免疫反应(例如炎症和补体激活)和静脉内给药后几天至几周对载体的细胞免疫反应引起的。
我们不知道的
目前尚不清楚在ASPIRO试验中AAV8载体如何生产,使用了何种纯化方法,以及在此剂量下改变是否可以提高安全性。除了他们符合试验纳入标准(未公开)外,我们不知道这些男孩的抗AAV8衣壳抗体水平是多少。目前尚无用于测定预先存在的抗AAV衣壳水平的标准化方法,这仍然是该领域面临的巨大挑战。作为衣壳,这很重要:抗体复合物可能在上述一些试验中激活了补体。此外,尚未公开这些男孩曾患过哪些肝胆疾病,但据认为在所列试验中并不严重:排除标准包括“临床上显著的潜在肝病”。
离别的思考
现在该谈论高剂量的AAV。首先,这些死亡需要我们所有人确定如何安全使用大剂量AAV(如果有的话)。在短期内,需要更多的临床前研究来更好地预测安全剂量和毒性生物标志物,以及空衣壳水平,制造方法产生的杂质和不同纯化策略等参数的影响。
从长远来看,我们需要将重点从“如何安全使用大剂量”转移到“如何设计载体,以降低类似事件(死亡)发生”。这将需要在多个方面取得进展,包括:
-
工程化衣壳,可以更好地放置到目标器官
-
用于组织/环境特异性和可调节控制的新启动子和调节元件
-
安全的制造方法,可以同时放大到以满足生产需求,同时减少杂质(宿主蛋白和不需要的核酸)
-
在载体生产过程中增加对AAV生物学的了解
-
新型且更稳定的反向末端重复序列(ITR)基因组结构
-
更好的纯化方法,以进一步减少杂质负担
-
避免免疫反应的创新策略
-
新的药物递送方法
除工程化之外,我们还必须考虑使用体重来确定剂量是否合适。例如,如果2名体重相同的孩子的疾病严重程度明显不同,是否应该给予相同的载体剂量?或者,与婴儿相比,经历青春期目标器官发育完成的孩子之间有什么区别?或者他们是不同性别的患者?现在,许多研究者已经观察到用AAV进行明显的性别二形性肝转导,因此雄性出现了明显更大的转导,因此可能比雌性表达更高。对于性别二形性转导,至少在确定AAV剂量时我们需要参考一些数据。但是对于围绕不同发育状态和疾病严重程度的给药问题,我们严重缺乏临床前数据。
这2名男童的死亡是毁灭性的,我们向他们的家人和XLMTM社区表示敬意。作为科学研究者和临床医生,要感谢这些男孩,以确保这种情况不再发生。我们希望能够尽快公开更多细节,以便基因治疗界了解发生的事情并设计解决方案以最好地推动该领域的发展。
Audentes声明2020年6月23日(节选)
初步发现表明,(6月23日)死亡的直接原因是败血症。该患者患有以AT132给药后最初4-6周内发生的高胆红素血症为特征的进行性肝功能不全,而此前对标准治疗无反应。该患者因肝功能不全而接受积极治疗,包括住院和密切的临床观察。不幸的是,他的病情恶化,最终因细菌感染和败血症死亡。目前正在收集有关死亡的其他信息。
就像我们上个月(5月6日)分享的患者死亡案例一样,该患者也是三名接受AT132剂量3×1014vg/kg的年龄较大患者之一,我们最近观察到了新的肝胆疾病严重不良事件(SAE)。尽管有关这2例死亡的调查仍在进行中,但初步报告表明,2名死亡的患者的临床过程相似。
3名发生这些SAE的患者中的显著特征包括年龄较大,体重较重,已有肝胆疾病的证据以及以3×1014vg/kg的较高剂量给药。应当指出,在最初接受1×1014vg/kg治疗的6例患者研究中,包括4例先前有肝胆疾病史的患者,尽管已离开治疗多年,但均未出现肝SAE。