专家点评Cell | 许琛琦/黄超兰/惠恩夫合作为CAR T细胞疗法提供新思路
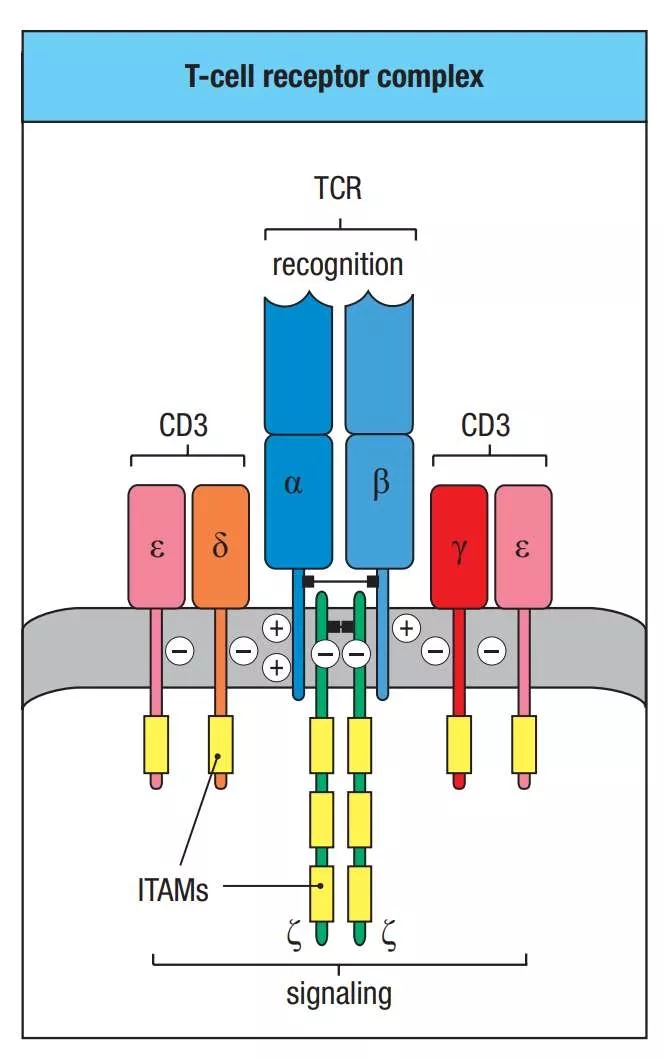
T细胞能特异性识别外来抗原并引发对入侵病原物或者肿瘤细胞的适应性免疫反应。T细胞主要通过T细胞受体(T cell receptor, TCR)来识别抗原,对于大多数T细胞来说,其TCR主要由抗原识别的TCRαβ亚基和三个信号传递的CD3εδ,εγ,ζζ亚基构成(图1)【1-3】。CD3亚基都含有免疫受体酪氨酸激活基序(immunoreceptor tyrosine-based activation motifs,ITAMs; YxxL/Ix6-8YxxL/I),ITAM中酪氨酸的磷酸化可以激活引起下游信号通路【4】。CD3ε,δ和γ亚基每一个都含有一个ITAM基序,而CD3ζ含有三个ITAMs,因此一个完整的TCR-CD3复合体拥有10个ITAMs有20个酪氨酸磷酸化位点来对不同的抗原刺激作出相应反应。CD3 ITAMs主要被Lck磷酸化而被CD45去磷酸化,双磷酸化的CD3 ITAMs可以和Zap70串联SH2结构域结合,解除Zap70的自我抑制,激活下游信号通路【4】。尽管CD3 ITAMs都具有YxxL/Ix6-8YxxL/I序列,但每一个CD3都有不同的序列,表明不同CD3亚基或可具有不同共能。此外,关于CD3亚基中ITAMs种类,数量以及磷酸化位点的多少是否会对TCR的信号传导有定性以及定量的影响,也颇有争议。
图1 T细胞受体复合物组成示意图【1】
2020年7月30日,中科院上海生物化学与细胞生物学研究许琛琦研究团队和其合作者北京大学医学部黄超兰(Catherine Chiulan Wong)团队以及加州大学圣地亚哥分校的惠恩夫团队在Cell上发表题为Multiple Signaling Roles of CD3ε and Its Application in CAR-T Cell Therapy的文章,通过定量质谱技术,定量检测了TCR激活过程中所有CD3中ITAMs磷酸化情况,发现部分CD3ε ITAM存在单磷酸化现象,并且CD3ε可通过招募Csk发挥抑制性作用,在传统的嵌合抗原受体(chimeric antigen receptor, CAR)中引入CD3ε可以提高CAR T细胞的存活,提高抗肿瘤效果并减轻过多的细胞因子分泌副作用。
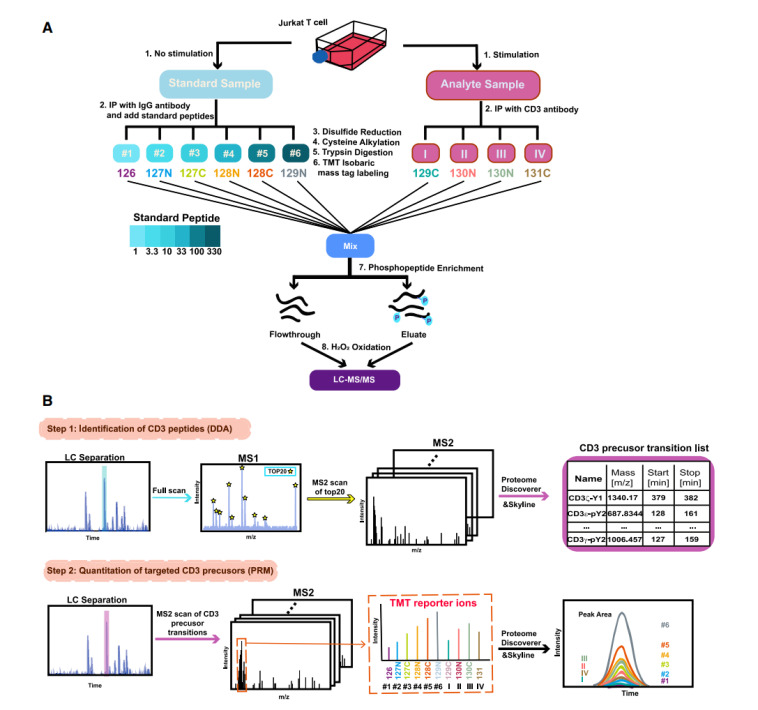
为了对TCR-CD3复合物上所有磷酸化位点同时进行定量检测,研究团队发展了一种targeted-IP-multiplex-light-absolute-quantitative mass spectrometry (TIMLAQ-MS)质谱方法,在一次检测中可以对来自不同时间点刺激样品中所有CD3 ITAMs的磷酸化位点进行绝对定量。在TIMLAQ-MS中,6种不同浓度的合成的磷酸化和非磷酸化的CD3肽段作为标准品和来自四个不同时间点刺激的T细胞的TCR-CD3样品同时进行质谱样本的处理标记和检测。利用标准品做出每一个磷酸化位点的标准曲线,进一步确定每一样品中CD3 ITAM磷酸化情况(图2)。
图2 TIMLAQ-MS样品处理及检查测示意图
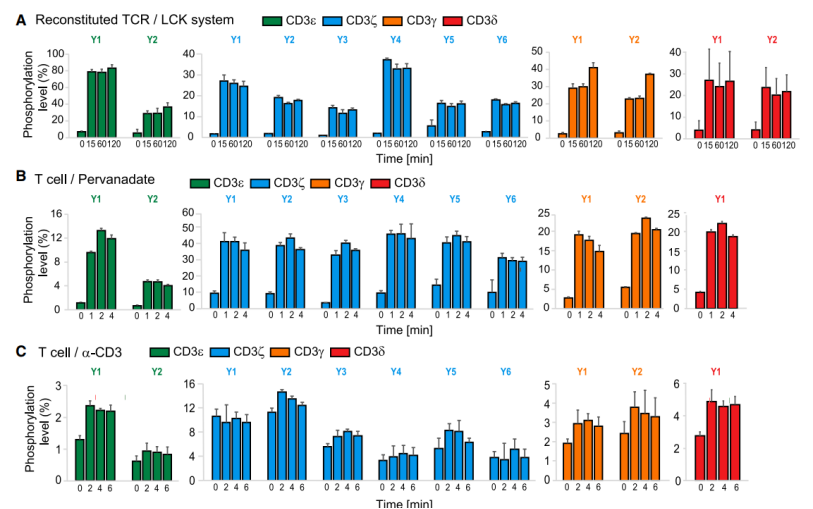
CD3 ITAMs主要被Lck磷酸化而被CD45去磷酸化,因此研究团队设计了三种刺激条件研究这两个因子对CD3 ITAMs磷酸化的影响:(1)T细胞直接被α-hCD3ε (OKT3)刺激,研究Lck和CD45同时存在条件下CD3的磷酸化;(2)利用磷酸酶抑制剂pervanadate刺激T细胞,研究Lck对TCR磷酸化的调控;(3)利用cell-free的大单层囊泡系统(large unilamellar vesicles,LUVs)重构TCR/Lck,在无细胞的膜系统中研究Lck对TCR磷酸化调控。质谱结果显示,除了CD3δ-Y2位点外,几乎所有CD3中磷酸化位点都被定量检测到了。总的来说,在三种系统中CD3 ITAM磷酸化模式基本一致,表明Lck是调控TCR磷酸化的主要因子(图3)。但是CD3ζ的三个ITAMs在直接TCR激活的情况下,CD3ζ ITAM1的磷酸化水平比CD3ζ ITAM2/3的要高,表明CD45可能对CD3ζ的三个ITAMs具有选择性(图3)。
图3 不同刺激条件下CD3 ITAMs磷酸化模式
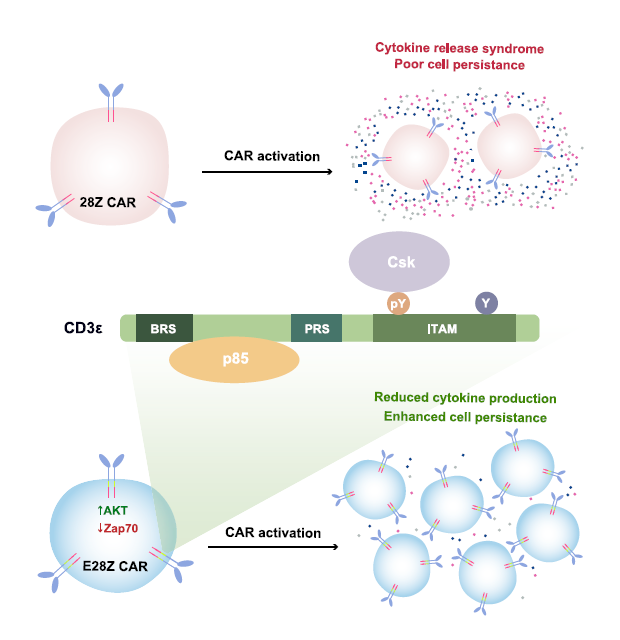
在所有的CD3 ITAMs中CD3ε ITAM在三种条件下都表现出一个更为明显的单磷化现象,CD3ε ITAM膜近端的酪氨酸磷酸化水平比远端更强(图3)。在生理性的抗原刺激情况下,研究团队也同样检测到了CD3ε ITAM的单磷酸化现象。已有研究表明双磷酸化的CD3 ITAMs可以和Zap70结合而单磷酸化的CD3失去结合作用【5】。为研究CD3ε ITAM单磷酸化后结合的蛋白,研究团队分析质谱中和TCR共沉淀下来的含有SH2结构域的蛋白,发现三个抑制性的蛋白,随后通过FRET实验证明CD3ε能在磷酸化后和Csk结合。Csk是一抑制性的酪氨酸激酶可以下调Lck的活性,单磷酸化CD3ε和Csk间的相互作用可作为负反馈机制限制TCR的信号转导。
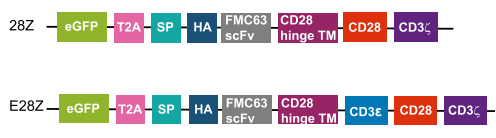
图4 CD19.28Z CAR和CD19.E28Z CAR构造示意图
CAR-T细胞疗法的副作用之一是过量细胞因子的释放,而这在正常的TCR信号通路中却很少见,而现存的CAR设计构建中通常利用CD3ζ来传递信号,研究团队假设将抑制性的CD3ε ITAM引入CAR中或可减少其细胞因子毒性。研究团队在临床批准的CD19.28Z CAR中引入CD3ε命名为CD19.E28Z(图4)。CD19.E28Z CAR T细胞和CD19.28ZCAR T细胞相比,具有相似的细胞表面CAR表达以及CD4/CD8比例,但CD19.E28Z CAR T细胞在抗原刺激之后,细胞因子IL-2,IFN-γ,TNF-α的分泌都较低,且CD19.E28Z CAR T细胞具有较低水平的凋亡程度且具有更高的增值比例,小鼠体内实验表明CD19.E28Z CAR T细胞具有更好的抗肿瘤作用。机制研究表明,CD19.E28Z CAR中CD3ε ITAM序列具有较强的Csk招募能力,通过抑制CD3ζ/Zap70/Plcγ1信号,进而抑制随后细胞因子的分泌。而CD3ε的basic residue rich sequence (BRS)序列可通过招募p85调控AKT信号通路,进而促进CAR T细胞生存和增殖。
总之,本文通过定量质谱对TCR激活过程中CD3 ITAMs的磷酸化模式进行了定量检测,发现TCR激活过程中CD3ε ITAM有单磷酸化的现象,且其可通过招募Csk发挥抑制TCR信号的作用,而CAR中引入CD3ε可以减轻CAR T细胞的细胞因子毒性同时提高CAR T细胞的生存和治疗效果。该研究增加了人们对CD3亚基功能多样性的理解,也为CAR T细胞疗法的发展提供了新的思路和指导。
苏晓磊(耶鲁大学,助理教授)
T细胞在抵抗外来病菌侵染和抗肿瘤免疫中起到重要作用。T细胞受体复合物 (TCR-CD3) 受抗原刺激后,激活T细胞,分泌细胞因子和细胞毒素杀死靶细胞。TCR-CD3由多种亚基组成,其中TCRα,β 亚基与抗原结合,CD3γ, δ, ε, ζ 亚基负责细胞内信号转导。CD3ζ 亚基研究得最为详细,对T细胞激活不可或缺。但是其他CD3亚基的作用还不是非常清晰。
中科院上海生化细胞所许琛琦实验室与北京大学黄超兰实验室以及加州大学圣地亚哥分校惠恩夫实验室合作在CELL杂志在线发表题为“Multiple Signaling Roles of CD3ε and Its Application in CAR-T Cell Therapy”的文章,揭示了CD3ε在抑制TCR激活中的作用。有趣的是,当CD3ε被嵌入CAR以后,能够提高CAR T抗肿瘤活性。这一成果不仅解决了T 细胞领域长期以来留存的一个问题,也为提高CAR T细胞抗肿瘤活性提供了新的工具。
1. CD3ε ITAM 抑制TCR激活
ITAM (immunoreceptor tyrosine-based activation motif)是一个激活T细胞的重要元件,在所有CD3亚基上都有分布。抗原结合TCR以后,激酶Lck磷酸化ITAM上的两个酪氨酸 (双磷酸化), 招募另一个激酶ZAP70, 从而进一步激活下游信号。不同CD3亚基上的ITAM序列略有不同,它们之间的功能差异不甚清楚。本文的研究人员采用了一项名为TIMLAQ-MS的定量质谱方法,精确测定了CD3所有亚基上ITAM被磷酸化的情况。出乎意料的是,与其他亚基上的ITAM被双磷酸化不同, CD3ε上的ITAM有很大一部分只被单磷酸化。单磷酸化的ITAM不能招募ZAP70, 而是招募另一个抑制性的激酶Csk。Csk抑制Lck的活性,从而减弱TCR信号通路的激活。
2. CD3ε提高CAR T抗肿瘤活性
CAR (chimeric antigen receptor)是一个人工合成的嵌合受体。CAR 能够通过胞外域特异性地识别癌细胞表面抗原,从而激活杀伤性T细胞以杀死癌细胞。目前美国FDA已经批准三项关于白血病的CAR T疗法,全球有数百项针对多种癌症的CAR T临床试验在进行中。其中大部分CAR 采用二代结构,即胞内域由CD3ζ加上CD28或者41BB组成。比较两种类型CAR T, CD28-CD3ζ CAR T活性比较高,但耗竭也较快;41BB-CD3ζ CART活性较低,但持续性较好。
鉴于CD3ε ITAM有减弱TCR活性的功能,研究人员猜想将CD3ε嵌入CD28-CD3ζ CAR后,是否可以降低CAR T活性,从而延缓CAR T的衰竭。体外实验结果显示,CD3ε的加入减少了CAR T分泌细胞因子的能力,但是对于靶细胞杀伤功能没有影响。此外,CD3ε增强了CAR T的增殖能力,减少细胞凋亡以及T细胞耗竭标志物PD1的表达。与体外结果相一致,CD3ε增强了CAR T在小鼠体内杀灭肿瘤的能力。进一步机制研究发现,虽然CD3ε ITAM降低CAR T细胞因子分泌,但是CD3ε上的另外一个BRS区域负责招募p85/PI3K, 从而激活AKT信号通路,促进CAR T细胞增殖。
综上所述,这项研究揭示了CD3ε在TCR信号转导和CAR T激活中的两项主要功能,一是通过招募CSk,抑制细胞因子分泌;二是通过招募PI3K,促进CAR T增殖和存活。同时,本项研究也引出了许多后续相关的问题。比如CD3ε ITAM在正常T细胞活化中有何生理功能,是否抑制自身免疫反应?CD3ε是否也能增加41BB CAR的抗肿瘤功能?CD3ε如何影响CAR T细胞的代谢状态和记忆性T细胞的形成?
T细胞信号转导领域在上世纪九十年代经历高潮之后,趋于平稳。如今,伴随癌症免疫疗法(cancer immunotherapy)的突飞猛进,immune checkpoint 和 CAR T发展的需求催生了T细胞信号转导研究的又一波热潮。T细胞信号通路这座金矿的深入挖掘,将为癌症免疫疗法持续提供新的策略和工具。
原文链接:
https://doi.org/10.1016/j.cell.2020.07.018
参考文献
1.Janeway's immunobiology. 9th ed, ed. K. Murphy and C. Weaver. 2017, New York: Garland Science, Taylor & Francis Group.
2.Alcover, A., B. Alarcon, and V. Di Bartolo, Cell Biology of T Cell Receptor Expression and Regulation. Annu Rev Immunol, 2018. 36: p. 103-125.
3.Dong, et al., Structural basis of assembly of the human T cell receptor-CD3 complex. Nature, 2019. 573(7775): p. 546-552.
4.Courtney, A.H., W.L. Lo, and A. Weiss, TCR Signaling: Mechanisms of Initiation and Propagation. Trends Biochem Sci, 2018. 43(2): p. 108-123.
5.Isakov, N., et al., ZAP-70 binding specificity to T cell receptor tyrosine-based activation motifs: the tandem SH2 domains of ZAP-70 bind distinct tyrosine-based activation motifs with varying affinity. J Exp Med, 1995. 181(1): p. 375-80.