近日,美国艺术与科学院、美国国家科学院两院院士Raymond J. Deshaies教授在Nature 杂志发表了题为Multispecific drugs herald a new era of biopharmaceutical innovation的文章[1],对制药行业当前的热点“多特异性药物(multispecific drug)”进行了介绍。该综述简述了现代制药工业的四次革命性浪潮,重点对带来第四次革命浪潮的多特异性药物进行了全面详实的阐述,并强调了其可能存在的挑战。
第一次革命性浪潮,即现代制药工业的起源,可以追溯到20世纪初,以神药阿司匹林的市场营销为标志,这是现代药物发展史上的一个标志性事件。该阶段药物研发强调在培养液或生物提取物中寻找对细胞或有机体有预期治疗效果的活性物质,并对活性物质的化学成分进行鉴定并制成药物。此次浪潮启动了现代制药工业,产生了一大批造福人类的药物。然而这种药物研发方式有其局限性,即药物的分子靶点往往是未知的,因此很难优化药物以增强其疗效或耐受性,或预测药物协同组合。
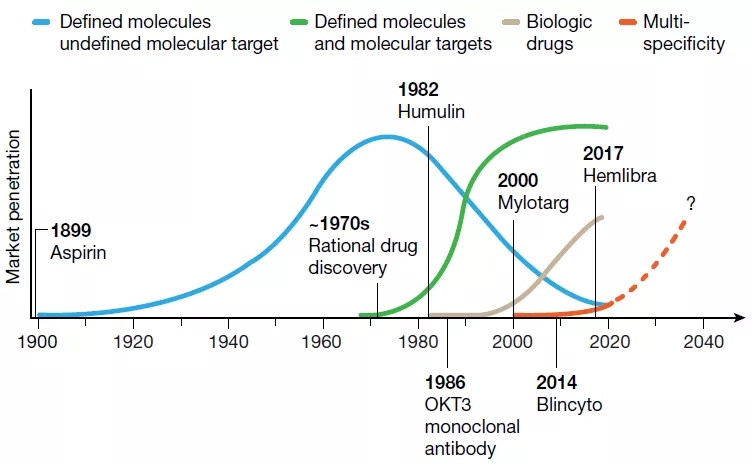
图1 现代制药工业史的四次革命性浪潮,来源于参考文献[1]
第二次革命性浪潮从20世纪70年代开始,以理性药物发现方法学取代经典的经验药理学为标志。这种药物研发方式的核心是一个靶点一个药(one target one drug,1T1D),即先明确一个靶点,然后针对该靶点进行药物筛选和设计。1T1D方法的使用,加上高通量筛选和基于结构的药物设计,已经很好地应用于制药行业,并催化了数百种小分子和生物药物的开发。Squibb开发的血管紧张素转换酶抑制剂——卡托普利便是一个典型案例。
第三次革命性浪潮从20世纪80年代开始,以基于重组蛋白的治疗药物为标志。重组DNA方法的发明开启了生物技术产业,1982年,第一个重组人胰岛素(humulin)获得批准;1985年,第一个单克隆抗体muromonab被用作治疗试剂。虽然重组蛋白药物在结构上比小分子复杂,但这两种药物的作用机制相似,都与预定的分子靶点结合并调节其功能。
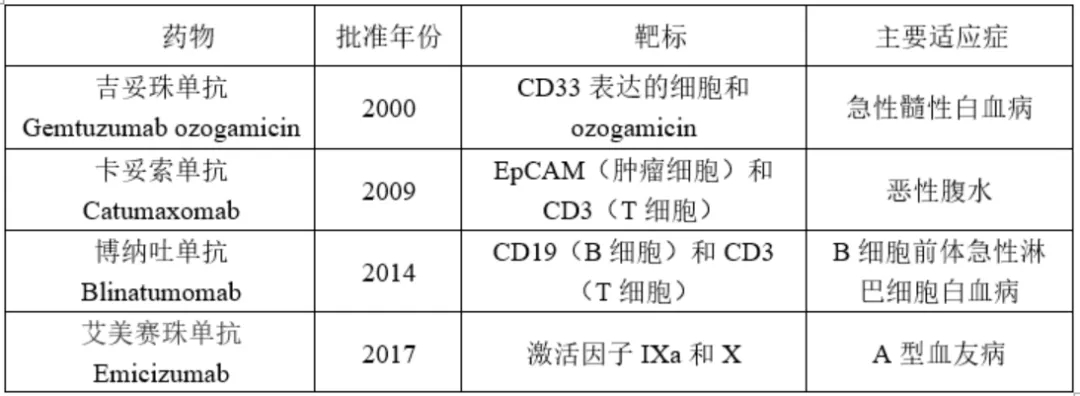
近年来,越来越多的双特异性药物(或者更普遍地指多特异性药物)开始发挥重要作用,现代制药工业史也随之出现了第四次药物革命性浪潮,即多特异性药物的出现。虽然到目前为止,只有四种前瞻性设计开发的多特异性药物被批准(表1),但这波浪潮正在迅速形成。在安进(Amgen)公司,通过I期临床试验的管线药物中约有三分之二是多特异性药物。这些前瞻性设计的多特异性药物的成功开发,让科学家们重新思考如何设计开发新一代药物。在本文中,作者将多特异性药物分为两大类:一类是能够在特定作用位点上发挥作用的药物,另一类是治疗药物与生物效应器相偶联的药物。
表1 四种已批准的前瞻性设计开发的多特异性药物
那么什么是多特异性药物,与经典的理性药物设计有什么区别?如图2的左图所示,理性药物设计遵循一个靶点一个药1T1D原则,药物与靶点直接结合,形成明确的单一药物靶点结合界面,这种结合通过促进或抑制靶点功能而发挥作用。另外,经典药物的另外一个特点是它们通常在全身都能发挥作用,不具有组织特异性。
与之不同的是,专性多特异性药物通过两个或两个以上的实体起作用,使药物活性限制在一个特定的位置,或将靶标锚定到内源性效应器旁边,让该效应器对靶标进行调节。专性多特异性药物的特点主要是形成2个或多个药物靶点结合界面,如图2的右图所示,MZ1与靶标BRD4和内源性效应器泛素连接酶亚基VHL同时结合,将BRD4锚到VHL附近,使VHL对BRD4进行泛素化修饰,然后被蛋白酶体降解。
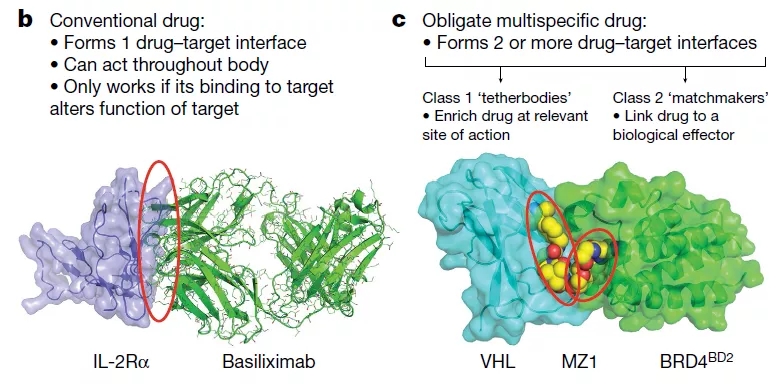
图2 多特异性药物与经典的理性药物的区别,来源于参考文献[1]
作者将多特异性药物分为两大类:一类是在特定作用位点上提高治疗效果的药物,即Tetherbodies(包括SOMs 和COMLs);另一类是将治疗靶点与生物效应器联系起来的药物,即Matchmakers(COMMS)。
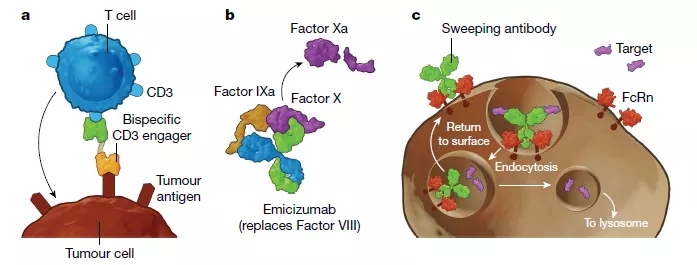
SOMs(sequentially binding obligatemultispecific drugs),即顺序结合专性多特异性药物(见图3a,b),例如常见的抗体偶联药物。抗体偶联药物将抗体与细胞毒性化合物相偶联。抗体部分与表达于肿瘤细胞表面的蛋白结合,抗体药物与抗原的结合使细胞毒性化合物在肿瘤细胞处富集。抗体偶联药物随后进入肿瘤细胞中发挥细胞毒性作用,从而杀死肿瘤细胞。该药物的锚定过程和杀死细胞过程具有先后顺序,因此得名。第一个前瞻性设计和批准的SOMs是抗体偶联药物gemtuzumab ozogamicin(商标名Mylotarg,吉妥珠单抗),用于治疗急性髓系白血病。该药物的靶点是核DNA,核DNA被ozogamicin 裂解。而gemtuzumab则与白血病母细胞上表达的CD33结合。
COMLs (concurrently binding obligatemultispecific drugs that mediate localization) ,即介导定位的同时结合专性多特异性药物(见图3c)。它是SOMs的一种适度的变体,COMLs的锚定位点和药物作用靶点定位于同一个部位,并且锚定过程和对靶点的调节过程同时发生,因此得名。COMLs的一个例子是抗体细胞因子融合药物。细胞因子IL-2可以增强肿瘤的免疫攻击,但是当它们被系统传递时可能会产生副作用,从而限制了它们的使用。一种解决方案是降低IL-2对其受体的亲和力,并将其与一种能与肿瘤限制性细胞表面抗原结合的抗体相连接,这样IL-2只能在其受体集中的区域即肿瘤上富集,从而发挥作用,降低副作用。许多抗体细胞因子融合药物正在开发中,但目前还没有药物进入市场。
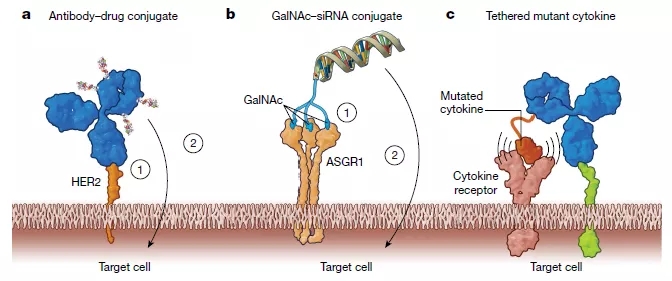
图3 在特定作用位点上提高治疗效果的多特异性药物Tetherbodies
(a,b为SOMs,c为COMLs),来源于参考文献[1]
COMMs (concurrently binding obligatemultispecific drugs that function as matchmakers ),即发挥媒介作用的同时结合专性多特异性药物。COMMs发挥分子媒介作用,将靶标与效应体相连接,形成一个与效应体结合的界面和另一个与靶标结合的界面,从而拉近效应器与靶标的距离,使效应体作用于靶标。COMMS又可以细分为两类,一类是基于小分子的COMMs,包括免疫抑制剂和植物激素(如环孢菌素cyclosporin、植物激素auxin、布雷菲德菌素A brefeldin A)、分子胶水(如沙利度胺)、PROTAC(靶向蛋白水解嵌合体,Proteolysis-targeting chimeric molecules)(图4);另一类则是基于生物大分子的COMMs,如双特异性CD3激动剂BCEs和异源性双功能IgG(图5)。

图4 基于小分子的COMMs,来源于参考文献[1]
图5 基于生物大分子的COMMs,来源于参考文献[1]
多特异性药物带来的挑战
由于多特异性药物通常与两个或两个以上的实体相互作用,因此它们本质上比单一特异性药物更复杂。这会影响它们的合成、优化、药代动力学、安全性、生产、临床开发和商业化,药物的研发更加复杂化。
一旦产生了候选的多特异性生物药物,临床前药代动力学和安全性评估可能会带来独特的挑战。与单特异性药物相比,多特异性药物常常出现蛋白水解、聚集、物理不稳定性和产量低的趋势。嵌合蛋白常常在动物体内诱发抗药物抗体,从而危及长期的毒理学研究,而双特异性抗体可能表现出较差的药代动力学行为,并通过非标准途径清除。体内药效和毒理学研究也可能因缺乏合适的动物模型而受挫。由于激活免疫攻击的药物可能导致严重的不良事件,因此BCEs的首次人体剂量由最低预期的生物效应水平决定,而不是最高的非严重毒性剂量,这可能会延长第一阶段临床试验的剂量增加。
除了开发方面的挑战外,多特异性药物的制造成本可能更高,分发和管理也更困难。多特异性药物在生产过程中的稳定性可能会发生变化,并会影响细胞培养过程的类型。另外,在工业规模上生产出产量高、质量稳定、杂质可忽略的均匀多特异性分子仍是一个挑战。
目前我们站在医药工业变革的边缘,可以想象不久的未来,会有大量越来越复杂的多特异性药物诞生,包括生物的和小分子的多特异性药物。特别是,多特异性小分子药物有可能通过招募强大的细胞效应因子来调节包括蛋白质、核酸甚至细胞器在内的多种靶点,从而打开迄今为止不可用药的细胞内蛋白质组。我们面临的机会是巨大的,但要发展多特异性药物,就必须在可接受的安全风险下,提供更好的疗效。此外,还要考虑药物生产的难易程度、药物的稳定性和给药的剂量及方便性等问题。由于这些药物的复杂性增加,这些问题可能会给一些多特异性药物带来挑战。然而,生物制药行业在过去的一个世纪里有了长足的进步,并且与生物学、化学、工程学以及计算机科学等学科有了更紧密的联系,我们可以期待会有更具潜力和更特异性的分子药物来治疗疾病,造福人类。
参考文献
[1] Raymond J. Deshaies.Multispecific drugs herald a new era of biopharmaceutical innovation. Nature,2020, 580:329-338. https://doi.org/10.1038/s41586-020-2168-1