盘点4-1BB赛道:想参与还来得及,最快也就Phase II
自PD-1、PD-L1、CTLA-4等靶点的单克隆抗体开发成功后,免疫检查点成为了肿瘤免疫治疗的热门靶点,这些检查点在免疫系统中起到一个“刹车”的作用。4-1BB是TNFR家族的成员之一,在T细胞和NK细胞等被激活后,会有很高的表达,是一个对细胞激活具有重要功能的共刺激因子。4-1BB能够活化细胞毒性T细胞和记忆T细胞,促进T细胞增殖和存活,有助于对肿瘤细胞进行杀伤,对于免疫系统,4-1BB起到“油门”的作用。近十几年来,利用4-1BBL或激活型4-1BB单抗,激活4-1BB后刺激T细胞,逐渐在肿瘤免疫中崭露头角。
4-1BB天然状态下结合三聚化的4-1BBL,达到成簇的目的,促进后续信号通路的传导,同样可以采用激活型的抗体实现4-1BB成簇目的,但如何能筛选到合适的激动型抗体仍然是一件具有挑战的事情。
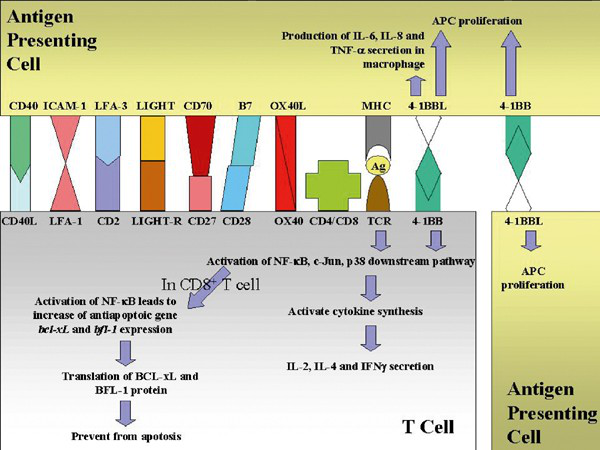
4-1BB和4-1BBL结合在免疫反应中的作用,激活T细胞需要两个信号,第一是通过TCR:MHC:Ag的结合,第二个信号涉及共刺激信号,比如CD28:B7,4-1BB:4-1BBL等。同时还有黏附因子的相互作用,比如CD40:CD40L,ICAM-1:LFA-1,LFA-3:CD2等,会增加两个细胞保持在一起的时间。
4-1BB和4-1BBL结合后,第一,会活化转录因子NF-kB信号通路,增加抗凋亡基因bcl-xL 和 bfl-l的表达,促进CD8+ T淋巴细胞的存活。第二,通过c-Jun N末端激酶(JNK)等途径,促使细胞因子的产生和分泌。
鉴于4-1BB对T细胞的激活的功能,开发4-1BB的激活型抗体可以激活T细胞,达到肿瘤免疫治疗的目的。目前进展最快的两个单克隆抗体分别是辉瑞的utomilumab和BMS的urelumab,分别进展到临床二期。
BMS的urelumab是一款全人源IgG4 – kappa型单克隆抗体,激活4-1BB,不阻断4-1BBL的结合,是第一个进入临床试验的4-1BB单抗药物。单药显示对黑色素瘤的客观缓解率ORR为50%,但是同时提示无法避免与剂量相关的肝毒性及副作用。BMS重新启动了低剂量0.1 mg/kg试验,但抗肿瘤活性一直不高。
辉瑞的utomilumab是一款全人源IgG2 – lambda型单克隆抗体,激活4-1BB,同时抗体结合表位和4-1BBL有重叠,可以阻断和4-1BBL的结合。Utomilumab是比urelumab作用更弱的激动剂,具有相对较高的安全性,剂量可爬坡至10 mg/kg,但治疗效果依然不理想。
除了上述的utomilumab和urelumab之外,其它处在临床二期的3个,临床一期的10个,公开的临床数据比较少。
从在研临床分子结构上来看,单克隆抗体和双特异性抗体较多,比如ND-021是Numab设计研发的一种单价三特异性抗体片断分子,可同时结合PD-L1、4-1BB和HSA三个靶点。根据设计,ND-021中HSA可以延长分子半衰期,并且消除了与任何一种FcγR亚型的结合。由于亲和力的高低不同,ND-021优先结合肿瘤细胞表面上的PD-L1,之后才与4-1BB的独特抗原表位相结合,激活抗癌T细胞,从而可能避免肝毒性。国内科望生物的PD-L1/4-1BB双特异性抗体ES101 (INBRX-105),是全球第一个进入临床阶段的PD-L1/4-1BB双特异性抗分子。ES101是一个四价双特异性抗体,分别靶向PD-L1和4-1BB。ES101基于PD-L1在肿瘤微环境中高表达这一生物学特性,能够有效持续阻断PD-L1的同时,在肿瘤微环境中有条件激活4-1BB。
而从在研临床分子设计的整体策略来看,双特异性是明显的趋势,不仅仅可以结合两个肿瘤靶点,同时还可以把4-1BB适度激活,通过肿瘤靶点在细胞膜上的聚集实现4-1BB的成簇,达到肿瘤杀伤的目的。
综上:相对阻断型抗体,如PD-1、PD-L1等来讲,激动性抗体,4-1BB抗体开发更具挑战,抗体前期发现要考虑多种因素,包括抗体的亲和力、表位选择、效价、簇形成、FcγR受体相互作用、FC亚型等。从目前临床数据来看,4-1BB的激动型抗体在早期试验中均未能达到之前的预期。4-1BB单抗受限肝毒性的影响,降低剂量或者去除FcγRIIB对抗体Fc的交联作用,是可以调整的两种策略。针对4-1BB的窗口期较窄,后期的联合用药和双特异性抗体的设计是4-1BB抗体很大的发展趋势。