独家深度!最难治肿瘤「胶质母细胞瘤」新药研发进展
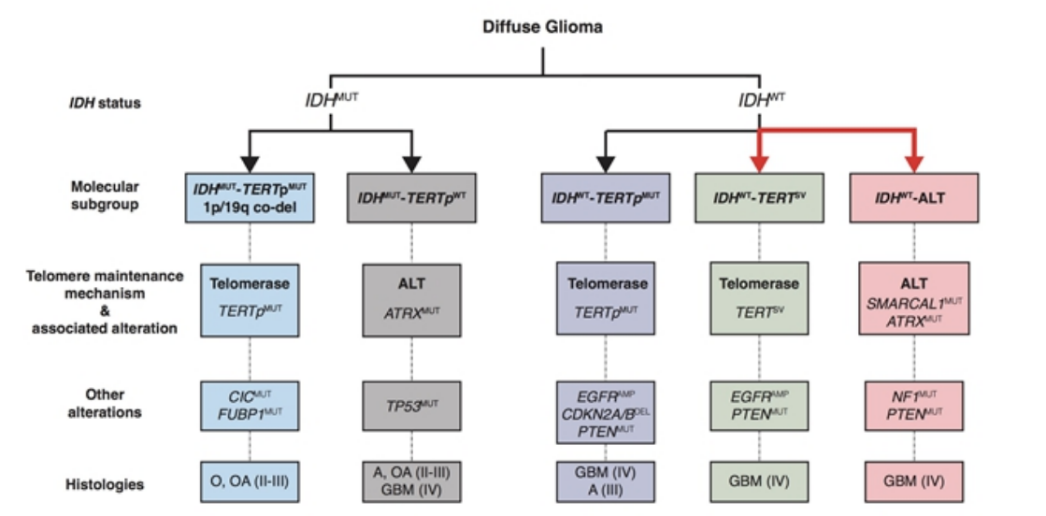
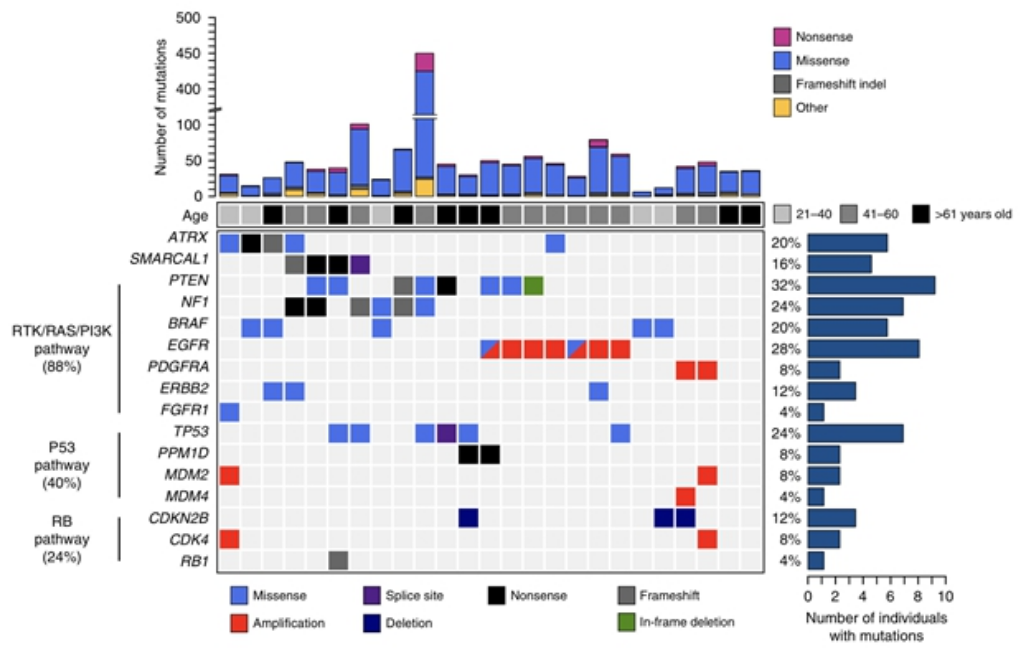
TERTpWT-IDHWT胶质母细胞瘤体细胞编码改变的突变图谱
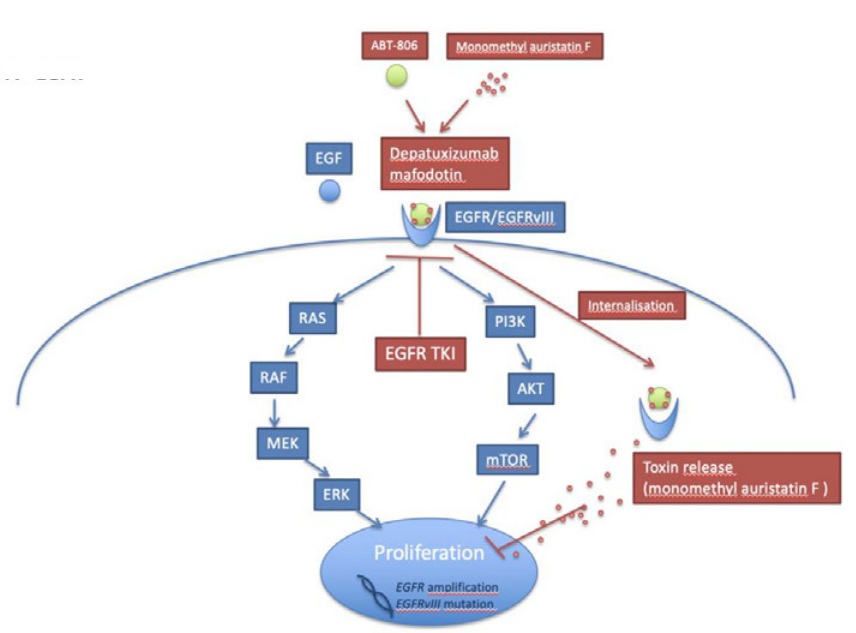
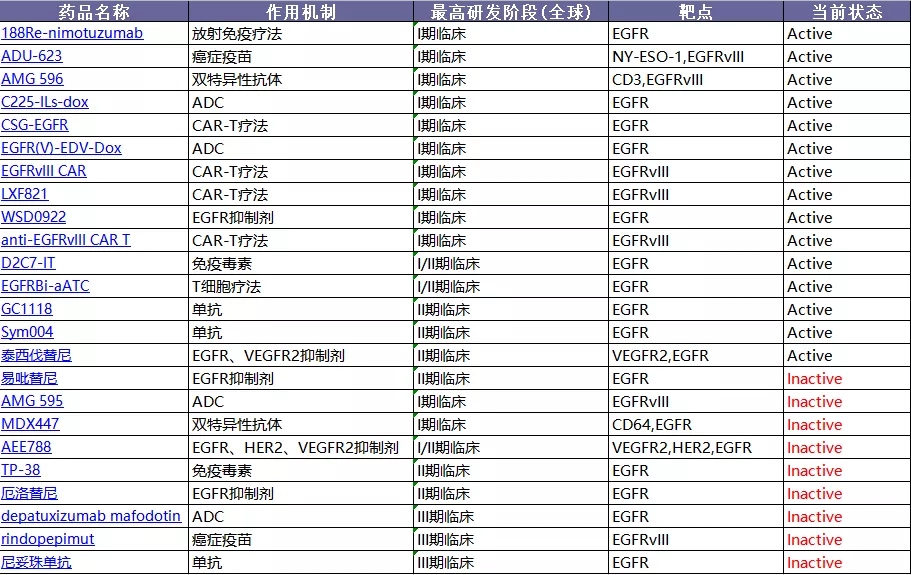
EGFR:热门靶点,失败率高
据统计,针对GBM适应症,推进至I/II/III期临床的EGFR项目共有24个,其中9个已经失败(包括1个单抗、3个小分子靶向药、1个癌症疫苗、2个ADC药物、1个免疫毒素、1个双抗),目前仍在开发中的EGFR项目的主要处于I期(10个)和II期(6个),此前进入III期阶段的项目全部以失败告终。各种数据分析,EGFR靶向治疗的研发失败率较高可能与药物的透血脑屏障、疾病信号通路的复杂性等有关。
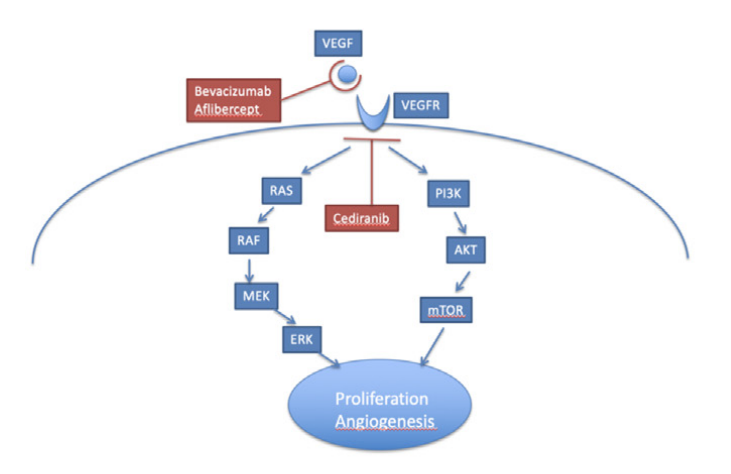
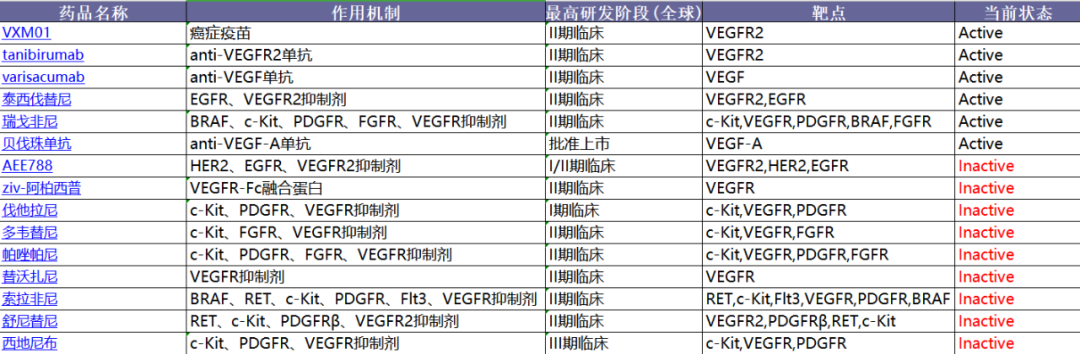
VEGF:有效靶点,尚存争议
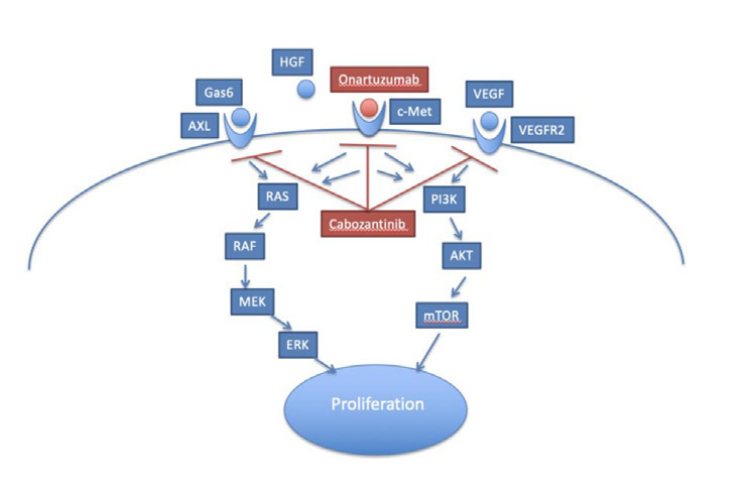
MET靶点:潜力靶点,硕果仅存
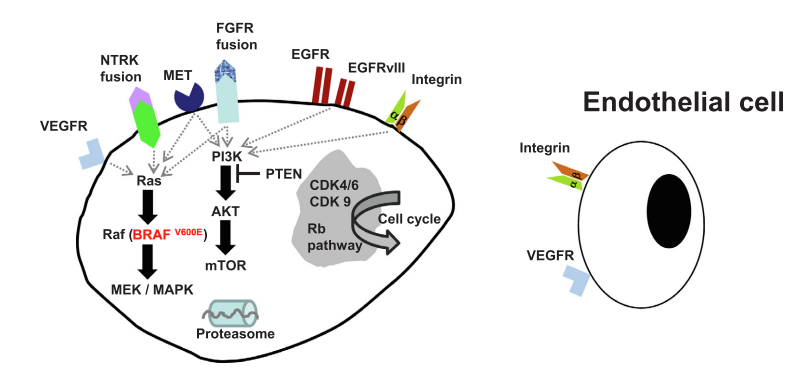
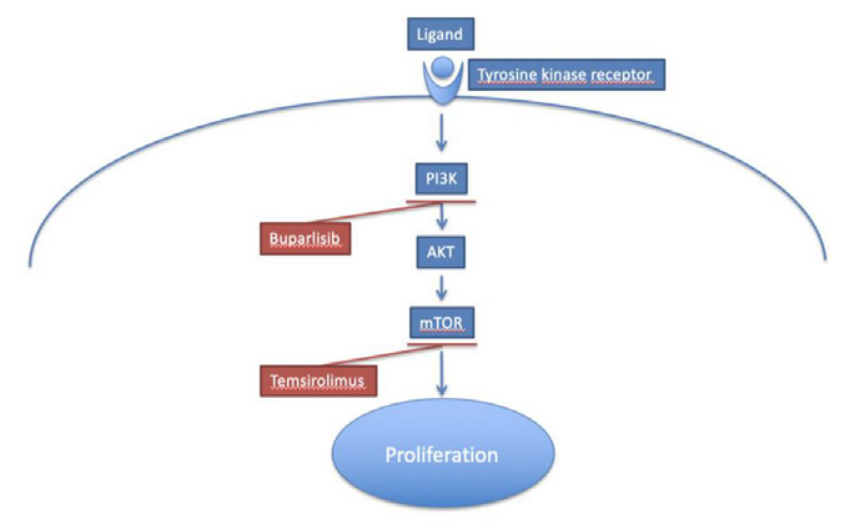
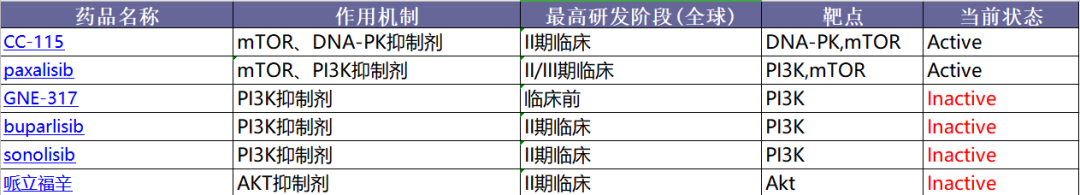
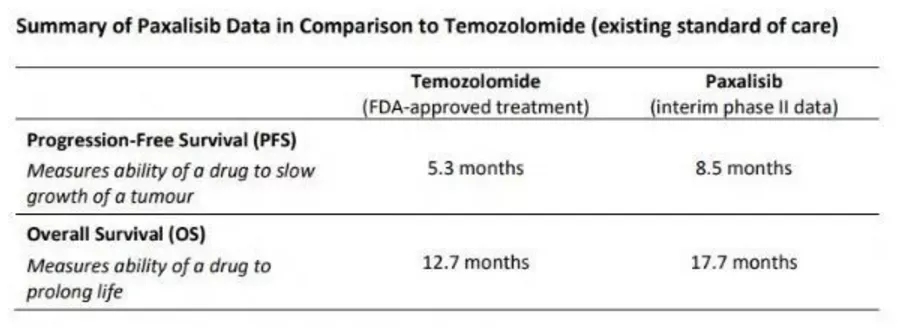
PI3K/PTEN/AKT/mTOR信号通路:关键靶点,曙光乍现
针对GBM适应症的PI3K/AKT/mTOR信号通路相关项目
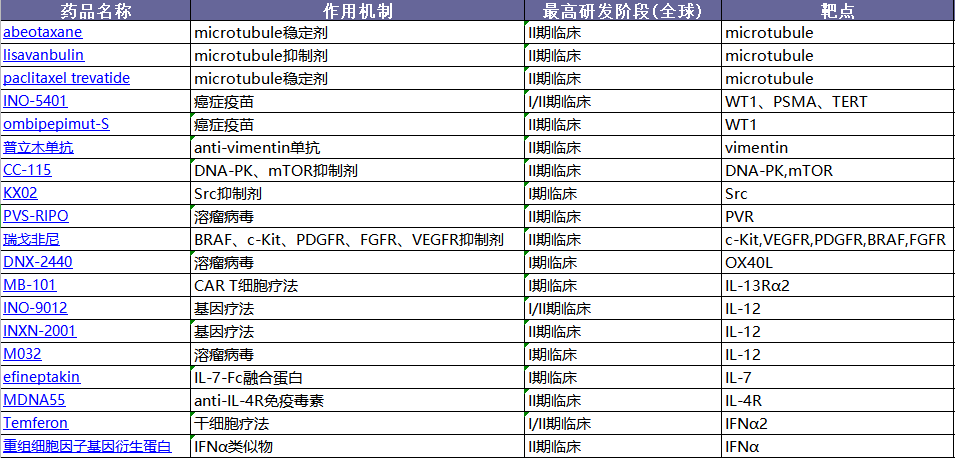
其他靶点:前赴后继,值得期待
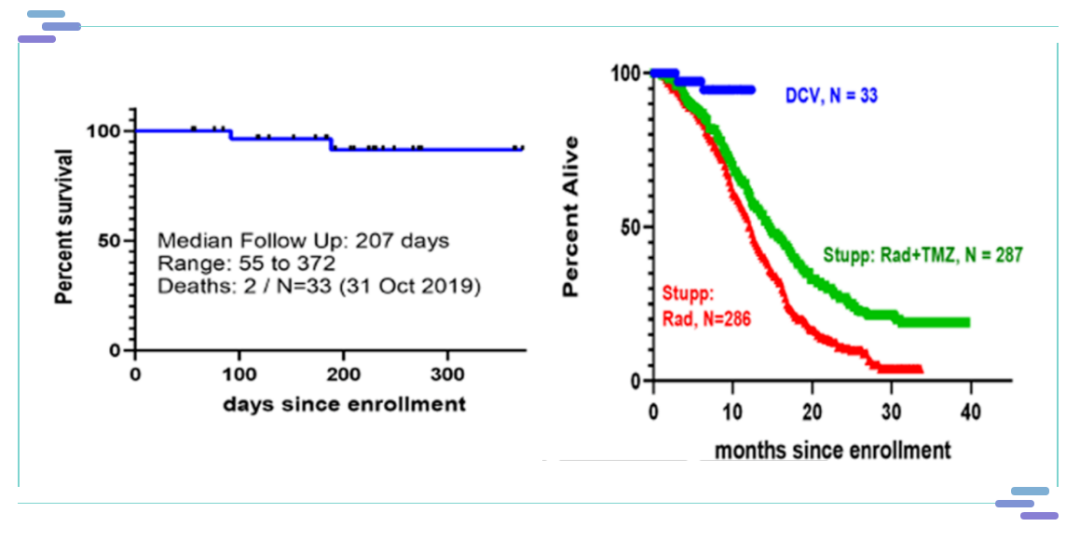
AV-GBM-1是一种患者自体的特异性树突状细胞疫苗,旨在利用患者自身的免疫系统来寻找并消灭癌细胞。这种疫苗能够携带术后肿瘤组织中提取的特定抗原信息,注射后将抗原信息传递给T细胞激发起杀瘤活性。能与替莫唑胺和放疗同时进行,也可从化疗和放疗中恢复后再注射该疫苗。AV-GBM-1的II期临床数据在2020年4月8日公布,显示此款新型疫苗在延长新确诊胶质母细胞瘤患者总生存期方面具有极大潜力。
接受AV-GBM-1治疗的50例可评估患者的15个月总生存率为76%,而对照组287例接受标准治疗的患者的12个月和15个月总生存率分别为61%和48%。临床表明,接受该治疗的患者15个月的总生存率提高了28%,疗效格外显著。
结语
在最近的临床发展中,针对GBM的许多靶向药物的失败表明,大多数的GBM甚至不是一种单一通路的疾病,是否适合靶向治疗值得我们探讨。
虽然新药物和新治疗手段为GBM治疗带来了新的希望,但在未来发展过程中还需解决诸多难题:1)GBM的抗原异质性是免疫治疗尚待解决的难题,如何进行特异性抗原鉴定、分离和纯化;T细胞输送到何处才能发挥最大功效;T细胞进入肿瘤的效率以及T细胞的持续存活和增值。2)如何避免耐药和放疗抵抗。3)对于初发和复发GBM,何者更适合免疫治疗或基因治疗还需要临床试验进一步验证。如何将新技术和新的治疗方法应用于临床,尤其是个体化治疗,将是GBM治疗所面临的一项巨大挑战。
为此,我们共同期待未来越来越多意想不到的临床研究成果!
专家点评
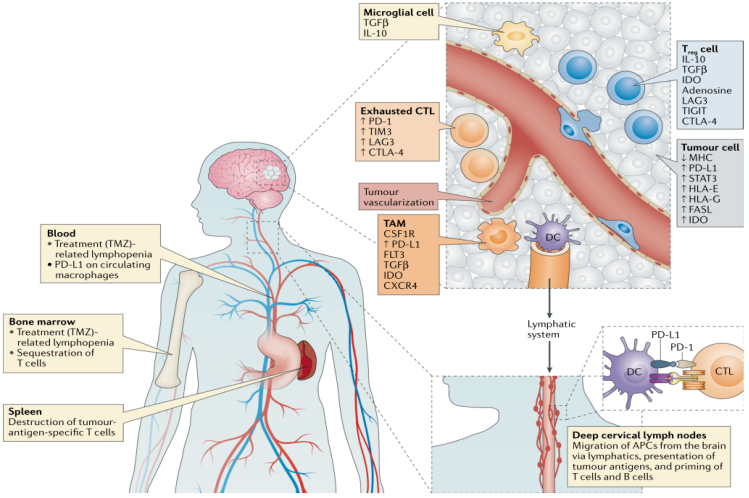
脑胶质瘤是指起源于神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤之一,目前治疗手段包括手术和术后辅助放化疗,对于高度恶性的胶质瘤如GBM,还可以辅助电场治疗,延长生存时间。但是绝大多数患者预后不理想,急需开辟新的治疗方式/方法。免疫靶向治疗作为新型的治疗手段可能有利于延缓肿瘤复发,提高肿瘤的治疗效果。
两年前国内专家形成了第一版“中国中枢神经系统胶质瘤免疫和靶向治疗专家共识”(中华医学杂志)在国内引起强烈反响,由于这个领域进展快速,第二版共识也完成,目前待出版中,可供临床医生等参考。本文从IDHWT/TERTpWTGBM基因谱的绘制谈起,从致病通路和分子分型的基础上深入浅出地解析了GBM在研药物聚焦的候选分子靶点和在研进度,非常详尽和较全面。在此基础上,结合我们临床实践和研究,有以下感想:
1 )脑胶质瘤治疗的靶点选择非常重要,不同分子分型存在不同靶点,也不是任何一个“靶点”被封闭或者拮抗就一定会起到抑制肿瘤的效果,所以在提高血脑屏障通过率基础上更加科学全面考虑合适的关键靶点或者相关通路会更加事半功倍;
2 )总体上胶质瘤是冷肿瘤,同时存在超冷免疫亚型,如何克服脑局部固有细胞超冷特性、如何更好的使用iRANO标准来评价免疫治疗效果、如何利用脑淋巴管,类淋巴组织来增强免疫治疗效果等值得进一步研究;
3)恶性胶质瘤药物治疗建议采取联合以及序贯疗法为主,过多过度的联合以及远超肿瘤负荷的治疗都是没有必要的。当然,我们期待更多胶质母细胞瘤更多研发药物得以上市,造福病患。
专家简介
姚瑜教授,华山医院神经外科主任医师、医学博士、博士生导师。中国中枢神经系统胶质瘤免疫和靶向治疗共识制定专家组组长,中国胶质瘤指南编写组秘书,中国胶质瘤协作组秘书,参加多个胶质瘤相关临床试验,对脑胶质瘤等脑瘤有着丰富的显微外科手术经验和综合治疗体会。
参考资料
1. Le Rhune, et al. Molecular targeted therapy of glioblastoma[J]. Cancer Treat Rev, 2019,80:101896.
2. Itakura H, et al. Magnetic resonance image features identify glioblastoma phenotypic subtypes with distinct molecular pathwayactivities[J]. Sci Transl Med, 2015, 7(303):303ra138.
3. ALEXANDER BM, CLOUGHESY TF. Adult glioblastoma[J]. J ClinOncol, 2017,35(21):2402-2409
4. WICK W, OSSWALD M, WICK A, et al. Treatment of glioblastomain adults[J]. Ther Adv Neurol Disord, 2018,11:1277012020.
5. ZHU Z, GORMAN M J, MCKENZIE L D, et al. Zika virus has oncolytic activity against glioblastoma stem cells[J]. J Exp Med, 2017,214(10):2843-2857.
6. HU H, MU Q, BAO Z, et al. Mutational landscape of second aryglioblastoma guides MET-targeted trial in braintumor[J]. cell, 2018, 175(6):1665-1678.
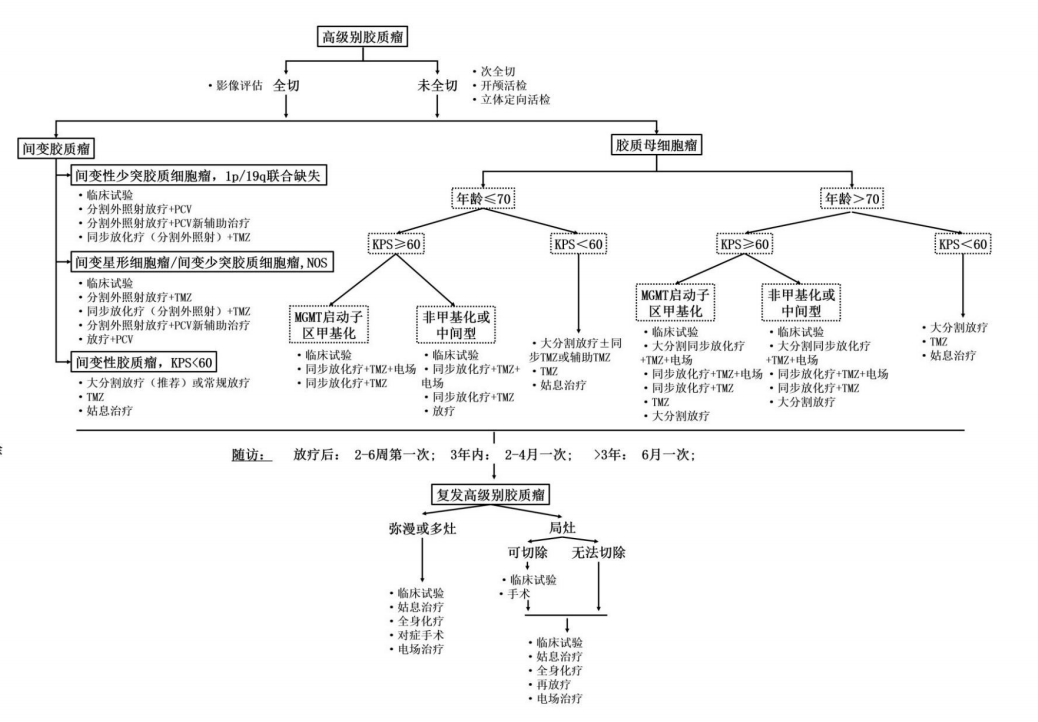
7. 国家卫健委发布的2018版《脑胶质瘤诊疗规范》
8. https://www.onclive.com/web-exclusives/avgbm1-active-in-frontline-glioblastoma
9.https://www.businesswire.com/news/home/20200408005162/en/AIVITA-Biomedical-Update-Ongoing-Phase-2-Glioblastoma
10.https://kza.irmau.com/irm/PDF/4dda3cec-12bc-424f-a866-120d5de846de/KaziapaxalisibPhaseIIinterimdata
11. https://www.kaziatherapeutics.com/researchpipeline/gdc-0084
12.Diplas B H, He X, Brosnan-Cashman J A, et al. The genomic landscape of TERT promoter wildtype-IDH wildtype glioblastoma[J]. Naturecommunications, 2018, 9(1): 2087.
14.Michael Lim,et al. Current state of immunotherapy forglioblastoma[J]. Nature Reviews Clinical Oncology,2018,15:422-442.