治疗肺癌!强生EGFR-MET双抗和第三代EGFR-TKI联合疗法在华获批4项临床!
-
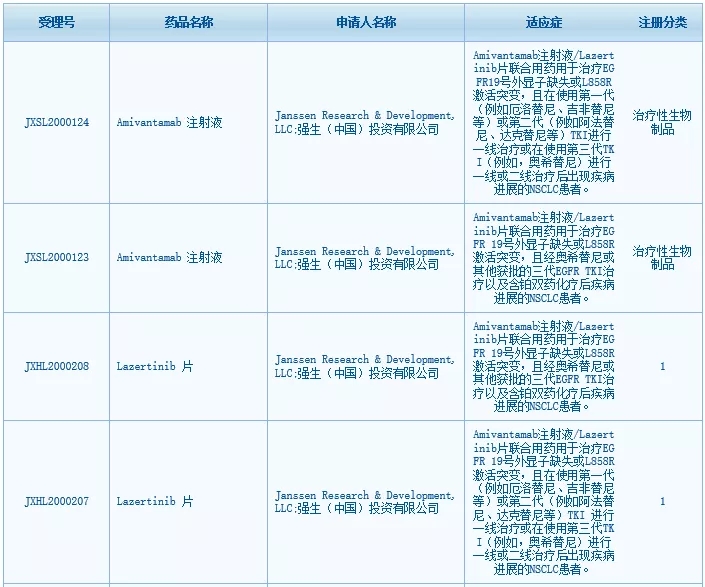
amivantamab注射液/lazertinib片联合用药,用于治疗EGFR 19号外显子缺失或L858R激活突变,且在使用第一代或第二代TKI进行一线治疗或在使用第三代TKI(如奥希替尼)进行一线或二线治疗后出现疾病进展的非小细胞肺癌(NSCLC)患者。
-
amivantamab注射液/lazertinib片联合用药,用于治疗EGFR 19号外显子缺失或L858R激活突变,且经奥希替尼或其他获批的三代EGFR TKI治疗以及含铂双药化疗后疾病进展的NSCLC患者。
大家知道,肺癌是众癌之首。其中NSCLC约占肺癌病例的85%。约75%的NSCLC患者确诊时已是晚期,五年存活率仅5%。公开数据显示,EGFR突变在全球10%~35%的NSCLC中出现,在中国约有50%的NSCLC患者存在EGFR基因突变。
正因为如此,一直以来全球很多针对肺癌的靶向药开发,都试图通过抑制突变EGFR的活性来抑癌。过去从第一代到第三代已有多款针对EGFR的酪氨酸激酶抑制剂(TKI)药物上市,为许多患者带来了临床改善。然而,接受过TKI治疗患者出现的获得性耐药使得病情继续进展。
为应对患者治疗中出现的耐药性,药物研发界的科学家门正在不断努力开发新的药物,其中就包括强生正在联合开发的双抗药物amivantamab和三代EGFR TKI药物lazertinib。此次这两款药物的联合疗法在华获批临床,是它们临床开发进程中的又一进展。
值得注意的是,强生公司今年7月在ClinicalTrials.gov登记了amivantamab联合lazertinib一线治疗EGFR突变的局部晚期或转移性非小细胞肺癌的3期临床研究,以评估该联合疗法较奥希替尼或单药一线治疗EGFR 突变(外显子19缺失或外显子21 L858R替换)、局部晚期或转移性非小细胞肺癌的疗效和安全性。根据公开信息,该项研究计划入组1000例受试者,将于今年10月正式启动患者招募。
此次amivantamab注射液+lazertinib片的联合疗法在中国获批临床,意味着这一在研联合疗法即将在中国开展相关临床研究。我们祝贺强生,希望这些研究顺利开展,早日为患者带来新的治疗希望。