近期癌症免疫疗法重磅临床研究进展解读
2017年1月6日讯 /生物谷BIOON /——作为一种利用自身免疫系统攻击肿瘤细胞以治愈癌症的新兴疗法,癌症免疫治疗已经成为继手术、化疗、放疗之后的第四大癌症治疗方法,基于免疫检验点的抑制剂已经进入临床,而CART等正在临床试验中。那么近期癌症免疫治疗邻域的临床研究又有什么新进展?
本文中小编盘点了近期关于癌症免疫治疗的重磅临床研究进展,与大家一起分享。
【1】STM:晚期淋巴瘤病人经CAR-T细胞免疫疗法治疗后病情完全缓解
doi:10.1126/scitranslmed.aaf8621
一项近期发表在《Science Translational Medicine》上的研究中,美国弗雷德-哈金森癌症研究中心领导的一项早期免疫疗法临床试验CAR-T细胞治疗非霍奇金淋巴瘤病人,这些病人之前用尽了多种常规的癌症治疗手段,但是在他们的免疫细胞经过基因改造变成抗癌免疫细胞后,他们体内的晚期肿瘤完全消失了。
在这项临床试验中,研究人员提取来自病人血液的抵抗疾病的T细胞,将它们送往位于弗雷德-哈金森癌症研究中心的一家专业实验室以便对它们进行基因改造。在那里,技术人员将制造一种人工合成的靶向癌症的嵌合抗原受体(CAR)的DNA指令插入到这些T细胞的基因组中。用于这项研究的CAR是在弗雷德-哈金森癌症研究中心Riddell实验室开发的,靶向在某些白细胞---包括一些淋巴瘤细胞---表面上发现的一种被称作CD19的分子。
32名参与者在进行化疗(被称作淋巴细胞删除)后接受CAR-T细胞灌注,其中化疗的目的是为随后灌注的CAR-T细胞进入病人体内腾出空间。研究人员发现在一组11名病人先接受两种药物化疗再接受中等剂量CAR-T细胞灌注后,这些CAR-T细胞最为有效地摧毁癌症。这11名病人中的7人(64%)进入病情完全缓解。
【2】抗癌免疫疗法新药获成功
doi:10.1038/bjc.2016.342
科学家们最近研究出了一种能够有效杀伤恶性胰腺癌的药物,而且没有明显的副作用。该药物叫做“IMM-101”,它能够唤醒体内的免疫系统从而对肿瘤进行杀伤。由于胰腺癌自然状态下会主动逃避体内免疫系统的识别,因此该药物的出现对于该类肿瘤的治疗具有重大的意义。
来自英国伦敦大学的研究者们通过将IMM-101与已有的化疗药物gemcitabine进行联合使用,发现其能够有效杀伤胰腺癌细胞外周的保护性细胞,以及能够延长转移胰腺癌患者的寿命。接受该免疫治疗药物的患者均表示相比传统化学疗法要舒服一些。而且研究结果表明该疗法没有明显的副作用。虽然早期的研究结果十分喜人,但这并不能说明该药物具有治愈胰腺癌的能力。而且,由于该实验仅仅囊括了110名患者,因此还需要提高样本数量来获得更加可靠的结果。
【3】Cell:黑色素瘤劫持重要免疫信号途径对抗免疫治疗
DOI: 10.1016/j.cell.2016.08.069
来自美国MD安德森癌症中心的研究人员在国际学术期刊Cell上发表了一项最新研究进展,他们发现黑色素瘤能够利用一个重要的免疫应答途径中的基因突变抵抗免疫治疗药物ipilimumab。IFNγ是一个能够激活免疫应答的细胞因子,除此之外IFNγ还可以通过结合细胞表面的受体直接攻击肿瘤细胞,引发一系列分子事件抑制细胞生长促进肿瘤细胞死亡。研究人员表示,IFNγ这种直接的细胞杀伤作用可能受到了肿瘤细胞基因突变的阻断。
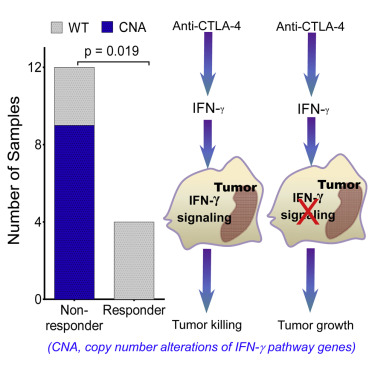
他们首先对16名接受ipilimumab治疗的黑色素瘤病人进行了全外显子测序数据分析。16名病人中只有4人应答ipilimumab治疗,另外12人不应答。在不应答治疗者的肿瘤中共发现184个基因突变,其中142个为基因拷贝数变异,42个为单核苷酸变异,而在应答治疗者的肿瘤中只发现了4个基因突变。分析表明不应答治疗者在肿瘤的IFNγ信号途径上平均存在15.33个基因突变,基因拷贝数的变异最为显著。
12个不应答治疗者中有9人存在基因拷贝数的改变,其中一些基因的变异最为显著,包括IFNγ的两个受体IFNGR1和IFNGR2以及两个最重要的下游基因IRF-1和JAK2出现基因缺失。这条通路上两个已知的抑制因子SOCS1和PIAS4出现了基因扩增的情况。
研究人员在一个对IFNγ攻击比较敏感的黑色素瘤细胞系中敲除IFNGR1,结果发现肿瘤细胞在存在IFNγ的情况下也可以生长。他们又将相同的细胞系移植到小鼠体内,并用ipilimumab进行治疗,24只存在正常IFNγ受体的小鼠中只有4只发展为癌症,而移植了敲除IFNGR1的细胞系的25只小鼠中有12只发展为肿瘤。
【4】NEJM:联合使用免疫检查点抑制剂或导致癌症病人死于心脏副作用
DOI: 10.1056/NEJMoa1609214
一项发表在国际学术期刊NEJM上的研究中,研究人员介绍了两名黑色素瘤病人在接受了ipilimumab和nivolumab这两种药物的联合治疗后意外出现急性心肌炎并发生死亡的病例。这两种药物都是FDA批准的免疫检查点抑制剂能够刺激病人的抗肿瘤应答。Ipilimumab是一种抗CTLA-4抗体,nivolumab是抗PD-1抗体。
在这两例死亡病例中,一名患者为65岁女性,另外一名患者为63岁男性,两人都患有转移性黑色素瘤,在联合治疗开始后住院观察接近两周。文章通讯作者Javid Moslehi教授表示,这两名病人在住院期间只表现出一些轻微症状。随后研究人员对这两种药物导致心肌炎的机制进行了研究。通过对病人的心脏组织进行研究清晰发现心脏中浸润了大量T细胞和巨噬细胞导致心脏发生了免疫反应。非常重要的是,心肌中浸润的T细胞群体与肿瘤和骨骼肌中出现的T细胞群体相同。
作者表示,全球数据表明接受ipilimumab和nivolumab联合治疗的病人发生心肌炎的概率不到百分之一,表明这是一种非常罕见的副作用反应。
【5】治疗黑色素瘤该选择靶向治疗还是免疫治疗?这项研究给你一个答案
doi: 10.1001/jamaoncol.2016.4877
黑色素瘤是一种具有很强侵袭性的致命皮肤癌。据加拿大癌症学会介绍,每年加拿大新发癌症病例中有大约3.3%为黑色素瘤。在黑色素瘤早期阶段,只进行手术就可以达到治疗目的,但是大多数处于癌症晚期阶段的病人并不适合进行手术,药物治疗才是主要的治疗手段。而来自加拿大麦克马斯特大学的研究人员最近发现,对于晚期黑色素瘤病人来说,联合使用几种免疫治疗方法能够提高病人生存率,降低危及生命的事件的发生风险。
研究人员分析了2011年到2015年之间发表的15项随机对照试验数据,其中共包含6662名癌症病人,这些病人或者是体内的癌细胞已经扩散到淋巴结不适合手术,或者黑色素瘤已经发生远端转移。研究人员评估了靶向治疗或免疫检查点抑制剂为这些病人带来的好处和坏处。 他们发现BRAF和MEK联合靶向治疗以及PD-1免疫治疗对于改善整体生存率同样有效。BRAF和MEK联合抑制对于提高无进展生存率最有效。PD-1抑制剂与显著降低危及生命事件的风险有关。
【6】进行早期免疫治疗干预可阻止多发性骨髓瘤进展
来自美国丹娜法伯癌症研究所的研究人员最近发现利用一种免疫治疗药物组合进行早期干预或可阻止郁积型多发性骨髓瘤发展为完全成熟的多发性骨髓瘤。这项2期临床试验的中期结果呈现在第58届美国血液学会年会上,该会议于2016年12月5日在美国圣地亚哥召开。
据美国癌症学会的介绍,如果一个人在骨髓中发现疾病症状或出现其他可能导致发展为骨髓瘤的病理特征,就认为这个人患有郁积型多发性骨髓瘤,多发性骨髓瘤目前仍是一种不可治愈的血液癌症,在美国每年有大约三万人诊断为该疾病,预计2016年将有12650人死于多发性骨髓瘤。郁积型多发性骨髓瘤病人有50%的几率在两年内发展为症状明显的多发性骨髓瘤。许多临床试验都在研究在郁积型多发性骨髓瘤阶段进行早期干预是否安全,是否可以阻止骨髓瘤进展。
在这项临床研究中,他们共招募了50名病人,有47人仍可追溯,其中有23名病人完成了9轮治疗,这些病人中有82.6%出现药物组合引起的肿瘤萎缩,34.8%的病人产生良好应答。在中位数为7个月的随访过程中,许多病人都处于疾病缓解期。研究人员认为这些初步结果表明这种药物组合比之前一项试验使用的lenalidomide和地塞米松药物组合效果更好,当然他们也承认虽然这些数据令人感到兴奋,但是在将其确定为标准治疗方法之前还需要进行3期随机试验。

【7】免疫治疗药物组合展现对抗霍奇金淋巴瘤的新希望
根据一项最近的研究结果,联合使用两种免疫治疗药物可以安全有效地摧毁64%复发霍奇金淋巴瘤病人体内的大多数癌细胞。研究人员在美国血液学会年会上介绍了这项研究,该研究在19名病人中发现联合使用brentuximab vedotin和nivolumab这两种药物可以在一定程度上减小肿瘤尺寸或抑制肿瘤扩散。
由纽约大学Langone医学中心领导的这项多中心临床试验招募了初始化疗或干细胞移植失败无法阻止癌细胞生长的病人,他们曾在去年的会议上报道称brentuximab vedotin和ipilimumab这两种药物形成的类似组合对于淋巴瘤的治疗同样安全有效。研究人员表示希望未来可以将这种治疗策略进一步应用到其他非霍奇金淋巴瘤的治疗上。(生物谷Bioon.com)