
美国Dana-Farber神经肿瘤研究中心Patrick Y. Wen团队2019年6月18日在SCI医学1区杂志 Clinical Cancer Research(2018-IF:8.911)上发表名为“ A Randomized Double-Blind Placebo-Controlled Phase II Trial of Dendritic Cell Vaccine ICT-107 in Newly Diagnosed Patients with Glioblastoma”的文章。
研究报道了DC疫苗ICT-107治疗新诊断胶质瘤母细胞瘤患者的II期临床研究结果,检测了其有效性、安全性、对生存质量以及诱导免疫反应方面的影响。初步结果显示 ICT-107治疗能够显著延长PFS同时维持患者生存质量,其中HLA-A2亚群的患者中ICT-107的活性及免疫原性显著提高。
该研究原文链接:
https://clincancerres.aacrjournals.org/content/25/19/5799.long
胶质母细胞瘤(GBM)是脑肿瘤中发病率较高且预后较差的一类,目前除标准治疗(手术切除联合辅助化疗及同步放化疗)之外,仅肿瘤电场治疗(TTF)以及贝伐单抗等为数不多的治疗方案被批准用于复发及难治性GBM的治疗中,而对于新诊断GBM来说,预后好于复发GBM,而方案也变得更加局限,近期才批准TTF作为新诊断GBM的辅助治疗1。
之所以GBM的治疗效果及预后不尽人意,背后的机制可能在于其 免疫逃逸或“免疫豁免”方面的特性,以及 GBM内部基因靶点的异质性。因此催生了众多改善GBM免疫微环境以及联合靶点的实验性治疗方案。过去的10年里, DC疫苗作为新兴的免疫治疗方法,在肿瘤治疗领域发展迅速,包括转移性黑色素瘤、肝细胞肝癌、肺癌、乳腺癌等,早在2010年就被FDA批准可以应用于治疗进展期前列腺癌,而目前正被广泛应用于改善GBM免疫抑制微环境的研究中。
2018年报道了在新诊断GBM患者中应用自体 DC疫苗(DCVax-L)联合替莫唑胺(TMZ)的Ⅲ期临床试验,由于交叉研究设计,近90%的患者接受了DCVax-L的治疗, 平均总体生存期为23.1个月(术后),其中223/331名患者生存期超过30个月,仅7名患者出现了3或4级副反应,因此在新诊断GBM患者中具有一定的有效性、安全性以及可行性2。
ICT-107是一类 靶向6个特异性靶点的自体DC疫苗。研究人员在胶质瘤样本中筛选了6个GBM特异性分布的抗原,分别是HLA-A1限制性的MAGE-1、AIM-2以及HLA-A2限制性的EGFR-2(HER2/neu)、TRP-2、gp100、ILI3Rα2,该6个抗原在83%的肿瘤细胞中全部表达。该多靶点疫苗既能起到改善GBM免疫抑制环境的作用,一定程度上也能克服GBM的肿瘤异质性。
Ⅰ期临床试验中在21名GBM患者身上有很好的耐受性,部分患者也表现出显著提高的免疫水平和生存优势,随访40个月有6/16名新诊断GBM患者未出现肿瘤复发。本研究是继之的 Ⅱ期临床研究,进一步就新诊断GBM患者中 ICT-107的安全性、有效性以及对免疫系统的调控程度扩大范围进行研究。
研究方法
1)ICT-107
受试者的外周血中分离单核细胞,利用细胞转化因子促进单核细胞转化为DC细胞,分别与6种预选的合成抗原多肽共孵育,获得致敏DC细胞疫苗ICT-107(以未经多肽致敏的DC细胞作为对照)。
2)患者入选标准
18岁以上,组织学证明GBM,经过肿瘤全切手术(影像学无增强残余病灶),或者次全切(增强残余病灶小于1c m 3 或交界区100m m 2 残余病灶),经过6周的放疗以及至少50%的同步TMZ化疗(注:标准方案同步TMZ治疗为75 mg/m2/天,共42天),且无进展性疾病。其他标准包括KPS评分≥70%,HLA-A1+或HLA-A2+分型等。(排除标准详见图1)
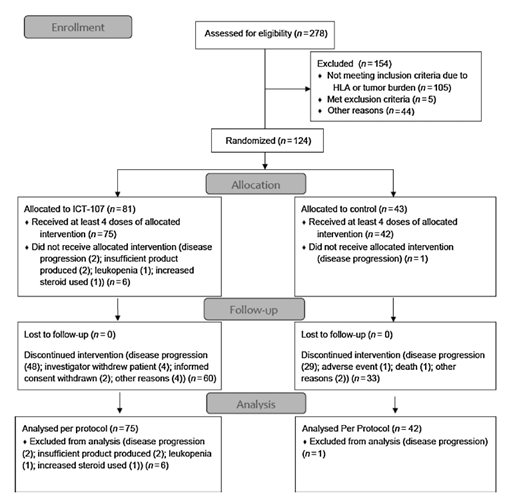
图1. 本研究入选排除标准及流程
3)设计方案
本研究为随机双盲对照II期临床研究,患者2:1分配到 实验组(ICT-107)以及对照组(未致敏处理DC细胞)中,给药方式为腋下皮下注射给药,完成放化疗4周为疫苗诱导期(1周注射1次),随后为维持期(TMZ治疗第1、3、6、10程的第21天注射,完成12程化疗后每6月注射一次,直至试验结束)。
4)观察结局
首要结局:OS(与对照对比);
次要结局:PFS,安全性,可耐受性,患者免疫反应以及相关预测因子。
5)试验指标检测
免疫检测:利用IFNα ELISpot体外检测患者肿瘤组织中相关抗原的免疫反应。利用多聚体检测HLA-A2阳性患者的免疫反应,并用Monte Carlo方法综合多种免疫反应参数确定反应强度的阈值。
生存质量评估:KPS评分,激素用量以及患者自述生存质量(癌症治疗功能性评估脑-量表,Functional Assessment of Cancer Therapy-Brain,FACT-BR)评估,在基线、维持期以及试验结束时分别进行评价。
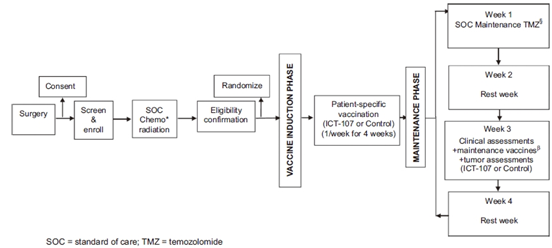
图2.试验流程图
实验结果
1)毒性评价
最常见副作用为乏力、呕吐、眩晕,但是在实验组和对照组中无显著差别。

2)有效性评价
整体OS,ICT-107与对照无显著差异(17.0m vs 15.0m,p=0.58);PFS,ICT 107显著优于对照(11.2m vs 9.0m,p=0.011);
亚组分析:HLA-A2+患者中,MGMT启动子甲基化的患者mPFS可达24.1m(对照8.5m,p=0.004),OS为33.7m(ICT-107)和23.9(对照)(p=0.65)。非MGMT启动子甲基化患者中PFS和OS均无显著性。而仅HLA-A1+患者合并MGMT启动子甲基化中平均OS有显著提升(47.6m vs 25.8m,p=0.049)。
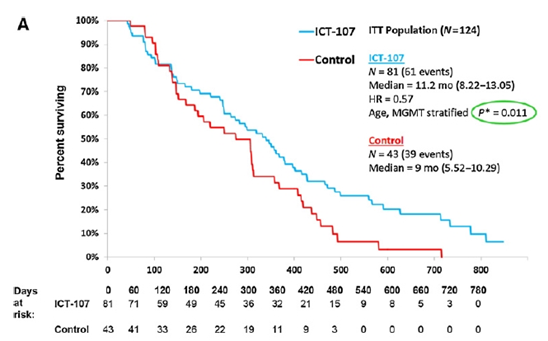
图3. PFS K-M曲线
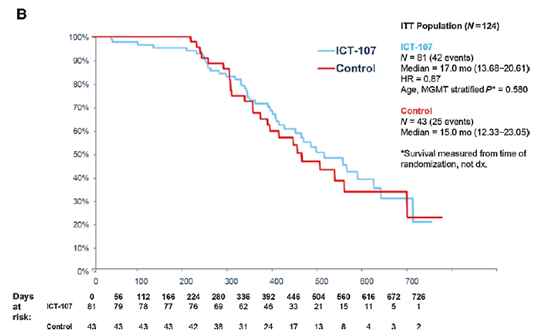
图3. OS K-M曲线
3)免疫指标及生存期评价
测量与CD40配体相关的DC细胞的IL12的表达量,发现IL12的表达水平和患者达到生存显著相关。108人经检测免疫水平,发现ICT-107实验组中34/68(50%)人为应答者,对照组中13/50(33%)为应答者(p=0.058)。而实验组中应答者mOS为433天,対照组为407天(p=0.05)。
4)生存质量评价
FACT-BR量表测量在实验组以及对照组中无明显差异。而实验组中KPS评分显著提高。
文章限制
1)样本数量小,大部分HLA-A1+亚群患者均不表达目标抗原,而HLA-A2+患者大多表达目标抗原,但唯一有显著性生存期延长的就是HLA-A1+伴MGMT启动子甲基化的群体。该矛盾结果可能来源于较小的样本人群。
2)经免疫治疗的PFS可能出现假性进展,造成偏差。假性进展更容易在实验组出现,因此造成实验组的PFS偏短,实际治疗效果可能更优。( Ⅱ类错误)
小结
本研究报道了DC疫苗ICT-107治疗新诊断GBM患者的II期临床研究结果,从疫苗的安全性、有效性、免疫诱导性以及对生存质量的影响等方面进行分析,证明其对GBM潜在的治疗效果,推动进一步临床研究。
1)ICT-107治疗组患者 PFS显著延长。
2)生存质量方面两组接近,实验组的 KPS评分更优。
3)仅 HLA-A1+患者伴MGMT启动子甲基化亚组,实验组平均OS显著长于对照组。
4)ICT-107实验组 免疫应答者比例略高于对照组,而 实验组中免疫应答率与生存期相关。