最全CAR-T药物上市审批总结
2020年6月6日,南京传奇生物在美国纳斯达克上市,CAR-T药物再次成为行业热点话题。而CAR-T药物在国内的注册审批情况又是如何呢?下面是笔者总结的CAR-T药物的审批历程和趋势。
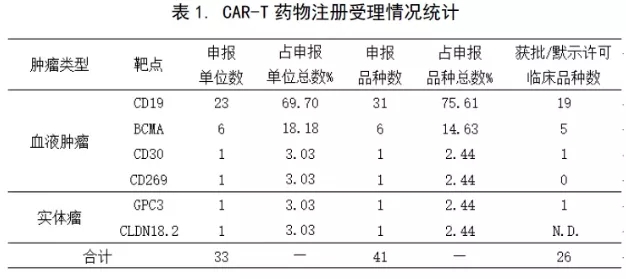
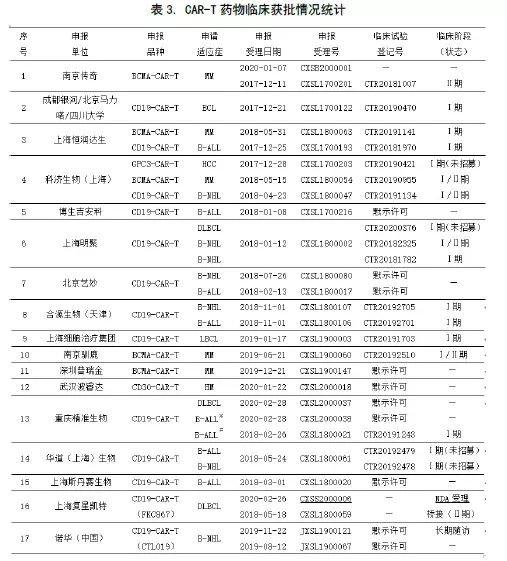
自南京传奇于2018年3月13日拿到国内首份CAR-T药物临床试验批件以来,CAR-T药物研发项目出现井喷式增长。截止2020年5月31日,共有41个该类药物的IND申报获得CDE受理,适应症和靶点的申报情况见下表1。
CLDN18.2:Claudin18.2;GPC3:磷脂酰肌醇蛋白聚糖3;N.D.:在审批中。
【注】①获批开展临床试验期间,申请增加新适应症且获受理的新临床试验申请(有新受理号),按新的申报品种计数。②同一个受理号下,申报有几种适应症,按一个申报品种计数。因重大变更(试验方案、药学、非临床研究重要安全性发现等)提交的补充申请,按同一申报品种计数。③进口药品注册申报的长期随访申请(有新受理号),按同一申报品种计数。④NDA申请,按同一个IND申报品种计数。
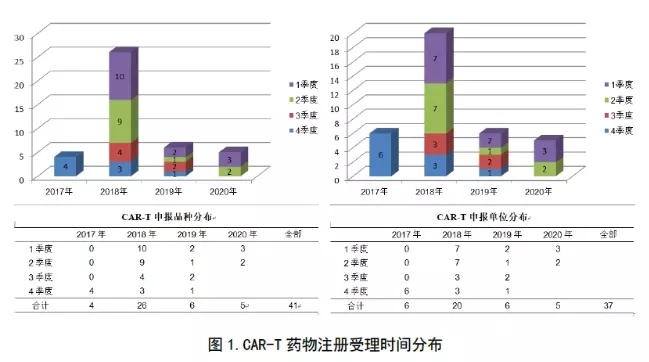
在41个受理的注册申请中,涉及28家申报单位和6个靶点。因为不少单位申报了多个适应症和靶点,故按适应症和药物靶点统计,累计有33家。按年份季度统计后,累计有37家(见下图1)。
从图1中可见,无论从申报品种数,还是从申报单位数上说,2018年堪称CAR-T注册申报最“拥挤”的一年。尤其是前两季,申报品种19个,申报单位累计达14家,差不多占到迄今申报总数的一半。现在注册数量年均在10个(家)以下,季均在1-2个(家)左右。
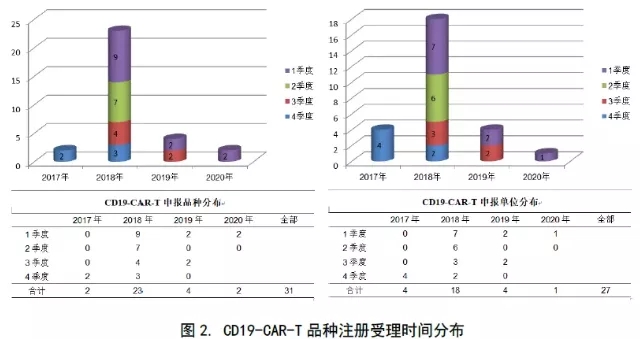
受KYMRIAH和YESCARTA首获上市刺激,CD19同类CAR-T品种国内申报剧增。在2018年中,受理数达到惊人的23个,占迄今CAR-T申报总数的56%(23/41),同类申报的74%(23/31),尤其是在前两季。至2019年,注册数量减至4个(家)(见下图2)。
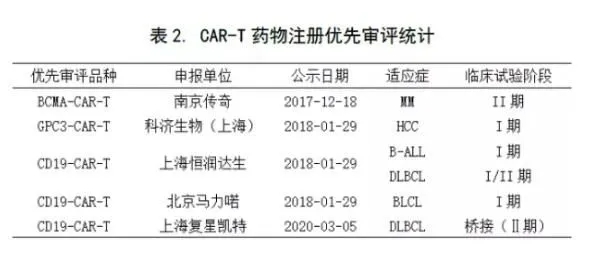
值得注意的是,少数企业着手布局其他CAR-T品种,赢得先机。如南京传奇申报了BCMA-CAR-T(全球首创针对多发性骨髓瘤的新靶点),科济生物申报了GPC3-CAR-T(全球首创针对实体瘤的新靶点)(见下表2)。
2018年这波CAR-T注册热使得审评审批环节极为“拥堵”,申报企业间竞争加剧。相当一部分申报单位未能拿到临床试验批件,或获得临床试验默示许可。(【说明】原国家食药监总局(CFDA)2018年第50号公告对临床试验审批程序调整为:“自申请受理并缴费之日起60日内,申请人未收到CDE否定或质疑意见的,可按照提交的方案开展药物临床试验”,即默示许可制,于2018年7月24日起实施)
如下表3中所示,获批临床的申报单位共有19家,占总数的67.9%(19/28)。其中,科济生物申报了靶点为CD19和BCMA(针对血液肿瘤)、GPC3和CLDN18.2(针对实体瘤)的 4种适应症,获批3个,2个已进入Ⅰ/Ⅱ期,国内最多。重庆精准生物也获批了三种适应症。获批2种适应症的有南京传奇、上海恒润达生、上海明聚、北京艺妙、合源生物和华道生物。
CTL019:即KYMRIAH。#:B-ALL(3-21岁);※:B-ALL(22-70岁);—:无此项或情况不明
获批临床的适应症有11种,其中血液肿瘤9种,实体瘤2种。除科济生物有两种实体瘤(HCC和胃癌/胰腺癌)适应症申报外,其余单位申报的适应症均为血液肿瘤,包括MM、B-ALL和B细胞源性的淋巴瘤(含B-NHL和DLBCL)。
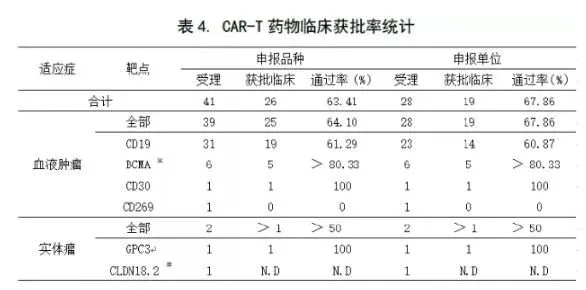
已注册的CAR-T药物中,目前获批临床的品种共有26个,获批率为63.4%(见下表4)。其中,CD19-CAR-T品种获批率约60%。这远低于CDE总体获批率(科志康内部数据,近两年平均获批率为84% )。
※:有一个品种还在60天默示期内;#:申报刚获受理,审批中;N.D:审批中,结果未定。
目前,大多数单位的申报品种尚处在临床Ⅰ期阶段,甚至临床试验还未启动。进展较快的有南京传奇、科济生物、上海恒润达生和重庆精准生物,以及上海复星凯特和诺华(中国)。前者有先发优势,且技术实力雄厚,后者同样开展较早,也有相对成熟的经验可以引进消化。
据笔者了解,2020年2月26日,YESCARTA(CD19-CAR-T)在国内的对应品种——复星凯特的益基利仑赛注射液(拟定名,代号FKC867)的新药上市申请(NDA)已获受理,用于治疗二线或以上系统性治疗后复发或难治的LBCL成人患者,包括非特指型DLBCL、PMBCL(原发性纵隔B细胞淋巴瘤)、HGBCL(高阶B细胞淋巴瘤)和TFL(滤泡淋巴瘤转化的DLBCL)。这是迄今为止国局正式受理上市申请的首个CAR-T细胞治疗产品。
对于复发难治的多发性骨髓瘤患者,南京传奇不久前更新了其BCMA-CAR-T治疗的Ⅰb/Ⅱ期临床的长期随访数据(中位数为11.5个月),显示其总有效率为100%,完全缓解率为86%,9个月无进展生存率为86%。
同样地,科济生物报告的最新随访结果也显示,在经过多线治疗的多发性骨髓瘤患者中,经BCMA-CAR-T治疗后,显示出良好的安全性和显着的有效性,完全缓解率接近 80%,中位无进展生存期已达到 16.6个月。
两者数据非常接近。那么,他们都有希望在今年年底前获批上市吗?
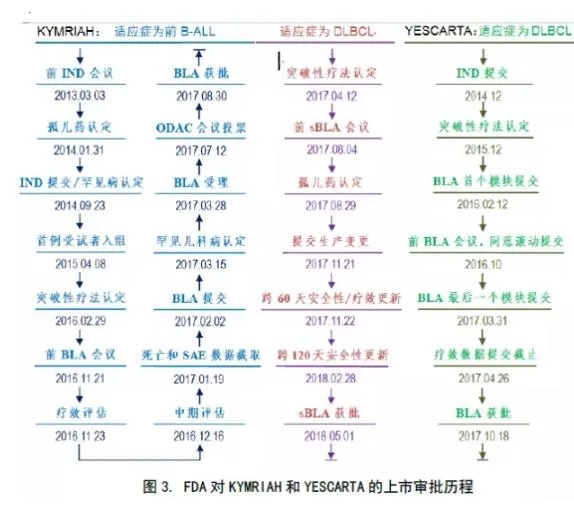
或许,我们稍稍考察一下已获批上市的CAR-T类药品——诺华的KYMRIAH和凯特(现为吉利德)的YESCARTA,他们的上市之路,可能会得到一些启发(见下图3)。
IND:新药临床试验申请;BLA:生物制剂上市许可申请;ODAC:肿瘤药物咨询委员会;SAE:严重不良事件;sBLA:BLA补充申请。
观点
对于用于前B-ALL适应症的申报,KYMRIAH从IND提交到BLA获批,差不多经过了近3年的时间,即便是用于DLBCL适应症的补充申请,也用了1年左右。YESCARTA用于DLBCL适应症的申报情形与之相仿,也花了3年左右的时间。
CDE对NDA的标准审批流程是150个工作日。结合KYMRIAH和YESCARTA的坎坷审批历程来看,南京传奇和科济生物的CAR-T品种在年底前上市将存在很大不确定性,审批历程也可能存在不少挑战。相比之下,复星凯特和诺华(中国)凭借先前的成功审批经验,或许会顺利一些。
2020年,对于CAR-T药物来说,注定是一个暗潮涌动的一年。南京传奇能否再次创造传奇,让我们拭目以待。