综述 | Cancers:天然杀伤细胞发育和功能的转录调控
论文ID
原名:Transcriptional Regulation of Natural Killer Cell Development and Functions
译名:天然杀伤细胞发育和功能的转录调控
期刊:Cancers
IF:6.162
发表时间:2020.6
通讯作者:Dandan Wang, Subramaniam Malarkannan
通讯作者单位:美国威斯康星州密尔沃基市威斯提血液研究所
DOI号:10.3390/cancers12061591
主要内容
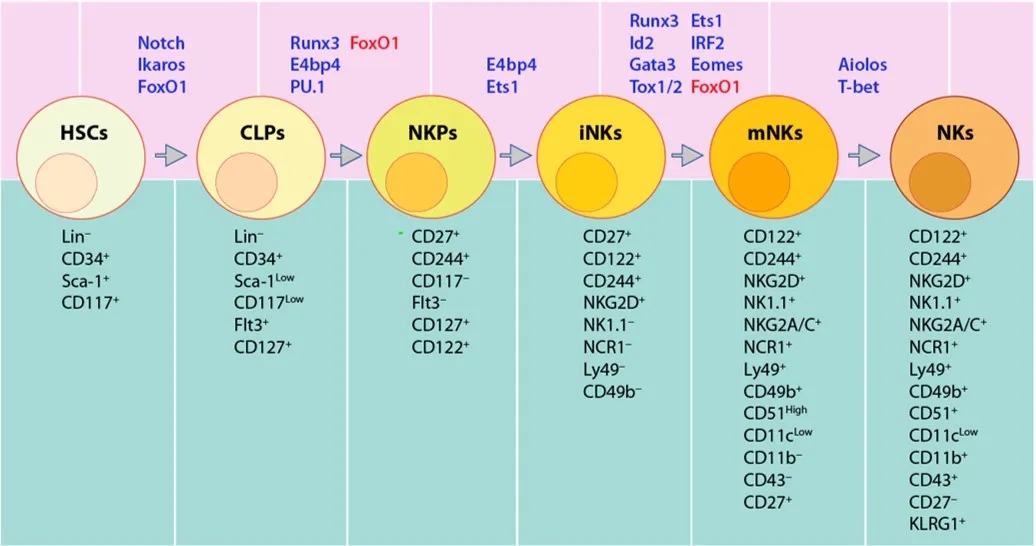
1.NK细胞发育
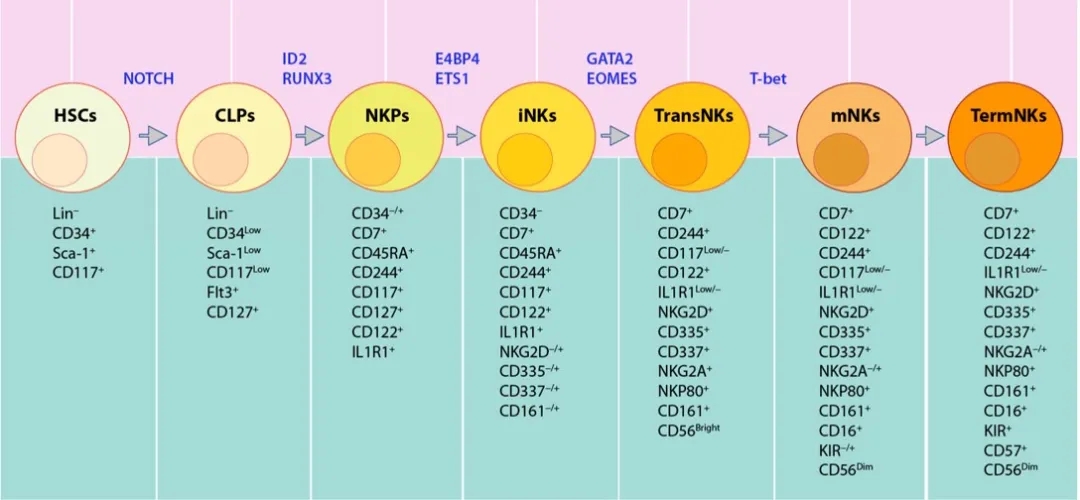
人和鼠的NK细胞起源于骨髓(BM)中多功能造血干细胞(HSCs)。鼠NK细胞主要在骨髓中发育,而人的外周器官(如淋巴结,脾脏和扁桃体)也支持NK细胞发育。淋巴启动的多能祖细胞(LMPPs)是第一个源于HSC 的祖细胞,之后经历淋巴祖细胞(CLP)阶段,NK祖细胞(NKPs)阶段,最终分化为成熟的NK细胞。利用不同的细胞表面标志确定其发育阶段。鼠NK细胞发育起始于Lin-Sac+CD117+HSCs分化为Lin−ScalowCD117lowCD135 (FLT3)+CLPs(图1)。人NK细胞发育始于Lin-CD34+HSCs分化为CD45RA+CD133+ LMPPs(图2)。人类NK细胞占健康成年人外周血单核细胞(PBMC)中循环淋巴细胞的5–20%
2.细胞因子在NK发育中作用
图2. 人NK细胞发育过程及涉及的转录因子
2.1 SCF,Flt3,c-Kit和IL-7控制 HSC向LMPP和CLP的定向转化
细胞因子, FMS样酪氨酸激酶3配体(Flt3L,也称为Flk2)和干细胞因子(SCF)促进了HSC向CLP分化。Flt3和c-Kit分别与Flt3L和SCF相互作用。Flt3或c-Kit缺乏的小鼠,其CLP数量减少。单独的Flt3L或SCF不能驱动NK细胞扩增和自CD34 + HSC的分化,而Flt3L或SCF与IL-15协同可显著增强NK细胞的增殖能力。Flt3L还可以诱导CD122表达,从而增强IL-15信号传导。SCF能够增强MAPK介导的人NK细胞增殖。IL-7受体(IL-7R)由独特的IL-7Rα(CD127)和γc亚基(CD132)组成。CD127的表达标志着CLP阶段的结束和NKP阶段的开始。Il7或Il7ra缺乏的小鼠都表现出胸腺NK细胞发育以及T和B细胞分化的缺陷,而外周和脾NK细胞没有表现出任何明显的缺陷。在人类中,IL-7Rα在CD56bright细胞中高表达,需要与IL-7相互作用来抑制CD56bright亚群的凋亡。
2.2 IL-15是NK细胞发育和成熟的必需细胞因子
IL-15是NK细胞发育和存活所必不可少的,但对于NK细胞谱系的确定则不是必需的。IL-15R复合物由IL-15Rα,IL-2Rβ和γc组成。Il15-/-,Il15ra-/-,Il2rb- /或γc-/-小鼠中NK细胞数目明显降低甚至缺乏;IL-15的过表达导致NK细胞数量增加。反向提呈细胞的胞内IL-15可与IL-15Rα结合形成复合物,这种独特的呈递机制解释了传统NK细胞无法在Il15ra-/-小鼠的BM中存活。反向呈递细胞包括DC,巨噬细胞,基质和上皮细胞。体外试验中IL-15诱导人CD34 + HSC分化为CD3ε-CD56+ NK细胞。在小鼠中,IL-15R介导的信号通路对NKP分化为mNK至关重要重,但对NKP的生成不是必需的。IL-15其下游信号分子STAT5和JAK3也是NK细胞发育中必不可少的成分。
2.3 IL-21与IL-15和IL-2协同,可增强NK细胞的细胞毒性
临床上IL-2和IL-15存在的条件下,IL-21可被用于扩增和刺激离体的人NK细胞。IL-21主要是由辅助性T(Th)细胞和NKT细胞产生,从而建立了NK细胞和T细胞之间的联系。IL-2是NK细胞存活,激活和扩增的关键细胞因子。IL-21与IL-2协同上调NKp46,NKG2A,穿孔素和颗粒酶B的表达,进而增强NK细胞毒性。此外,IL-21与IL-15协同,可促进人BM祖细胞扩增并增强NK细胞的功能。在鼠中,尽管IL-21增强了活化的NK细胞的细胞毒性和IFN-γ的产生,但它抑制了IL-15介导的静息NK细胞的扩增。上述结果表明鼠和人NK细胞对该细胞因子的反应不同。
2.4 IL-12和IL-18是髓样细胞和NK细胞的中介者
IL-12和IL-18都由激活的DC和巨噬细胞产生,可增强NK细胞的细胞毒性和IFN-γ的产生。骨髓细胞与NK细胞的相互作用,可建立起针对肿瘤或感染的免疫反应网络。IL-12刺激IFN-γ的产生;IL-12与IL-2,IL-15或IL-18协同,可显著增强NK细胞IFN-γ的产生,此外,IL-12还可以促进NK细胞增殖。 IL-18被定义为IFN-γ诱导因子,IL-18或IL-18R缺陷小鼠的NK细胞中IFN-γ产生和细胞毒性均降低,但在体外仅IL-18不足以诱导IFN-γ。IL-18与IL-2,IL-15或IL-21协同,能够上调IFN-γ并增强人类NK细胞的功能。
3.NK细胞发育和功能的转录调控
多种TF网络在人和鼠NK细胞的发育和功能中发挥重要作用。
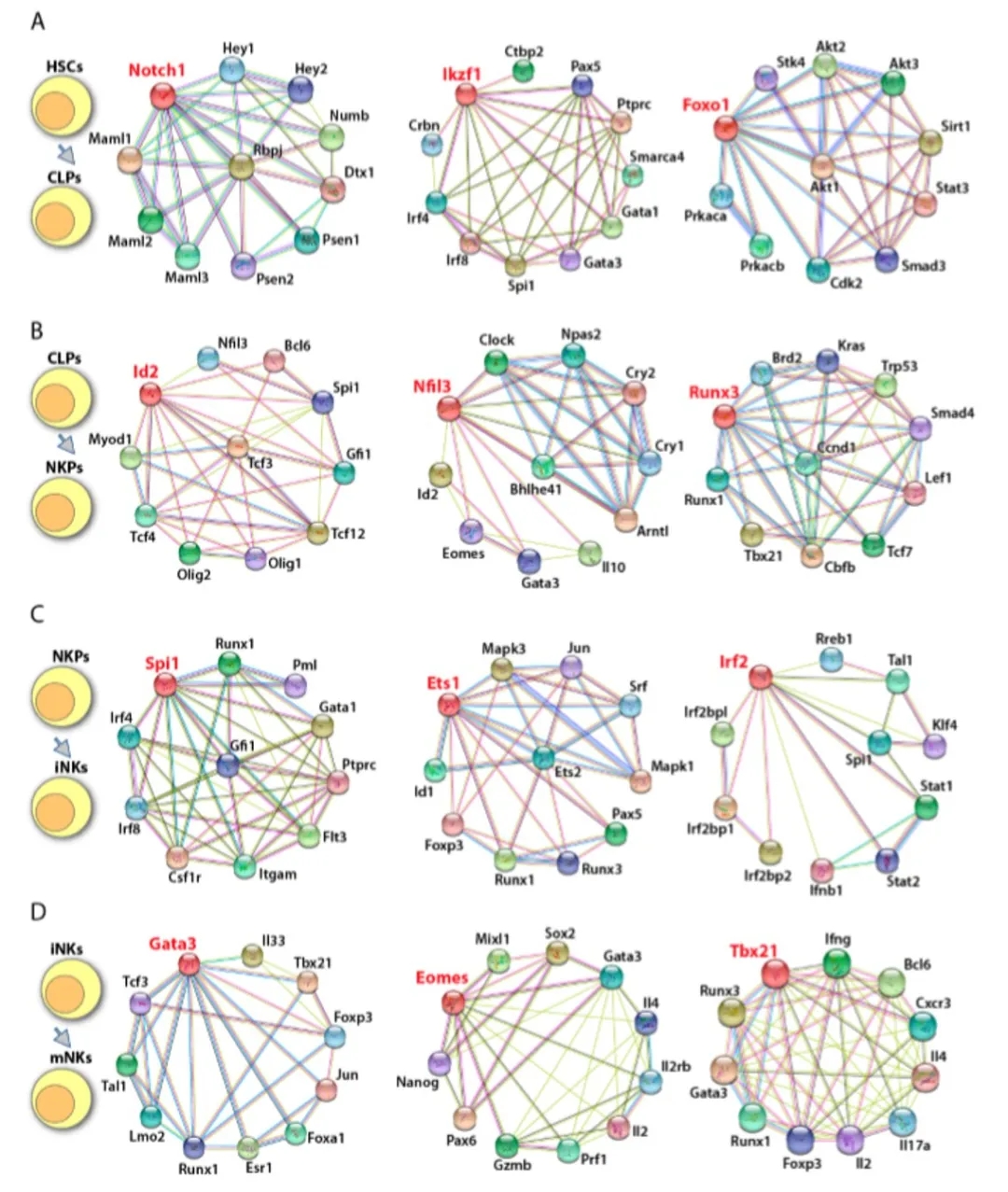
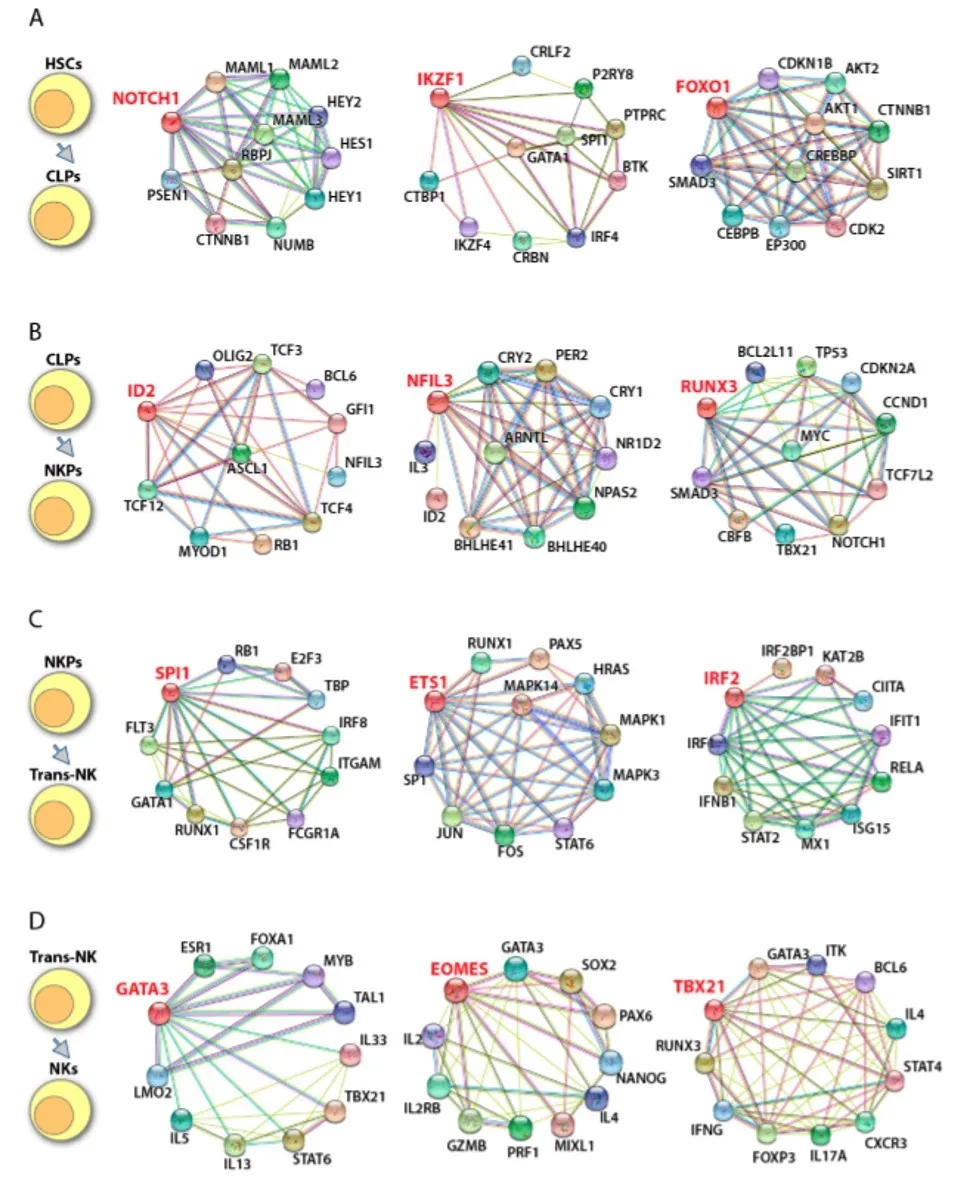
图3. 鼠NK细胞发育的转录因子调控网络
图4. 人NK细胞发育的转录因子调控网络
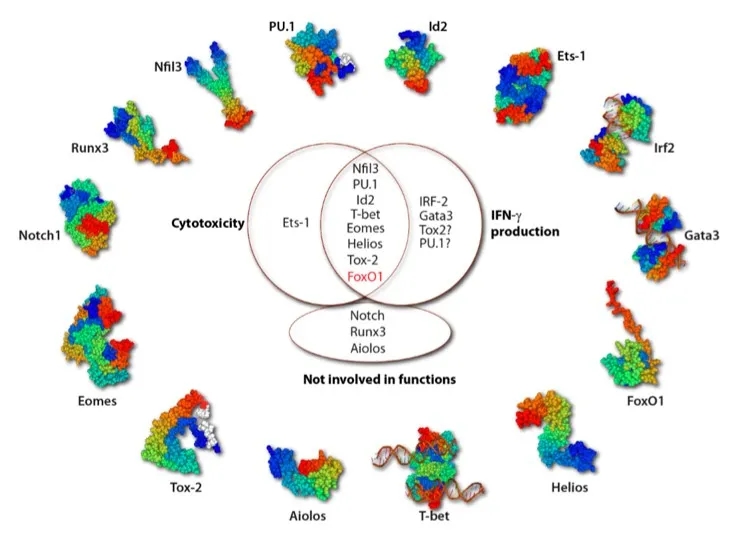
图5. 调控NK细胞效应功能的转录因子
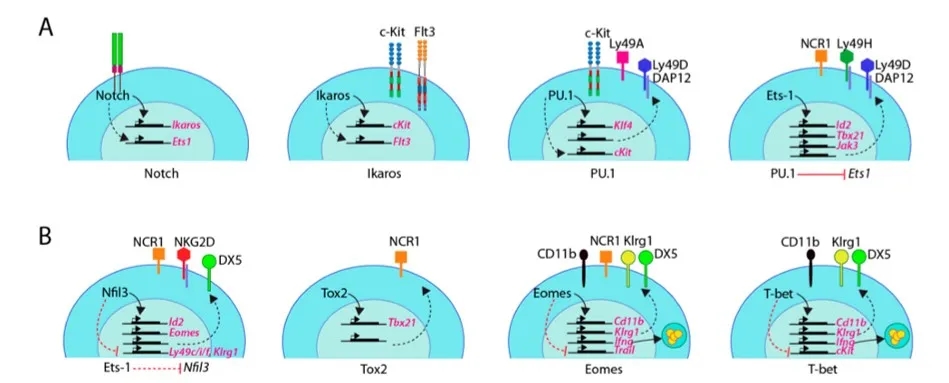
图6. 鼠NK细胞转录因子的下游靶标
3.1 Notch1调节 HSC的生成及向CLP的定向转化
高度保守的Notch家族是决定细胞命运的重要因子。Notch1和Notch2在造血前体细胞中表达。Notch1对于卵黄囊中HSC的生成至关重要。胎儿发生肝脏造血后,Notch信号通路对于促进胸腺中T细胞的发生并抑制其他谱系命运(包括B细胞,DC和髓样细胞)至关重要。但Notch信号并不限制NK细胞谱系的形成。在没有谱系特异性因子的情况下,当与Notch配体一起培养时,pro-B细胞或胸腺细胞可以重塑为NK细胞。在Vav1-Cre-Rbp-JKfl/fl小鼠中,不仅早期BM中NKP数量减少,而且脾NK细胞的成熟受阻。Rbp-JK是Notch信号的重要转录因子。因此推测,NK细胞的发育紊乱可能由于Rbp-JK缺陷型小鼠NKP中Ets-1和Ikaros表达降低。此外,活化的Notch信号可直接通过上调KIR表达来增强NK细胞的细胞毒性。这些研究表明,Notch可增强NK细胞的分化能力,但不是必需的。
3.2 Ikaros调节HSCs至早期LMPPs的定向转化
Ikaros是Ikaros TF家族成员之一(其它为Aiolos, Helios, Eos和Pegasus),各成员的表达具有组织特异性。Ikaro是淋巴谱系特异的主要调控因子。Ikaros无义突变小鼠表现出HSC,B和NK细胞谱系的缺乏,但保留了部分T细胞分化潜能。Ikaros缺乏的小鼠缺乏HSC,导致脾脏中NK细胞丢失或在体外系统中NKP无法分化为成熟NK细胞。在Ikaros缺乏的淋巴祖细胞中,Flt3表达完全丧失,c-Kit水平降低。ChIP序列数据显示,与WT小鼠相比,Ikaros缺陷小鼠的B祖细胞中c-Kit的表达量下降最为显著。尽管没有直接证据表明Flt3是Ikaros的靶基因,但Flt3和c-Kit表达的调节可部分解释这些小鼠的NK细胞缺陷。
Aiolos和Helios均在NK细胞中表达,分别有助于NK细胞的成熟和功能发挥。Aiolos在人NK细胞中表达显著,尤其在CD56dimNK细胞中比在CD56bright更高。Aiolos缺乏小鼠中CD11b-CD27 +和CD11b + CD27 + NK细胞数量更多,而CD11b + CD27−数目较少。在Aiolos缺陷型小鼠中,响应IL-15的高速增殖表明它阻止了成熟前的分化,而不是抑制增殖。Aiolos是NK细胞清除肿瘤细胞并产生IFN-γ必不可少的转录因子。Helios被定义为T细胞活化标记,在效应性Treg细胞中起着重要作用。NK1.1 + CD11b +亚群中Helios下调削弱了NK细胞的效应功能,表明Helios可能能够改变NK细胞的反应性阈值。ChIP分析显示Helios与FoxP3启动子区域结合,而敲除Helios则导致T细胞中FoxP3的下调。先前的研究表明,FoxP3不仅抑制T细胞功能,还通过免疫抑制性细胞因子IL-10抑制FoxP3修饰的人NK细胞功能。但需要进一步研究Helios对 NK细胞功能的调节机制。
3.3 Ets家族对NK细胞的调控作用
3.3.1 PU.1调节CLPs至NKPs的定向转化
PU.1表达始于CLP时期,PU.1缺乏的小鼠死于胚胎晚期或出生后且NK细胞从胎儿期肝脏转移到外周之前。我们使用造血细胞嵌合体小鼠研究PU.1对NK细胞的影响,在 PU.1缺陷嵌合体小鼠中尽管NKP和iNK数目降低,NK细胞在BM,脾脏和肝脏中广泛存在,表明PU.1 内在调节CLP至NKP的定型。PU.1可调节NK细胞发育,PU.1缺乏的小鼠无法响应IL-2,SCF,Flt3和IL-7的组合刺激而驱动NK细胞的扩增和激活,而Est-1可以一定程度弥补PU.1的缺失。此外,PU.1可通过其下游转录因子Klf4调节特定的组织外环境进而影响NK细胞发育。
3.3.2 Est-1调节NKPs转化为iNKs
Ets-1最早表达于LMPP阶段,在NKP的晚期达到峰值并保持至NK阶段。Ets-1-/-小鼠实验表明,Ets-1影响BM和脾脏中50%的iNK和80-90%的mNK,但不影响NKP数目,表明存在NK细胞发育终止现象。此外,Est-1影响iNK后期发育,NKp46-Cre-Ets-1fl/fl小鼠模型显示在iNK后期条件性删除Ets-1后,BM、脾脏和血液中的总NK细胞数量明显减少。Ets-1-/-小鼠表现出与IL-15或γc链缺乏小鼠相似的表型缺陷,Ets-1-/-小鼠的mNK细胞中IL-2,IL-15的产生及其受体的表达与野生型小鼠相当。在人NK细胞中,IL-2和IL-15刺激可激活ETS-1的表达,此激活过程依赖于MEK1 / ERK1途径。IL-15信号下游的两个重要分子Jak3和Stat5都与Est-1密切相关,Stat5和Ets-1蛋白形成复合物以激活T细胞基因转录,Ets-1可直接结合Jak3启动子区以激活转录。这些或许能够解释Ets-1缺陷小鼠中NK细胞的发育障碍。此外,Est-1可激活Id2转录和促进T-bet表达,这些都是NK细胞发育中的关键TF,无论 Id2或T-bet降低都会阻碍NK细胞的成熟。Ets-/-小鼠残留的mNK细胞其细胞毒性明显降低,可能由于NK细胞活化受体的丢失或Ets-1限制了细胞因子驱动的NK细胞活化,仍需进一步的研究以了解Ets-1在NK细胞发育中的作用。
3.3.3 Mef调节NK细胞的成熟
Mef由 Ekf4编码,在髓系和淋巴系细胞中均能检测到。 Mef缺乏的小鼠其体内T,B细胞发育正常,而脾脏中只有40%NK和30%NKT细胞,且这些NK细胞效应功能受损。推测Mef可能在NK细胞的成熟中发挥作用,但需要直接的证据来明确NK细胞发育受阻的阶段。与PU.1一样,由于仍可检测到外周NK细胞,说明Mef对NK细胞的发育不是必需的。Mef缺陷小鼠的脾脏NK细胞其细胞毒性功能受损,可能的解释是Mef结合到Ets-1结合区和近端Perf1启动子区,从而积极调节穿孔素的表达。
3.4 Runx3调节至iNK阶段的定向转化
Runx3是Runx家族成员,包含一个保守的与DNA序列结合的Runt域,同时与 CBFβ形成异源二聚体,CBFβ的结合不仅增强Runx3与其结合序列的亲和力,并且能够抑制或激活靶基因的转录。Runx3最早在NKP阶段表达,通过与CD122编码基因Il2rb的启动子结合启动转录,以控制NKP的表型。CBFβ缺乏将导致细胞发育阻滞在NKP前期阶段。此外,Runx3缺乏的小鼠体内,成熟的CD27-CD11b + NK细胞百分比和细胞数目显著降低;成熟的NK细胞标志物的表达也降低。Runx3结合KIR和NKp46基因的启动子区,并激活在人NK细胞特异性受体的表达。这些表明Runx3在NK细胞成熟中起作用。Runx3在一定程度上调节NK细胞效应功能,有研究显示Runx3缺陷型NK细胞产生穿孔素,颗粒酶以及裂解YAC-1细胞的能力并与WT相当;尽管表型相对不成熟,在IL-2和IL-12下,这些NK细胞产生IFN-γ的能力增强。此外,ChIP结果表明,Runx3与Ets-1和T-box协同作用,激活Tnfrsf9和Styk1的转录来促进IL-2 / IL-15介导的NK细胞增殖。
3.5 E4BP4调节从NKP到iNK的转化
E4BP4(E4-结合蛋白),由Nfil3基因编码,在NK和NKT细胞中高度表达,在NK细胞中的表达始于CLP阶段,以iNK及mNK含量最高。Nfl3 -/-小鼠模型数据表明,E4bp4是NKP向iNK过渡过程中的重要转录因子,这些小鼠骨髓中NK细胞数量明显降低,并且血液或脾脏中几乎检测不到NK细胞的存在, 但骨髓中CD122 +NK1.1-CD3ε-NKP细胞与WT小鼠相比无差异。Brady等人报道,在Nfl3-/-骨髓细胞中,NKPs的百分比及其绝对数目也显著降低;Nfl13-/-小鼠中残留的少量NK细胞产生IFN-γ的水平较低并伴溶细胞功能障碍;Nfl13-/- BM嵌合体也无法挽救该缺陷,表明这些发育缺陷是NK细胞固有的。进一步探究Nfl13-/-小鼠发育缺陷是否涉及细胞因子信号通路。早期研究表明,Pdk1-/-和Il15rα-/-小鼠均显示出较低的CD122 + NK1.1 + CD11b- iNK细胞水平,过表达E4bp4可以挽救NK细胞发育缺陷,细胞水平实验也得到相似结论。这表明E4bp4是IL-15的下游靶标,其表达取决于IL-15-PI(3)K-PDK1-mTORC1-E4bp4信号通路,大部分E4bp4下游靶标尚未明确。有研究指出Eomes和Id2也是E4bp4下游的必需转录因子,指导NK细胞的发育。
3.6 ID2和E蛋白调节iNK至mNK的转化
DNA结合抑制(Id)蛋白包括Id1到Id4,它们通过与E蛋白异源二聚化并阻止其与DNA结合而发挥转录抑制作用。E和Id蛋白之间的功能平衡控制淋巴细胞的分化,Id3和Id2认为是淋巴细胞谱系的分子开关。Id2是NK细胞中主要表达的Id蛋白。研究表明,Id2-/-小鼠骨髓中mNK细胞数量明显减少,而 NKPs和iNK细胞数量正常,表明Id2不是早期NK细胞发育的必需转录因子,Id2缺乏会阻碍骨髓中iNK后期和mNK前期的细胞发育。从Id2-/-小鼠骨髓移植至WT小鼠导致NK细胞分化受损,表明该缺陷是NK细胞固有的。同样,Id2-/-小鼠脾细胞中NK和mNK细胞总数均减少,而且脾脏NK细胞主要来自胸腺。表明胸腺NK细胞成熟并获得其独特的表型需要Id2。因为Id2通过结合和螯合E蛋白而发挥抑制作用。E2A的缺失可补救Id2-/-小鼠骨髓中的NK细胞分化,但未能挽救脾脏中有缺陷的mNK,这种现象表明组织间不同的需求。Id2还与其他转录因子(如Ets-1,E4bp4和Rb)结合发挥不同的作用。
3.7 TOX对mNK转化为终末成熟NK细胞至关重要
TOX1最早在造血干细胞(HSC)表达,并在NK阶段保持高表达。TOX2从HSC开始低表达,并在整个发育过程中保持渐进性的高表达直到过渡性NK阶段。Tox1-/-小鼠脾脏和BM的NK细胞具有相当数量的NK1.1-DX5-NKPs和NK1.1 + DX5-iNKs,但没有DX5 + mNK细胞,这表明NK细胞发育在iNK后期被阻断,且是NK细胞固有的。在慢病毒介导的人UCB NK细胞中也观察到到类似现象。 TOX2的过表达可增强NK细胞发育并增加成熟NK细胞的数量。ChIP结果显示,TOX2直接结合了Tbx-21(T-bet)启动子区域。TOX2敲低的NK细胞在其过渡性和成熟阶段,细胞中T-bet的表达明显降低。Tbx21过表达可以挽救上述发育缺陷,这表明TOX2可通过T-bet调节人NK细胞的发育。当NK细胞与K562细胞共培养时,TOX2的敲低减少了脱颗粒和穿孔素的表达,造成此效应缺陷的可能原因是在细胞中激活受体的表达降低。Tox在细胞因子介导的激活过程中的作用仍待明确。
3.8 IRF1和IRF2调节iNK至mNK的转化
IRF家族因其与干扰素基因及干扰素刺激调节元件的结合能力而被认定。IRF-1或IRF-2缺陷小鼠表现出严重的NK细胞缺陷。骨髓嵌合实验表明,IRF-1在骨髓微环境中需要基质细胞产生的IL-15。然而,IRF-2导致的 NK细胞缺陷是细胞固有的。Irf2-/-小鼠的骨髓及外周NK细胞总数均显著降低。在脾和肝脏中存在的NK细胞中,CD11b + DX5 +或CD11b + CD43 + mNK细胞百分比降低,但iNK细胞的百分比与WT小鼠相似。尚未明确参与NK细胞发育的IRF-2上游信号分子和靶标。
3.9 FoxO1抑制NK细胞谱系定向分化和NK细胞成熟
FoxO家族包括FoxO1,FoxO3, FoxO4, FoxO6,其中FoxO1在NKPs和iNK高表达,FoxO3在整个NK细胞发育过程中均表达较低,但FoxO1和FoxO3会过多地抑制NK细胞成熟。研究显示,Ncr1-Cre -FoxO1fl/fl和-FoxO3 fl/fl小鼠均具有较多的CD27-CD11b + mNK,少量增加的CD27 + CD11b +和不变的CD27 + CD11b- iNK细胞;而与单敲小鼠相比,双敲小鼠mNK数目并未增加。因此,FoxO1在NK细胞的早期发育中具有主要作用。进一步利用Vav1-Cre-FoxO1 fl/fl小鼠,结果显示其CLPs,NKPs和mNKs的比例增加,iNK比例降低。FoxO1在mTORC2的下游分子,研究表明FoxO1通过mTOR2-AktS473-FoxO1-T-bet轴抑制了iNK向mNK细胞的转化。FoxO1也可直接促进细胞周期抑制基因的转录来抑制NK细胞的增殖。目前尚不清楚FoxO1在mNK中如何发挥作用。
3.10 Eomes和T-Bet相互拮抗,调节NK细胞成熟
Eomes和T-bet是T-box家族TF的两个成员,控制NK细胞发育和成熟的多个方面。Tbx21-/-(T-bet敲除)小鼠中NK细胞发育在NK细胞终末成熟之前被阻断。T-bet缺乏导致CD11b,DX5,KLRG1和CD43的表达降低,同时未成熟标记c-Kit表达增加。将Tbx21-/-小鼠骨髓移植到WT受体后,无法挽救NK细胞的减少。在没有Eomes的情况下,NK1.1 +或NKp46 + NK细胞总数减少。细胞发育阻断在未成熟阶段,因为它们不能过渡到CD27 + CD11b +阶段。来自这些小鼠的NK细胞DX5和Ly49受体的表达显著降低,但TRAIL(未成熟NK细胞表面标记)表达增加。T-bet和Eomes相互拮抗,缺乏T-bet的小鼠NK细胞中表达更高水平的Eomes,反之亦然。T-bet和Eomes的单敲和双敲除实验表明T-bet和Eomes的合作对于NK细胞的发育至关重要,并且它们具有多种功能。T-bet和Eomes均受IL-15和mTORC信号调节。mTOR复合物可以负调节T-bet表达并抑制NK细胞成熟;IL-12和IL-15刺激可上调T-bet的表达。ChIP-seq结果表明,T-bet和Eomes是Stat5的直接靶标,Stat5是IL-15R信号通路下游中的重要分子。相反,T-bet和Eomes协同结合Il2rb启动子区域来激活转录IL-2Rβ。表明T-bet和Eomes在NK细胞发育中起重要作用,但两者的协调机制尚不清楚。
T-bet和Eomes在NK细胞效应功能中的作用逐渐明确。Runx3,E4bp4,Ets-1和Tox2支持T-bet表达,而FoxO1直接与T-bet启动子区结合并抑制其转录。T-bet直接结合ifng启动子区并促进转录。T-bet缺乏的NK细胞在刺激早期产生IFN-γ,但在IL-12和IL-18刺激24h后,不能继续产生并保持高水平的IFN-γ。表明早期IFN-γ的生成与T-bet无关,但持续产生依赖于正常的T-bet功能。此外,T-bet可与NK细胞的Gzmb,prf1和Runx1启动子区域结合,相关研究显示T-bet不足的NK细胞裂解YAC-1靶细胞的能力降低,穿孔素表达降低。Eomes可与T-bet协同增强溶细胞功能,因为与Tbx21-/-Eomes + / + NK细胞相比,穿孔素在Tbx21-/-Eomes +/- NK细胞中表达严重下调。实际上,Eomes也可以激活Gzmb和Prf1的转录并控制Ly49受体的表达。
3.11 GATA家族在NK细胞中的调控作用
GATA2调节人iNK细胞转化为CD56bright细胞,GATA3调节iNK和胸腺NK细胞的成熟。GATA2缺乏综合征具有不同的临床表现,但最可靠的是B和NK淋巴细胞减少和单细胞减少。最近的一项研究显示,其中70%经历严重的病毒感染,35%被诊断出患有HPV或EBV相关肿瘤。这些表明NK细胞介导的抗病毒和抗肿瘤功能缺陷。这些患者的NK细胞缺陷表现为外周NK细胞数目显著降低,CD56bright亚群丢失以及存留的CD56dim NK细胞毒性功能障碍。GATA2在CD56bright细胞中的独特性高表达可以反映其在CD56bright细胞中的重要作用。Gata2基因敲除小鼠在胚胎期死于严重的造血障碍,因此开发NK细胞特异性Gata2敲除模型对研究NK细胞生物学作用非常重要。
Gata3对于常规NK细胞正常发育可有可无,胸腺NK细胞的发育需要Gata3。Gata3缺乏的嵌合体其脾脏NK细胞数量和表面标志物均正常,而肝脏中的NK细胞较少且IFN-γ产生受损。基于NK细胞特异性Gata3缺乏模型的研究显示,脾脏和BM的NK细胞发育均在CD27 + CD11b-,CD27 + CD11b +阶段受阻,表明Gata3促进NK细胞成熟。这些Gata3缺乏的NK细胞不能出骨髓,也不能产生IFN-γ,但仍具有清除YAC-1细胞的功能。小鼠实验显示,使用AMD3100(CXCR4拮抗剂)可导致BM中NK细胞数量减少,脾脏和外周血中数量增加。表明Gata3缺陷的NK细胞的外流障碍与CXCR4信号通路相关。
4.PLZF和Zbtb32在适应性NK细胞中的作用
PLZF(Zbtb16基因编码)和Zbtb32都是是BTB-锌指TF家族成员。PLZF在人和鼠NK细胞中均表达。人类适应性NK细胞中PLZF的表达显著下调,表明PLZF缺乏标志着人类获得了适应性NK细胞。此外,PLZF与人类肝驻留NK细胞的标志物高度相关。鼠巨细胞病毒(MCMV)感染诱导Zbtb32的表达, Zbtb32上调IRF8的转录,对抗病毒和病毒驱动的NK细胞扩增具有重要作用。ILC1s由NK细胞和ILC1组成,都能产生IFN-γ并需要T-bet以发挥细胞功能。但ILC1是无细胞毒性,组织驻留的并且不依赖Eomes的一类细胞。Gata3和PLZF对ILC1s从常规NK细胞的分化起关键作用。PLZF的缺失会显著改变ILCs亚群的发育,但不影响NK细胞发育。条件性敲除造血细胞中Gata3,结果显示PLZF + ILCPs(ILC祖细胞)明显减少。
评论
NK细胞具有杀死恶性细胞而无需事先敏化的能力,因此对于成功制定免疫治疗方法具有临床前景。然而,癌症患者自身的NK细胞不能有效清除肿瘤,这就要求我们深入了解人NK细胞中的信号级联和转录网络,克服癌症患者中存在的免疫抑制。目前TFs的研究大部分是基于鼠模型开展,我们还需进一步明确TFs在人NK细胞中的作用,以开发更安全高效的治疗策略。