再鼎医药首个自主研发抗体新药-CD47单抗获批临床
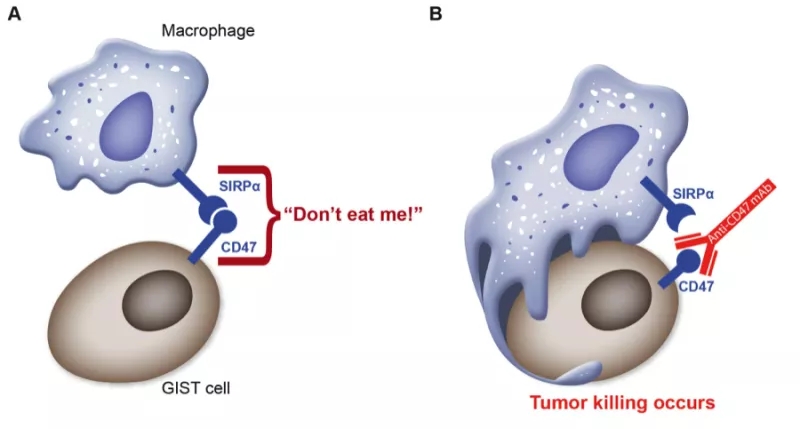
作为抗肿瘤免疫治疗领域热门靶点之一,CD47一直被行业喻为PD1/PDL1抗体之后,肿瘤免疫领域的下一个“明星”。CD47在多种肿瘤细胞上高表达,主要通过与巨噬细胞表面的SIRPα结合释放“别吃我”信号,抑制巨噬细胞的吞噬作用。
目前靶向CD47药物单药和联合治疗在在白血病、淋巴瘤、肺癌、肝癌等常见血液肿瘤和实体瘤的靶向治疗中均显示出良好的抗肿瘤疗效,多个CD47靶向药物已进入临床试验阶段。
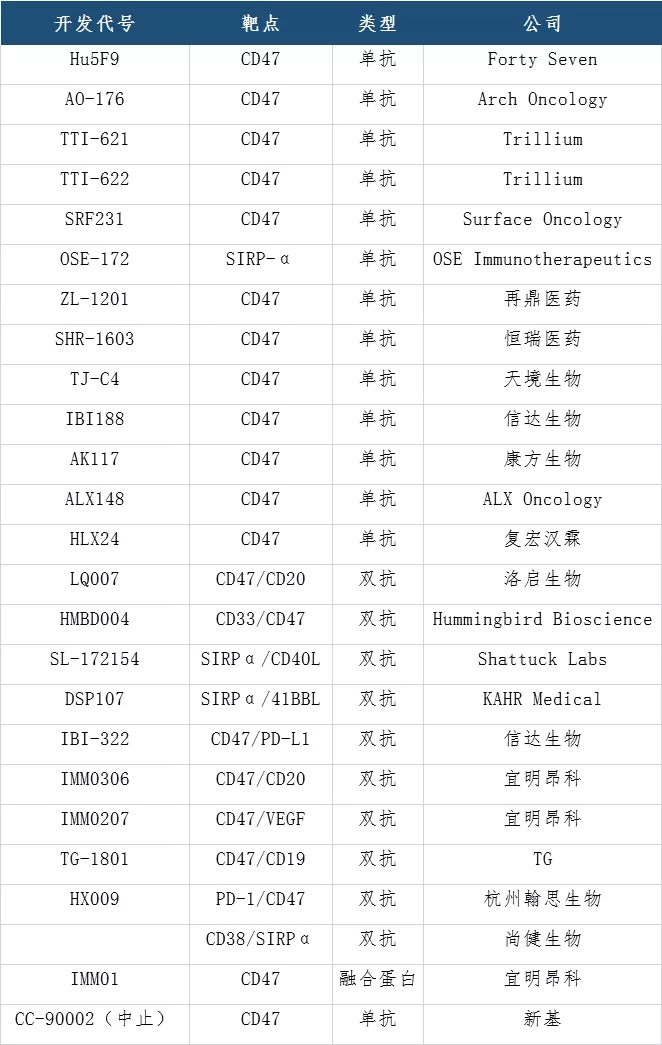
全球针对CD47/SIRPα相关的抗体药物在研项目近40个,在该靶点的进展上Forty Seven的magrolimab走在前列。今年3月,吉利德通过49亿美元收购Forty Seven公司一跃成为了该领域的领头者,国内也已有不少药企拿到了临床批件。
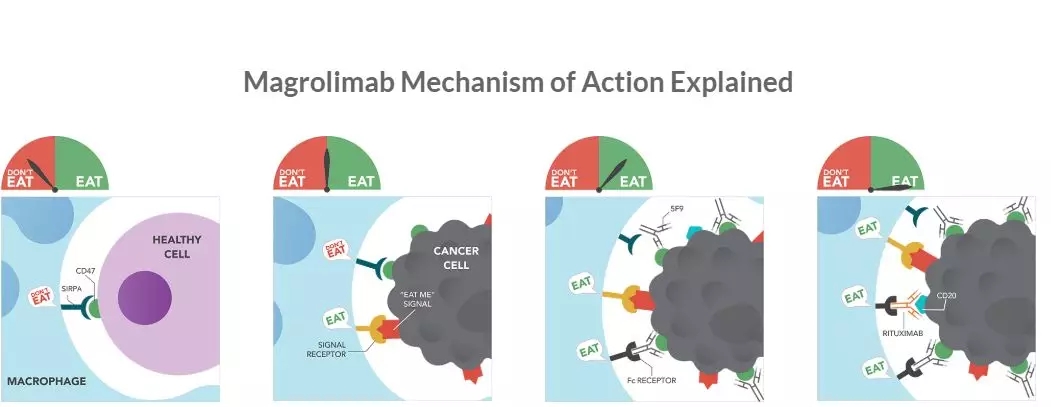
去年magrolimab在美国血液年会上的不俗表现也使得业界重拾了对CD47抗体的信心,公布数据显示,在治疗骨髓增生异常综合症(MDS)和急性髓系白血病(AML)患者的1b期试验中,magrolimab表现出优于azacitidine单药疗法的治疗效果。截至2019年11月18日,MDS患者总缓解率(ORR)达到92%,50%的患者达到完全缓解(CR),33%的患者达到骨髓形态学CR,8%的患者的血液学数据得到改善,8%的患者病情保持稳定。
另外,临床究显示,magrolimab与抗肿瘤药物利妥昔单抗(rituximab)出协同作用,侵袭性和惰性淋巴瘤患者体内吞噬作用明显增强,且未表现出临床上明显的安全隐患。magrolimab对22例淋巴瘤患者(其中95%的患者伴利妥昔单抗难治的疾病)的临床Ⅰb 期试验结果显示,DLBCL患者客观反应率(ORR)为40%,完全反应率(CRR)为33%;FL患者的ORR为71%,CRR为43%。
1月19日,信达生物的1类创新药抗CD47/PD-L1双特异性抗体---IBI322 获批临床,适应症为实体瘤和血液肿瘤。今年3月中旬,该公司的IBI188在美国开展的I期临床研究完成了首例患者给药。拟用于治疗包括非霍奇金淋巴瘤、卵巢癌在内的多种血液肿瘤和实体肿瘤。
前不久(5月11日),康方生物自主研发抗癌新药AK117(CD47单克隆抗体)在澳洲的临床试验中,首例患者已经顺利入组和给药。此前杭州尚健生物和洛启生物也已经分别公布了其CD38/CD47双抗和CD47/CD20双抗专利。
CD47虽然是十分有前景的肿瘤免疫治疗靶点,但一直存难以解决的生物安全性问题。由于CD47也在红细胞表面的广泛表达,靶向CD47药物可导致红细胞的吞噬破坏和凝集,影响其使用的安全性和耐受性。目前已有多家CD47布局药企通过诸如以有效性换取更高的安全性,从分子设计降低CD47药物对红细胞的结合力、构成双特异性抗体以及权衡给药方式等策略来降低靶向CD47所引起的生物安全性问题。(详见:吉利德49亿美元收购CD47抗体先驱Forty Seven,国内药企也在积极布局)
参考出处
1.Https://patentscope2.wipo.int/search/zh/detail.jsf?docId=CN277613838&_cid=JP1-K81C51-61254-1
2.CDE