图文并茂| 专题三: 新一代CAR-T技术。
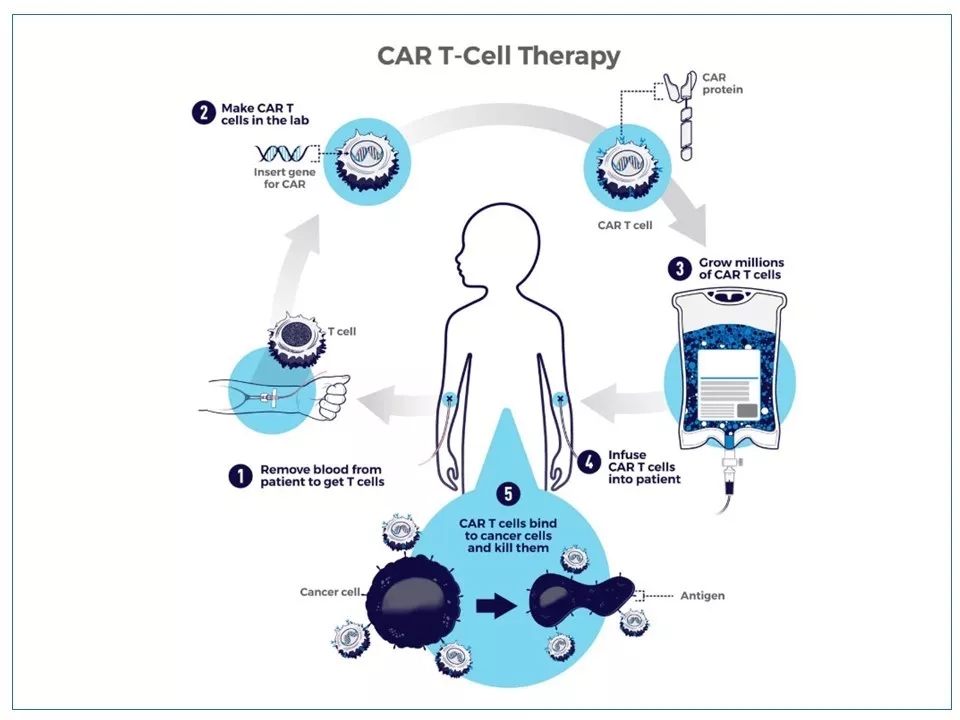
1 CAR-T细胞疗法是近几年来一种新兴的癌症治疗方法:患者的T细胞在实验室中通过基因工程改造后,能够识别、结合其癌细胞上的特定蛋白(抗原),并启动程序杀死这些癌细胞。整个流程主要分5步:(1)抽取患者的血液,从中提纯T细胞;(2)在实验室中将称为嵌合抗原受体(CAR)的基因引入到T细胞中——这种在细胞膜上表达人工设计的CAR蛋白的细胞,就成为了CAR-T细胞;(3)在实验室中培养、繁殖数百万个CAR-T细胞;(4)通过静脉注射将CAR-T细胞重新输入患者体内;(5)CAR-T细胞与癌细胞上的抗原结合后,拉响“警报”,进入战斗状态,最终将癌细胞杀死。
图片来源: cancer.gov
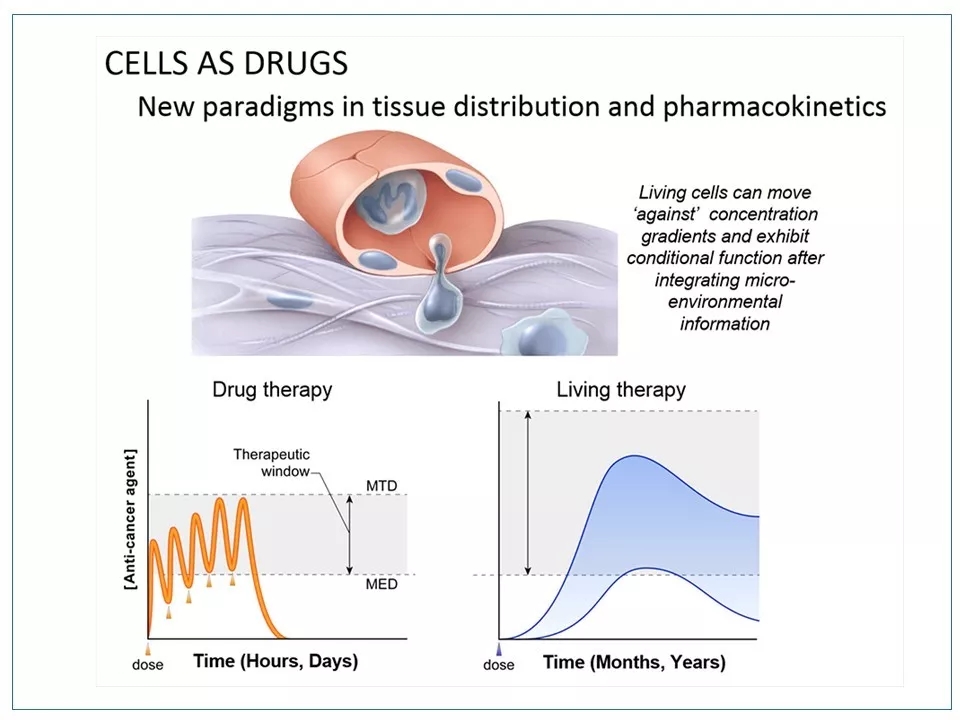
2 相对于药物疗法,细胞疗法的优势是细胞可以完成更复杂的任务,而且疗效持久——注射一次,可以维持数月甚至数年。其缺点是生产过程复杂。而且如果是异体细胞移植,还需要克服来自宿主的免疫系统排斥。也正是因为这点,大部分细胞疗法,包括CAR-T,使用的是患者自己的扩增、改造或加工过的细胞。
图片来源: ccr.cancer.gov
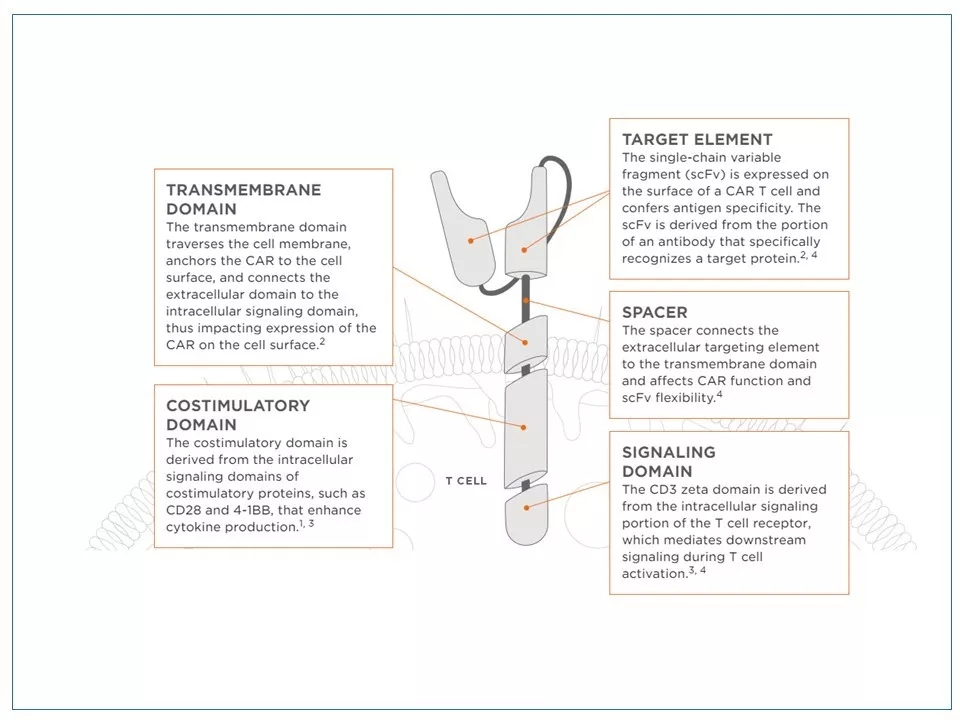
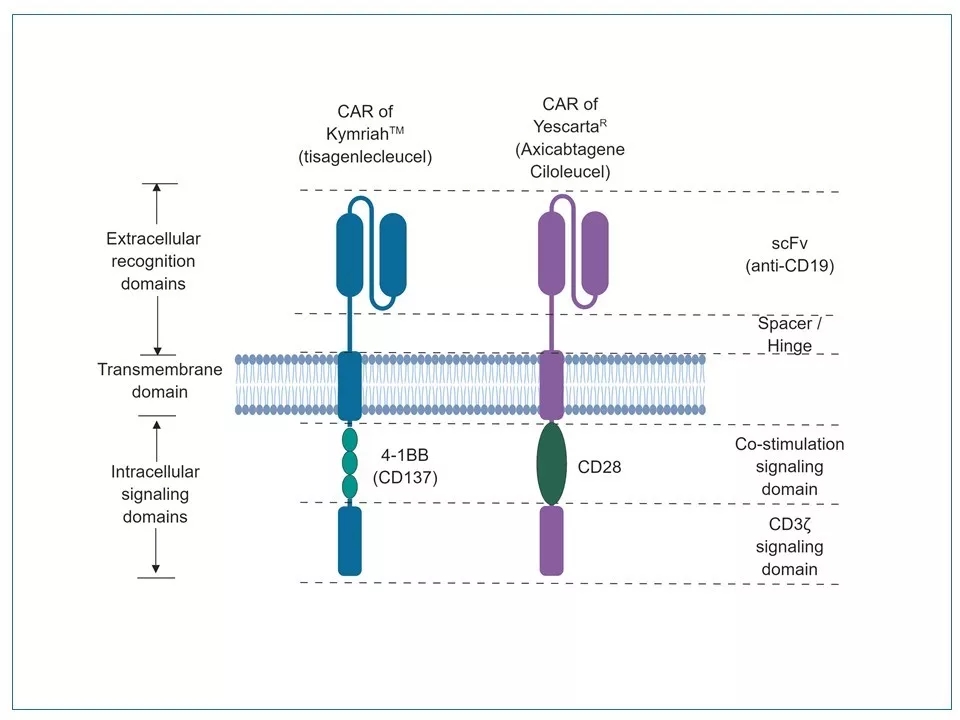
3 CAR-T细胞疗法是一个典型的“模仿自然,高于自然”的创新。CAR蛋白的设计建立在T细胞受体(TCR)的基础上,但在机理上又摆脱了MHC/HLA的限制,并引进了CD28、4-1BB等结构元素。CAR蛋白一般具有以下几个结构域:(1)细胞膜外的抗原识别片段:多为单链可变片段(scFv),相当于一个小抗体;(2)scFv和跨膜域之间的联结区:其长短会影响CAR-T的活性;(3)跨膜域:联结CAR膜外结构与膜内信号传导结构;(4)共刺激域:从第二代CAR-T开始引进,有加强细胞因子表达、促进T细胞增殖的功能;(5) 信号传导域:可激活T细胞,引起对癌细胞的杀伤作用。
图片来源: www.junotherapeutics.com
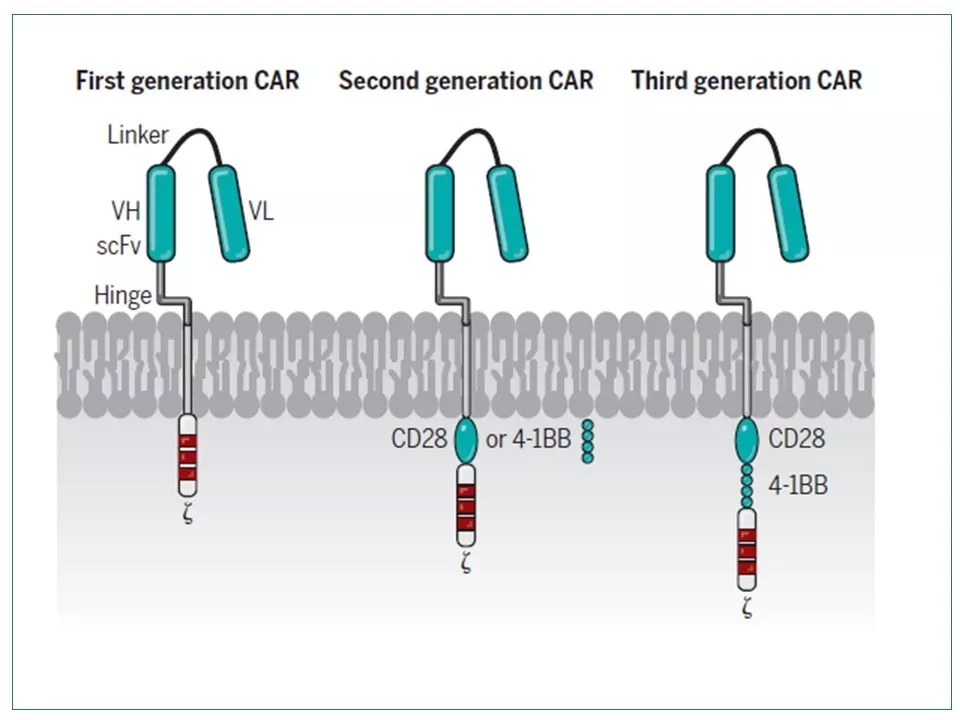
4 和其它高科技产品一样,CAR-T技术也在被不断改进,不断换代。CAR蛋白是近年来技术改进的主攻方向。第一代CAR没有共刺激域,所以在结合肿瘤细胞抗原后,CAR-T繁殖不够,不能持久,并且不能分泌足够多的细胞因子。因此第一代CAR-T对肿瘤细胞的杀伤力不够,最终未能进入市场。第二代CAR装备了CD28或4-1BB共刺激域——目前市场上的两个产品都是第二代CAR-T。第三代CAR既有CD28又有4-1BB,具有更强、更持久的杀伤力。
图片来源:参考资料3
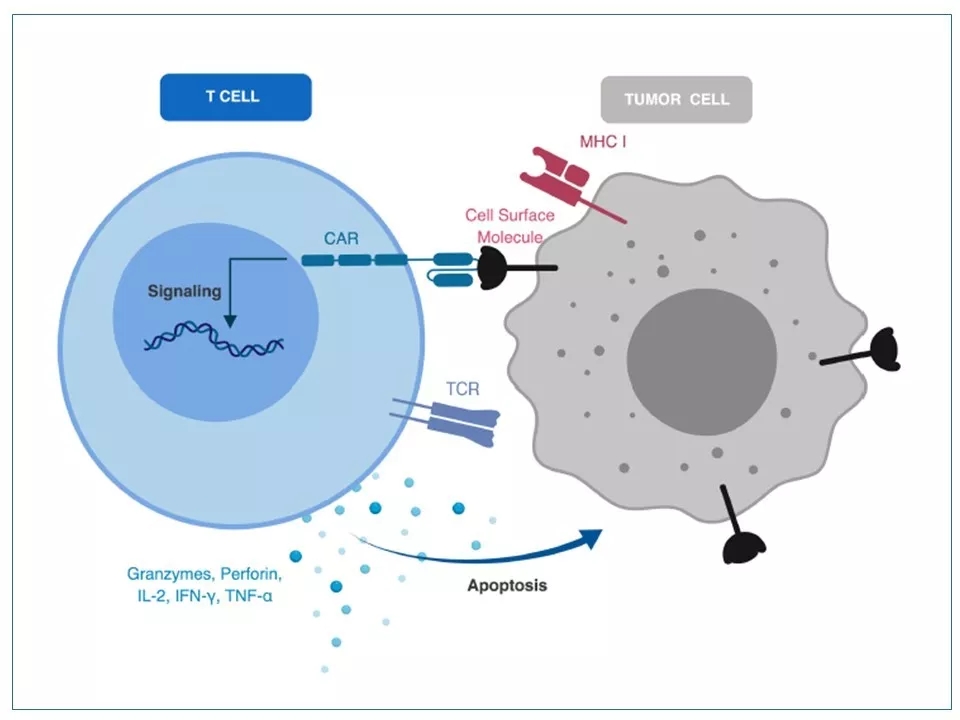
5 CAR-T对肿瘤细胞的杀伤力来源于CAR激活后启动的信号传导通路。在CAR-T表面的CAR与肿瘤细胞表面的特定抗原结合后,通过一系列信号传导,或分泌多种细胞因子,或释放颗粒酶、穿孔素等蛋白,从而引起肿瘤细胞的自杀。
图片来源:参考资料8
6 迄今为止,已有两个CAR-T产品进入市场: KymriahTM和Yescarta®。二者都是第二代CAR-T,一个重要的区别是它们的CAR蛋白的共刺激域不同。两个产品在临床上的不同表现也许是源于这一差异:Yescarta®在病人体内增殖快,但持久性差,有可能引起早期细胞因子风暴(CRS);而KymriahTM在病人体内增殖慢,但持久性好,有可能引起延迟的CRS。
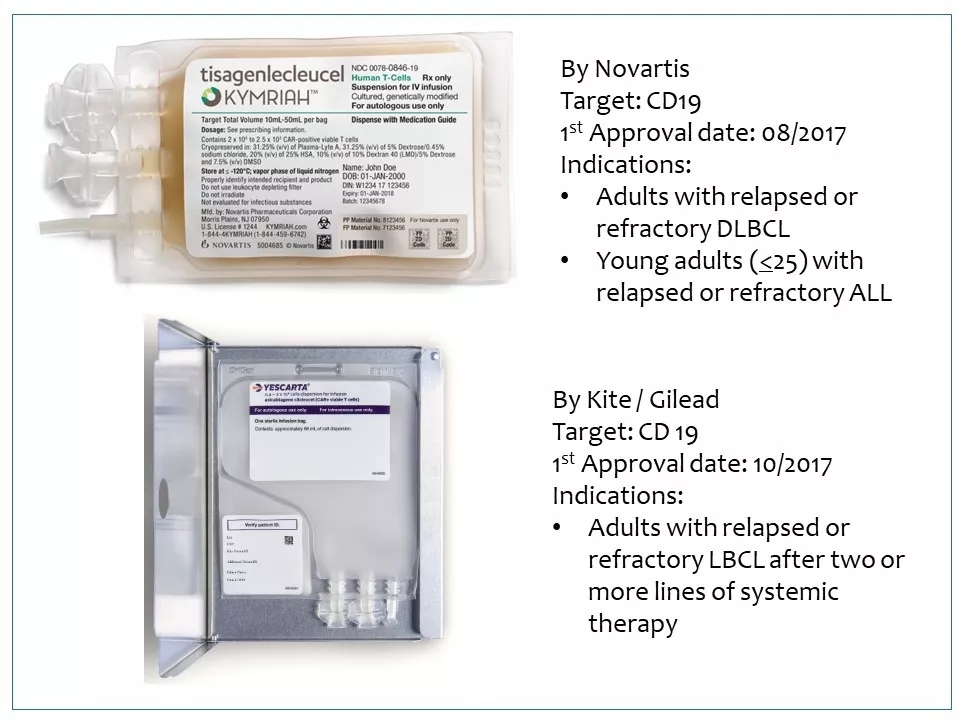
7 KymriahTM和Yescarta®都是针对CD19和B细胞淋巴瘤,先后于2017年首次获批上市。它们疗效显著,但也存在着很大的改进空间。
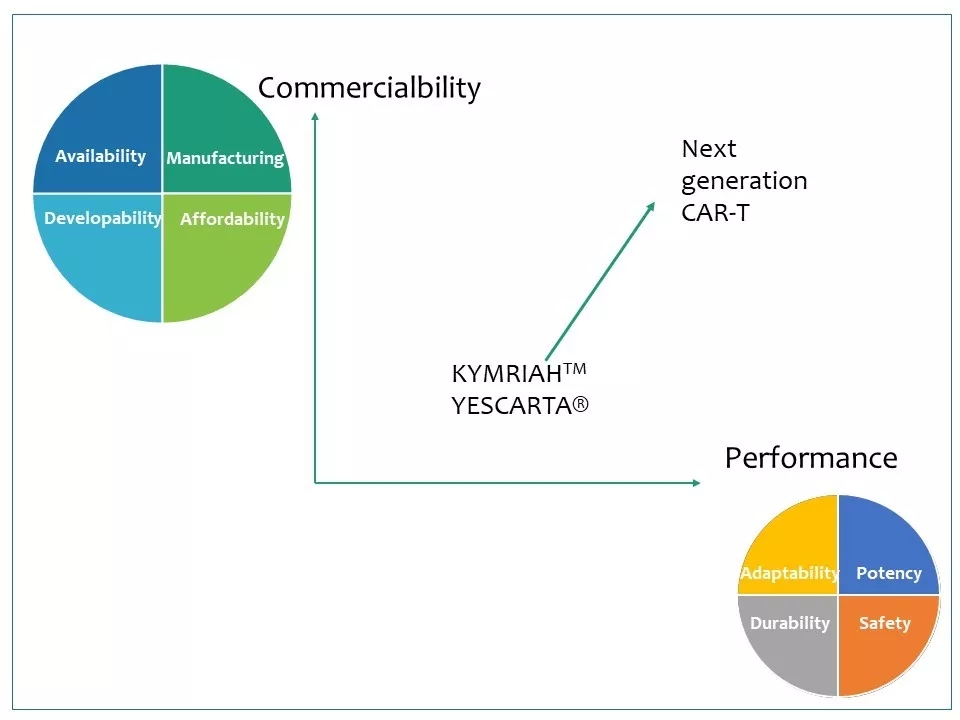
8 KymriahTM和Yescarta®两个细胞产品生产过程复杂,需要对每个患者单独制备,很难产业化,导致价格居高不下,因此限制了它们的销售。另外这一代CAR-T适用范围窄,很难应用到实体瘤上。而且其副作用大,在一些患者中引起CRS, 甚至导致死亡。众多生物技术和制药公司正研发新一代CAR-T技术,从商业性和产品性能两大方面进行改进,希望能克服这些局限性。
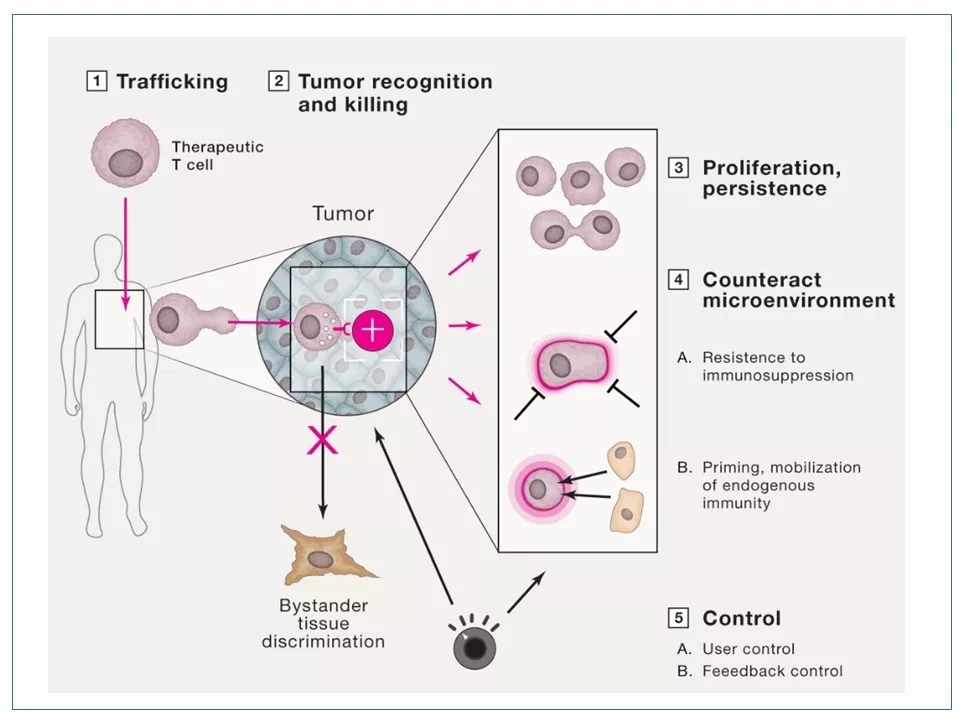
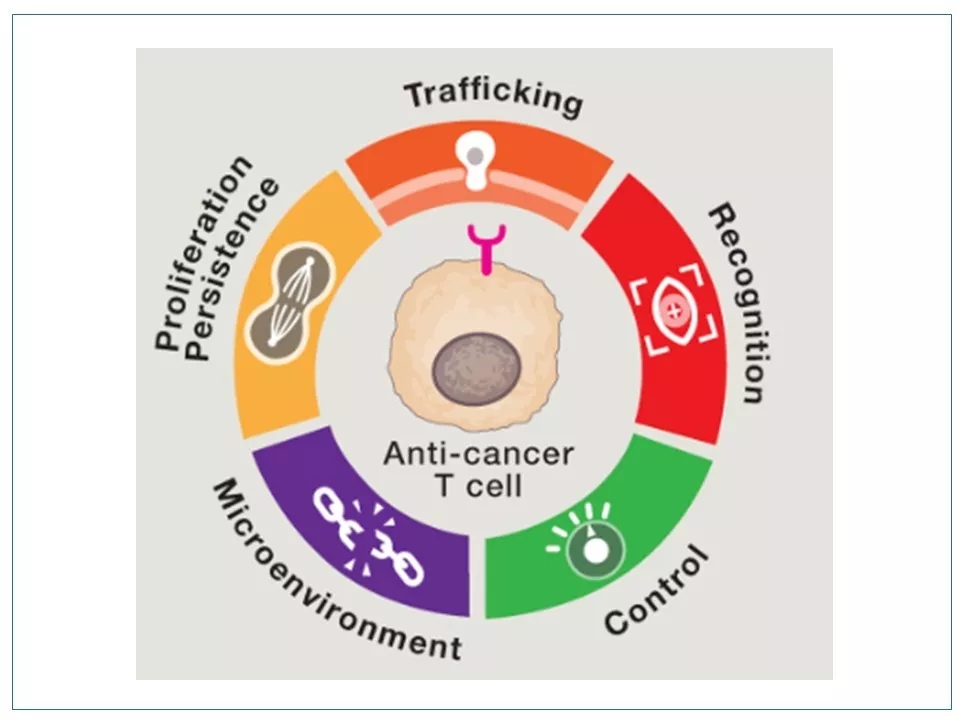
9 若想进一步改进产品性能,CAR-T技术必须解决五大挑战:(1)渗入:如何让T细胞有效地进入实体瘤的内部;(2)识别:如何让T细胞高精度地识别肿瘤细胞,而不滥伤无辜;(3)持久:如何保证T细胞扩增到足够多的数量、存活至足够长的时间,从而铲除所有的肿瘤细胞;(4)破境:如何使T细胞克服肿瘤周围的免疫抑制性的微环境(TME);(5)控制:如何能有效地控制、调节T细胞的启动、关闭、活性、持续时间和作用地点。
图片来源:参考资料5
10 改进CAR-T的产品性能也正是从这五个维度下手。对实体瘤来说,“渗入”和“破境”是前提。而对所有肿瘤而言,提高疗效的重点是改进“识别”和“持久”,提高安全性的重点则是完善“识别”和“控制”。
图片来源:参考资料5
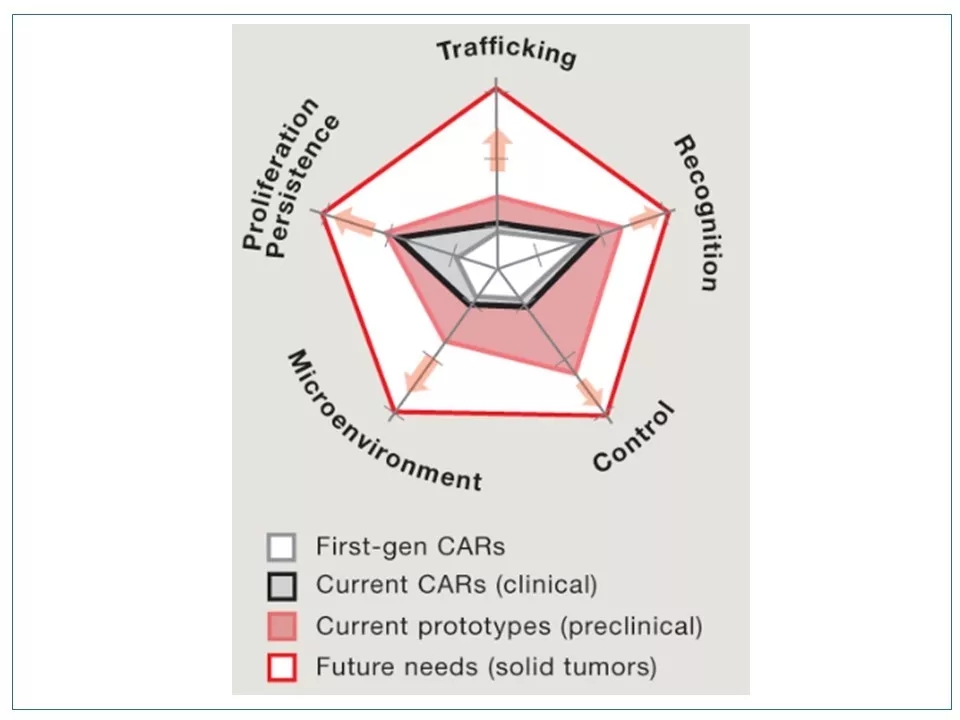
11 第二代CAR-T和第一代相比,主要在“持久”方面得到了很大的改进。现在各个公司在开发新一代CAR-T时,各显神通,专攻一个或多个维度。我们可以预见,未来的CAR-T产品,除了需要在这五个维度上做到完美,还要提高其商业性——降低成本、合理定价、开发通用型(off-the-shelf)CAR-T。通用型CAR-T细胞是指消除或降低了引起免疫排斥的风险的异体细胞,可批量生产,而不必针对每个患者单独制备。
图片来源:参考资料5
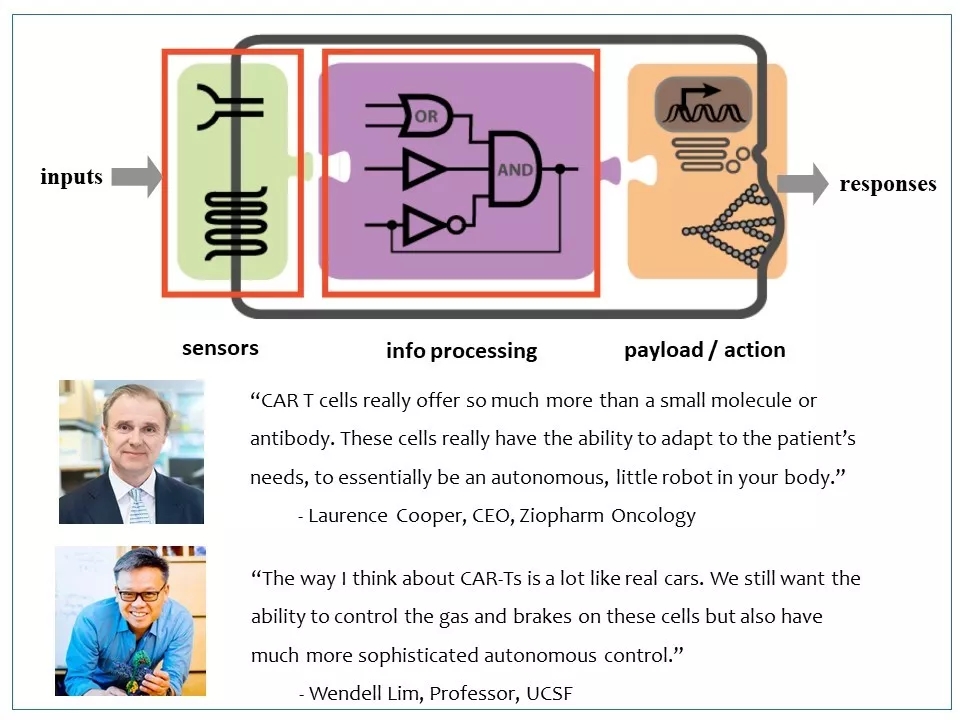
12 CAR-T不同于小分子药或蛋白药。它是“活”的药,而且可以添加很多功能。改进CAR-T的一个方向是借鉴系统生物学/合成生物学的理论,引入传感器、逻辑门、逻辑电路等概念,把它打造成一个机器人或智能系统。CAR-T is an engineered cell. Then why don’t we engineer the heck out of it?
图片来源:参考资料8
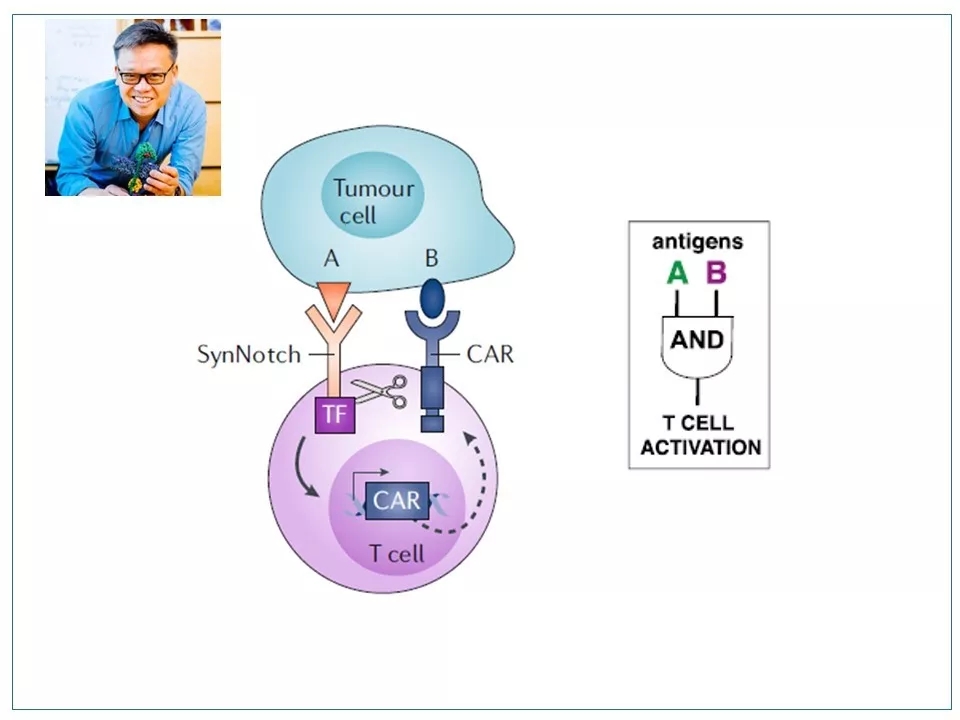
13 沿着这一思路,加州大学(旧金山)的Wendell Lim教授发明了SynNotch技术。SynNotch是一种合成的Notch受体,通过基因工程在T细胞表面永久性地表达。我们可以把它看作一种新型的CAR,其膜外结构也是抗体片段,识别并结合抗原A。A的结合引起SynNotch的膜内肽链被裂解,释放出连接的转录因子。转录因子进入细胞核,特异性地启动第二个CAR的转录。第二个CAR表达后,插入细胞膜,如果遇到第二个抗原B,会进一步激活下游信号,进入杀伤模式。SynNotch技术相当于给T细胞装了一个“与门”, 只有在接触到的细胞表达两种抗原A和B的情况下,才会被激活。
图片来源:参考资料6和7
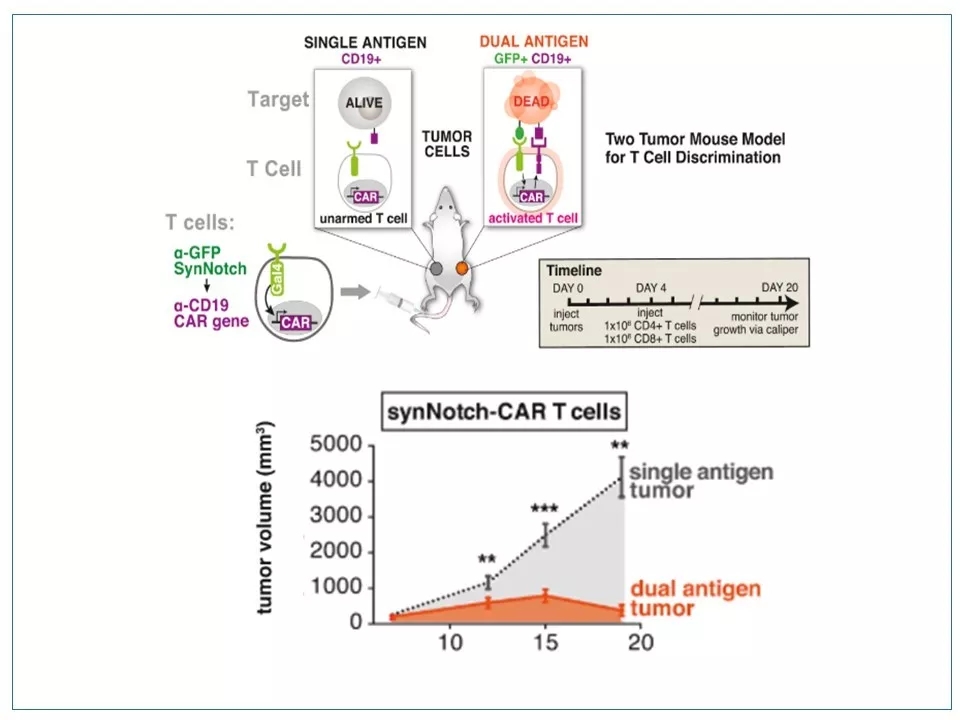
14 SynNotch技术在小鼠实验中已被验证。小鼠左侧接种单抗原肿瘤,右侧接种双抗原肿瘤。静脉注射的人源SynNotch CAR T 细胞(CD4+细胞和CD8+细胞1:1的混合)只对双抗原的肿瘤有疗效。
图片来源:参考资料6
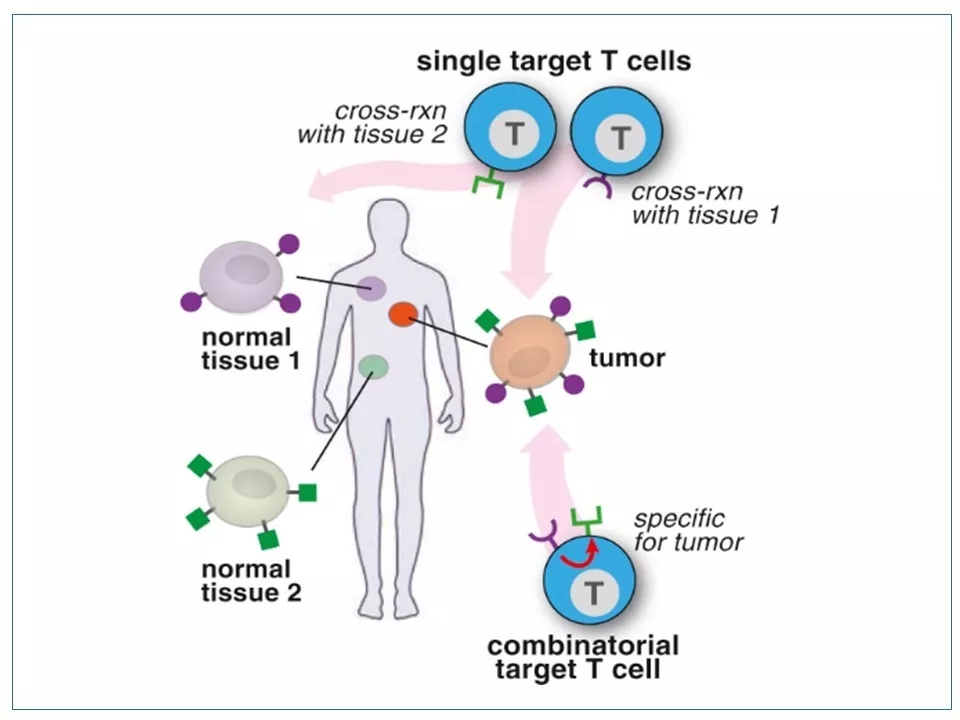
15 SynNotch CAR-T疗法的优势是能够更精准地歼灭(表达两种抗原的)肿瘤细胞,而不伤害患者体内健康的(只表达一种抗原的)细胞或组织。其缺点是从CAR1被激活到CAR2被激活有一个时间差,因此无法做到双靶点同步激活。
图片来源:参考资料6
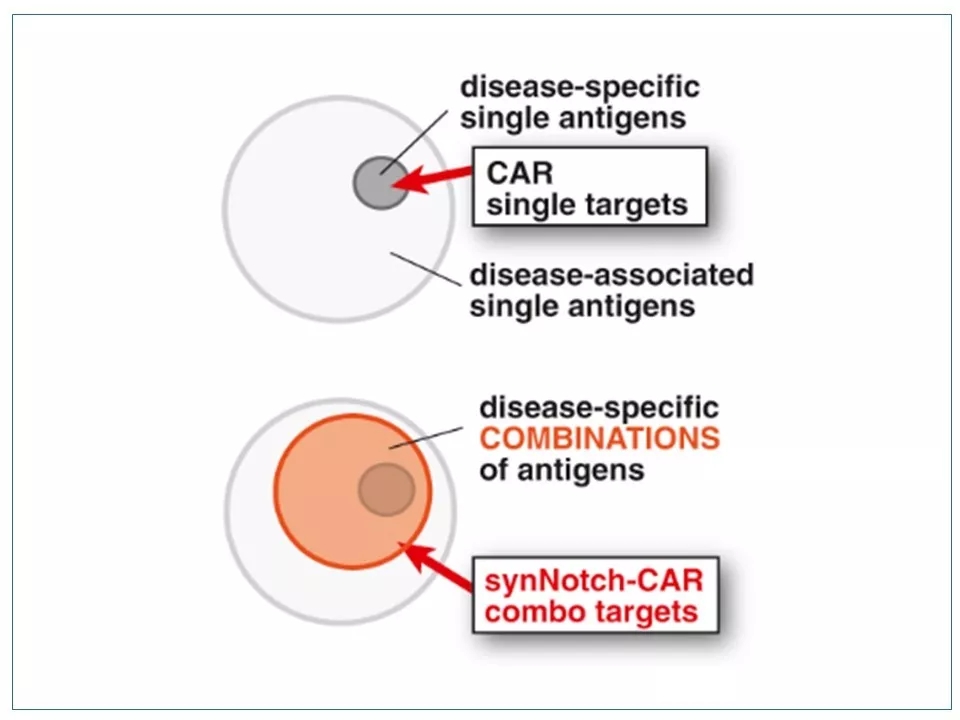
16 很少有实体瘤只依靠一个表面抗原就能被区分。因此,识别多靶点的SynNotch CAR-T技术除了可以减少副作用外,还可以扩展CAR-T的靶向空间。
图片来源:参考资料6
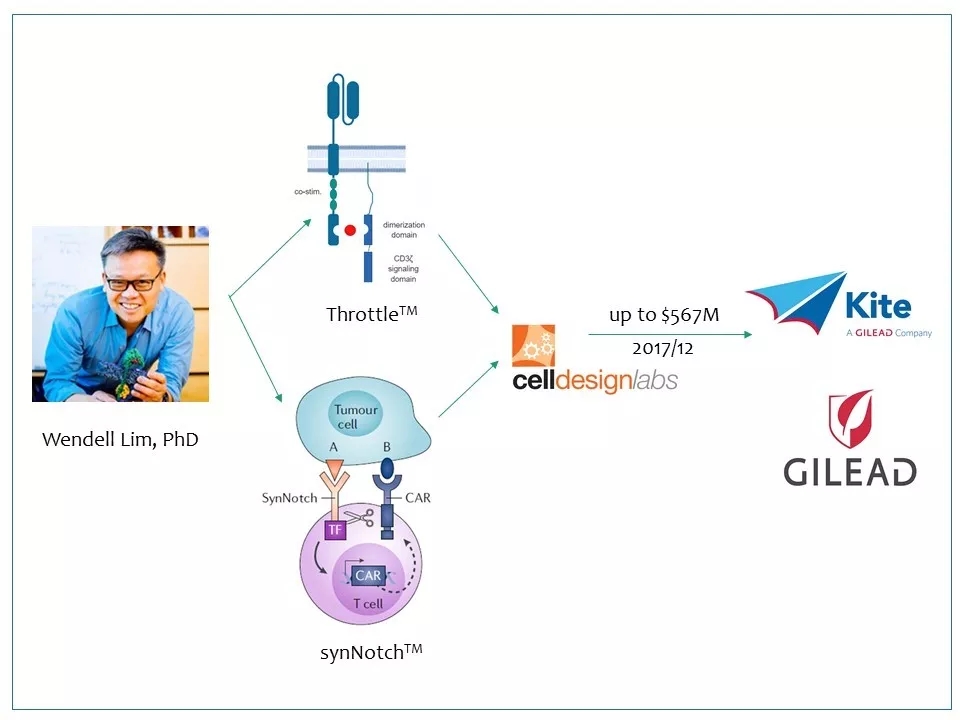
17 除了SynNotch CAR-T技术,Lim的团队还发明了ThrottleTM技术——用小分子药开关CAR-T。以这两个技术为基础,Lim于2015年创立了Cell Design Labs公司。Cell Design Labs与另一家CAR-T公司Kite有合作关系。2017年,在Gilead并购了Kite之后,Kite/Gilead几个月后又收购了Cell Design Labs。首付1.75亿美元,再加上各种里程碑,收购价最高可达5.67亿美元。
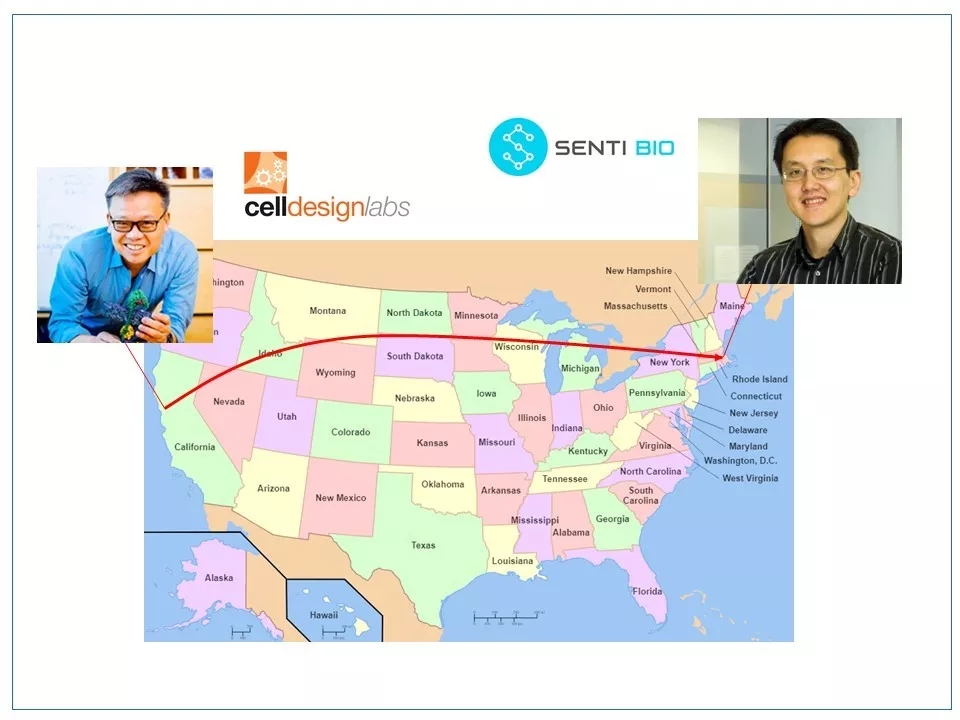
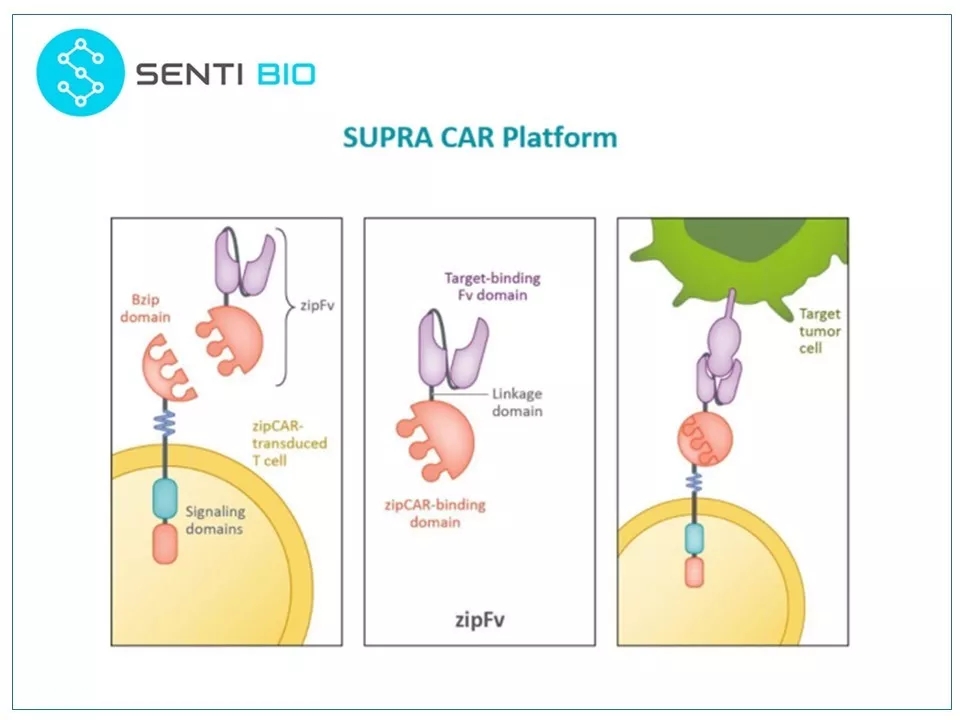
18 一个故事的结束往往意味着另一个故事的开始。 Wilson Wong博士曾在Wendell Lim的实验室做了将近5年的博士后。2012年初,Wong离开了北加州,来到波士顿大学任职。他也按着合成生物学的思路创造了一个新的CAR-T技术——SUPRA CAR,并于2018年2月联合创立一家生物技术公司Senti Biosciences来开发这一技术。
19 Senti Bio的其他几名联合创始人也是赫赫有名,包括MIT的Tim Lu和Jim Collins。公司的技术平台除了SUPRA CAR外,还包括小分子CAR-T开关和加强型免疫细胞(Advanced Arming)。
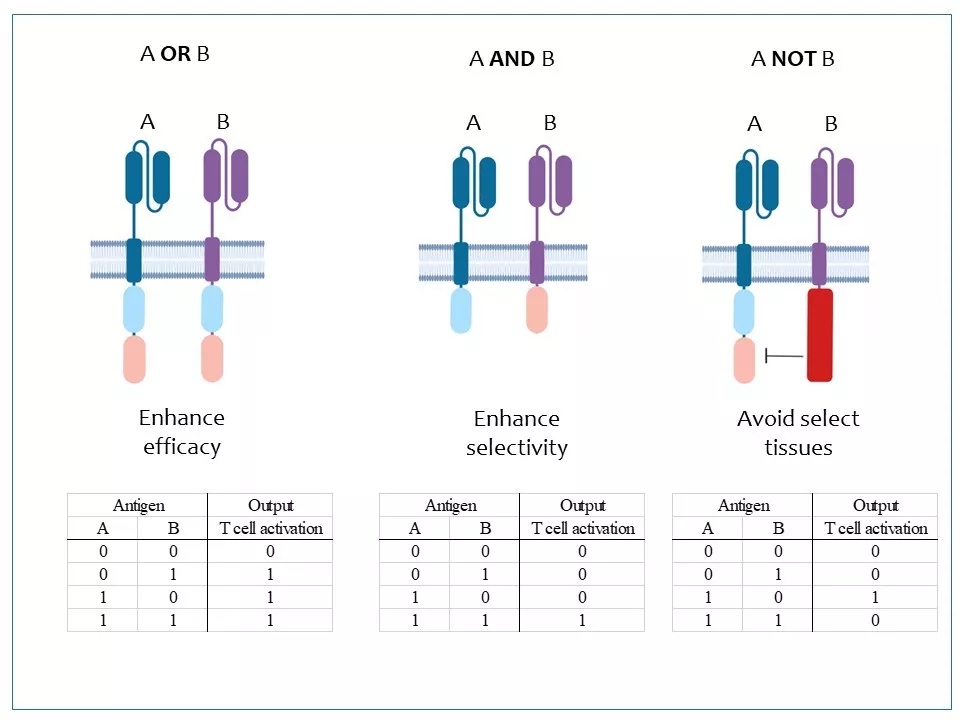
20 Senti Bio在CAR-T中引进了更多的逻辑门。除了多靶点识别的“与门”(A AND B)外,还有“或门”(A OR B)和SAND (“A NOT B”)。每种逻辑门的功效不同,可以根据实际需要灵活选择。
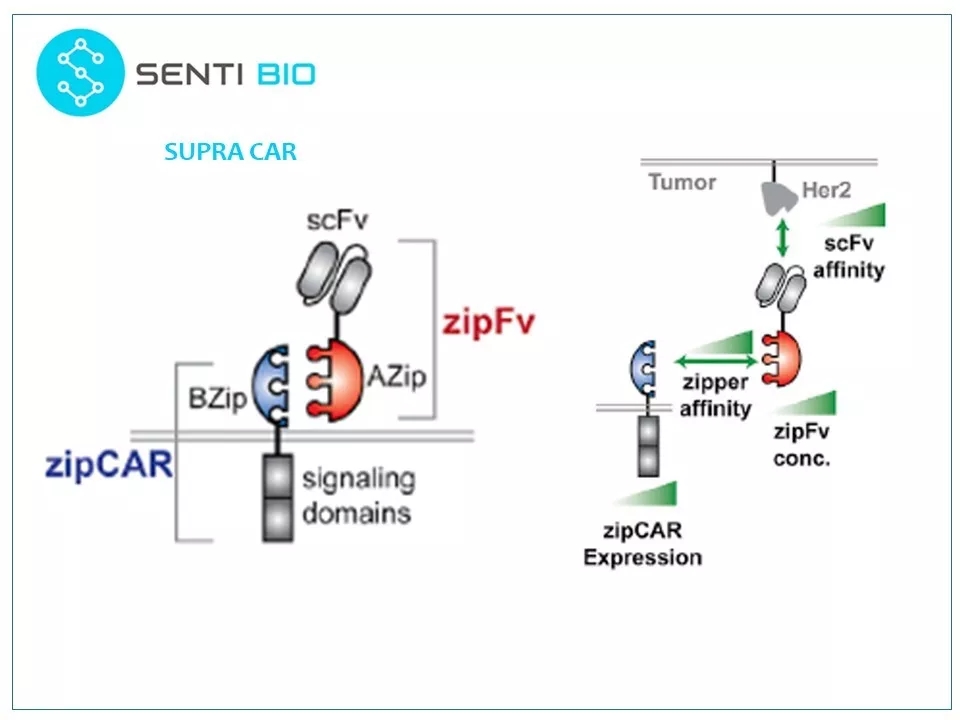
21 SUPRA CAR技术可以帮助实现这些逻辑门。SUPRA CAR系统中,CAR蛋白被分拆,成为两个蛋白:zipCAR和zipFv。zipCAR是跨膜蛋白,其细胞外结构是一个亮氨酸拉链,而zipFv是一个融合scFv,装有同源亮氨酸拉链,可以与zipCAR上的亮氨酸拉链互补结合。这个系统将CAR-T模块化,带来了更大的灵活性。其治疗模式是细胞治疗加蛋白治疗。对不同的肿瘤,只需一种zip-CAR-T细胞,但需要更换不同的传感器——zipFv。SUPRA CAR系统可以通过改变以下几个变量来调整其特性:(1)亮氨酸拉链对之间的亲和力,(2)肿瘤抗原和scFv之间的亲和力,(3)zipFv的浓度,和(4)zipCAR的表达水平。
图片来源:参考资料1
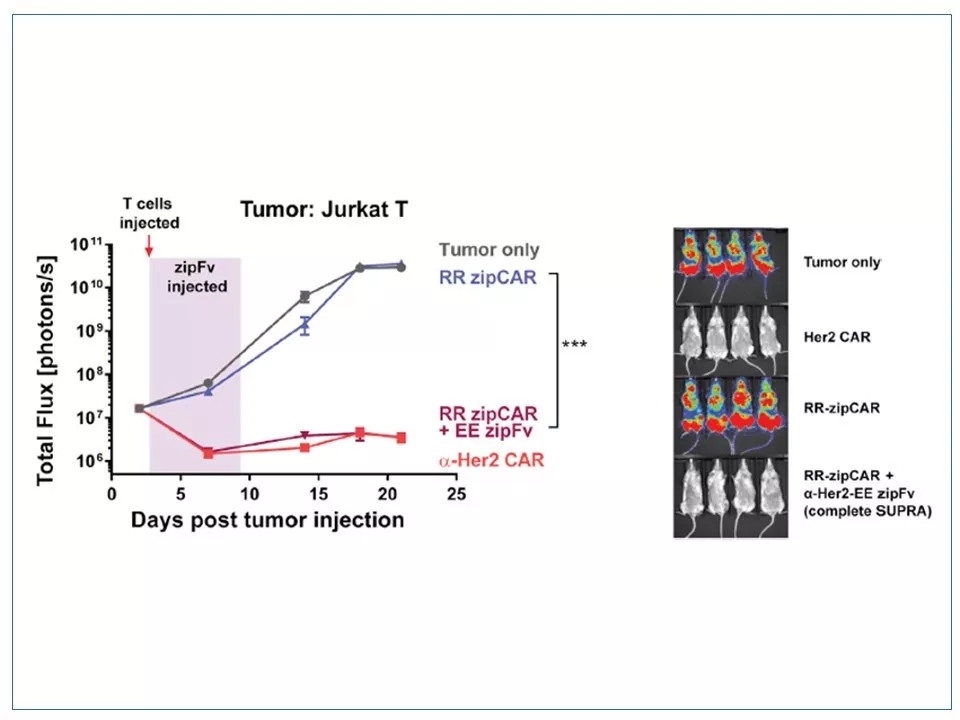
22 SUPRA CAR技术在小鼠肿瘤模型中已经得到验证。单独输入RR zipCAR T细胞并不能减少肿瘤负荷。只有同时引进EE zipFv蛋白后,RR zipCAR T + EE zipFv(RRzip与EEzip互补)才能有效抑制肿瘤,其活性接近于一个传统的CAR-T(a-Her2 CAR)。
图片来源:参考资料1
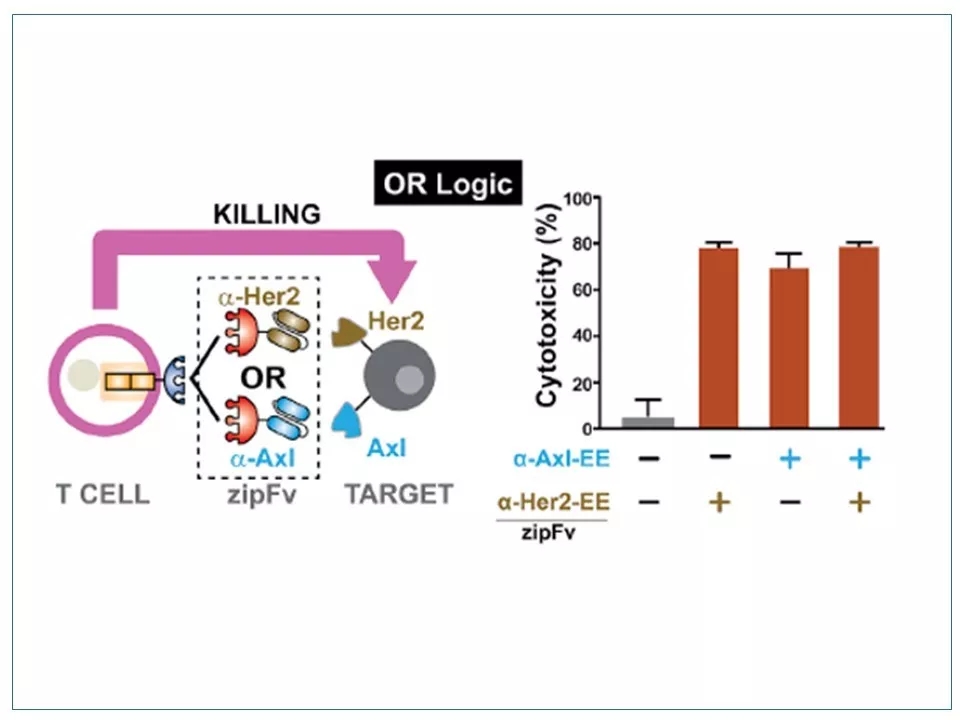
23 SUPRA CAR系统实现的“或门”展示。将表达双抗原的K562肿瘤细胞与表达RR-zipCAR的CD8 + T细胞共同培养,加入两种识别单抗原的zipFv中的任何一种都能够对肿瘤细胞起到杀伤作用。
图片来源:参考资料1
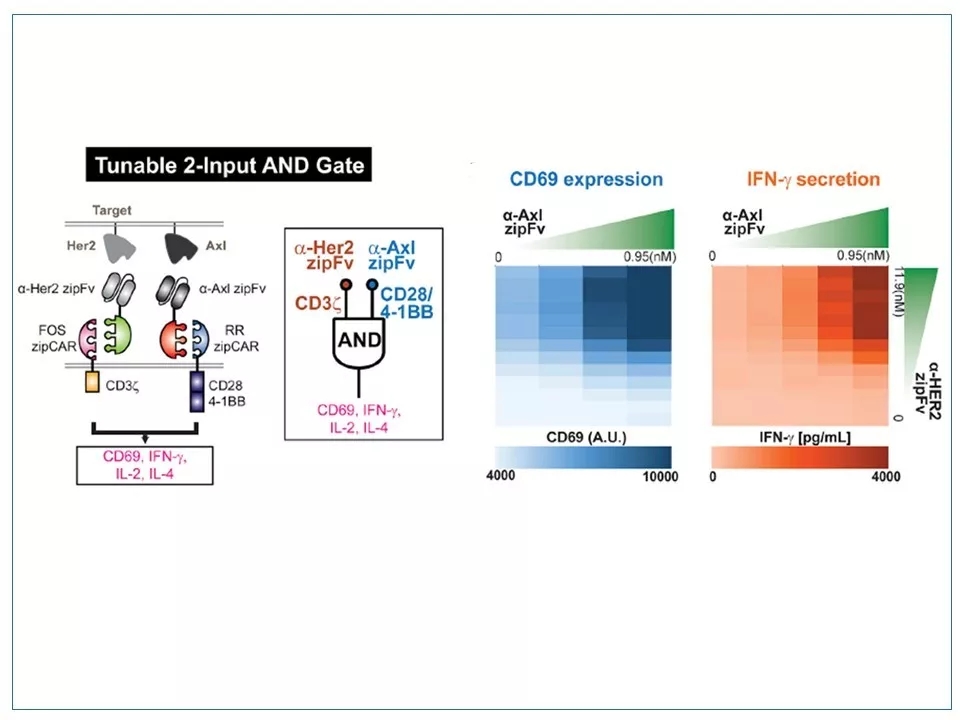
24 SUPRA CAR系统实现的可调性“与门”展示。RR zipCAR和FOS zipCAR分别装备了CD28 / 4-1BB共刺激域和CD3z信号域,信号传导相对独立。a-Her2 zipFv与FOS zipCAR结合,进一步被抗原Her2激活后,指令下传给CD3z结构域,继而增加CD69的表达;而a-Axl zipFv与RR zipCAR结合,进一步被抗原Axl激活后,指令下传给CD28 / 4-1BB共刺激结构域,继而增加了IFN-g等细胞因子的释放。改变每个zipFv的浓度可以调节来自每个受体的信号输出强度,而且这两个通路有很强的协同作用。
图片来源:参考资料1
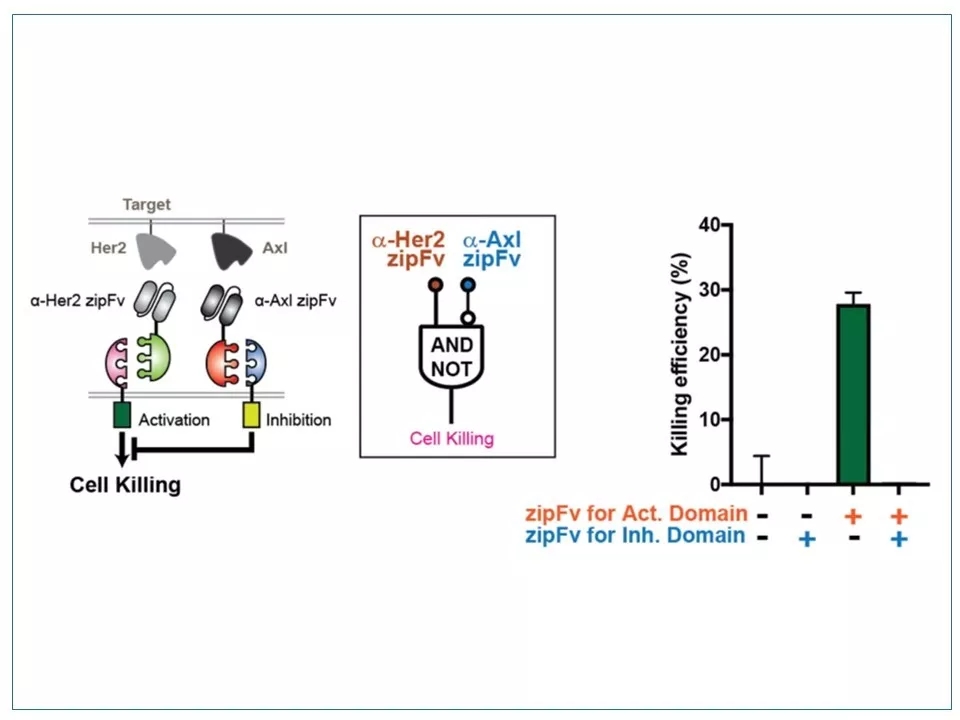
25 SUPRA CAR系统实现的“A AND NOT B”逻辑门展示。一种免疫细胞转基因后,其表面会表达两种zipCAR,其中一种的膜内域被激活后会抑制另一种的信号通路。在这个例子中,a-Her2 zipFv通路激活了免疫细胞,但加入a-Axl zipFv会抑制免疫细胞的激活,从而减弱了对肿瘤细胞的杀伤作用。
图片来源:参考资料9
26 SUPRA CAR的优势是其灵活性、可调性、多功能性、可编程性和应用广泛性。它主要存在两个缺点:(1)这种治疗方法是细胞疗法和蛋白药疗法的组合,给生产、申报、给药增加了复杂性。(2)由于zipFv是一种游离的scFv,体内半衰期短。若想维持CAR-T的疗效,需要不断补充scFv。Senti Bio将如何扬长避短,挖掘出这一技术的最大潜力?我们将继续关注。
图片来源:参考资料9
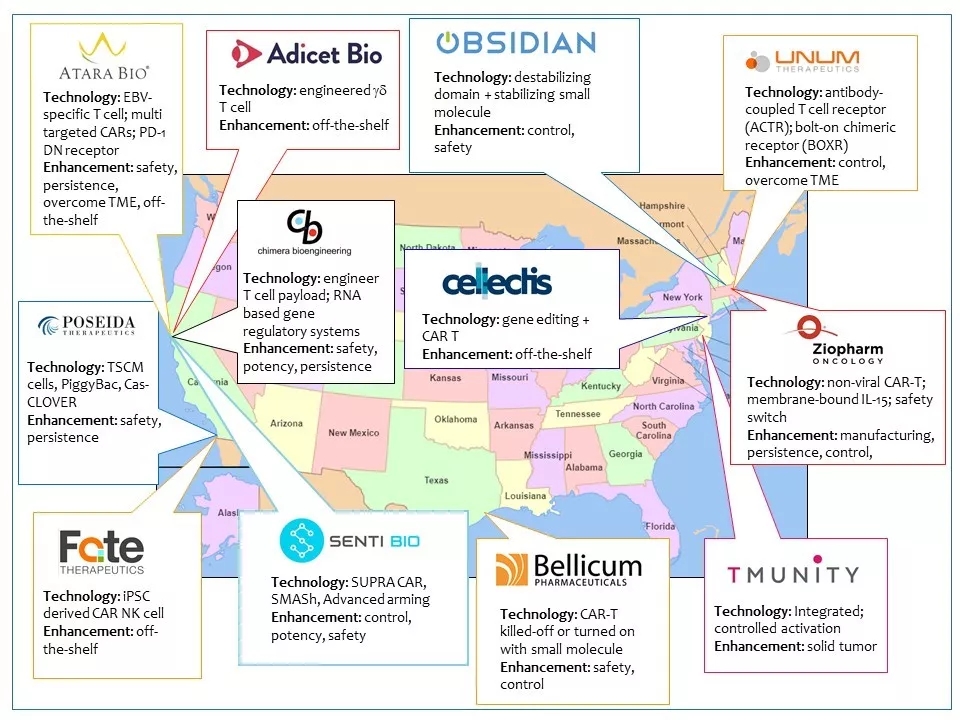
27 Senti Bio只是研发新一代CAR-T技术的公司之一。目前仅在美国就有几十个相似的或相竞争的生物技术公司。每个公司的技术各有千秋,但最终目标都是改进CAR-T的产品性能或商业性能。
28 医药界渴望的是开发出针对实体瘤的通用型CAR-T。只有实现了这一目标,CAR-T才能“跨越鸿沟",从小众产品转变为大众产品,以更好地造福人类。(完)
参考资料:
1. Cho, J. H., et al. (2018). "Universal Chimeric Antigen Receptors for Multiplexed and Logical Control of T Cell Responses." Cell 173(6): 1426-1438 e1411.
2. Cross, R. (2018). Controlling CAR-T: How scientists plan to make the engineered T cell therapy safer, and work for more cancers. Chemical & Engineering News. 96.
3. June, C. H., et al. (2018). "CAR T cell immunotherapy for human cancer." Science 359(6382): 1361-1365.
4. Kitada, T., et al. (2018). "Programming gene and engineered-cell therapies with synthetic biology." Science 359(6376).
5. Lim, W. A. and C. H. June (2017). "The Principles of Engineering Immune Cells to Treat Cancer." Cell 168(4): 724-740.
6. Roybal, K. T., et al. (2016). "Precision Tumor Recognition by T Cells With Combinatorial Antigen-Sensing Circuits." Cell 164(4): 770-779.
7. Wu, M. R., et al. (2019). "Engineering advanced cancer therapies with synthetic biology." Nat Rev Cancer 19(4): 187-195.
8. “Deciphering CAR T cells: Exploring functional mechanisms to drive next generation immunotherapy “ Riddell, S. and Lim, W. Science Webinar 04/11/2019
9. Dr. Gary Lee's talk at “Science Alliance: Advancements in Immuno-Oncology” JLABS Symposium 04/04/2019