三家国内细胞治疗企业相继IPO,CAR-T在中国离全面商业化还有多远?
2020年迄今为止,已经有复星凯特和药明巨诺两家企业的产品申请NDA并获受理;传奇生物、永泰生物和药明巨诺三家企业先后申请上市,其中永泰生物和传奇生物已经分别成功登陆港股和纳斯达克;另外美国FDA也再一次通过快速通道批准了第三款CAR-T细胞治疗产品上市。
自2017年诺华的Kymriah和KITE的Yescarta两款CAR-T产品接连上市之后,虽然国内细胞治疗行业在一级市场上的热度持续攀升,但是在产品审批方面,却少有斩获。蛰伏三年的产业,在2020年,终于到了爆发的时机。
如今我们以药明巨诺申请港交所上市为引,再次审视三家申报上市的中国细胞治疗企业,看看产业的风向朝哪?看看商业化之路上,还有哪些阻碍?
JUNO与KITE,在中国开辟第二战场
2016年4月药明康德与JunoTherapeutics宣布合作建立药明巨诺,以结合Juno在嵌合抗原受体技术(CAR-T)和T细胞受体(TCR)技术,和药明康德的研发生产平台及丰富的中国本地市场经验,联合打造中国领先的细胞疗法公司。
说到药明巨诺,就不得不提到另一家非常类似的企业,复星凯特。2017年1月,紧随JUNO和药明康德的合作,KITE也与复星医药达成了合作,同样成立了合资公司复兴凯特,将KITE的Yescarta(当时尚未获批,代号为KTE-C19)引入中国市场。
JUNO与KITE之间的竞争,贯穿了CAR-T产品的整个发展历程。两家公司从成立,到融资历程、产品研发,再到最终分别被新基制药和吉利德收购,发展轨迹非常类似。
2016年,JUNO也曾经是首款CAR-T产品的有力竞争者之一。然而2016年7月,JUNO的头部产品之一,JCAR015的Ⅱ期临床试验造成了两名白血病患者因为神经毒性作用死亡,随即被FDA叫停。
虽然JCAR015后来没再有更多的消息,但是JUNO仍有其他产品管线,不弱于同类竞品。在2017年底的ASH年会上公布的JCAR017Ⅱ期临床试验数据中,接受剂量水平2治疗的15位患者,ORR(总体反应率)为80%(12/15),CR(完全缓解)率为73%(11/15)。
2018-2019年,JUNO也还在持续更新JCAR017的相关数据,然而至今也没有申报上市。而另外一边,老对手KITE的第一款产品Yescarta已经先后进入了欧洲、日本等其他地区的市场,第二款产品也已经获美国FDA批准上市。
早期产品的不良反应,可能还是或多或少的影响到了JUNO的审批之路。欧美市场上,JUNO显然已经落入了下风。
欧美市场虽大,但是中国市场也不容小视。在中国市场的发展轨迹上,JUNO和KITE再次发生重叠。
复星凯特和药明巨诺这两家合资企业则始终以雄厚的实力保持在国内细胞治疗行业的第一梯队,研发进度也咬的很紧。2018年6月,药明巨诺的瑞基仑赛注射液(Relma-cel,JWCAR029)IND申请获批;同年9月,复兴凯特的益基利仑赛注射液(FKC876)也获批IND。
到2020年,复兴凯特益基利仑赛注射液的NDA申请率先在2月获CDE受理,并随后进入优先审评通道;而药明巨诺也毫不示弱,瑞基仑赛注射液的NDA申请也在6月获CDE受理。
谁将成为中国首款获批的CAR-T产品,至今仍没有定数。但我们可以看到,在欧美市场落入下风的JUNO,依靠药明巨诺的不断推进,再次开启了和KITE的竞争。
JUNO的首款产品或将通过药明巨诺在中国率先上市
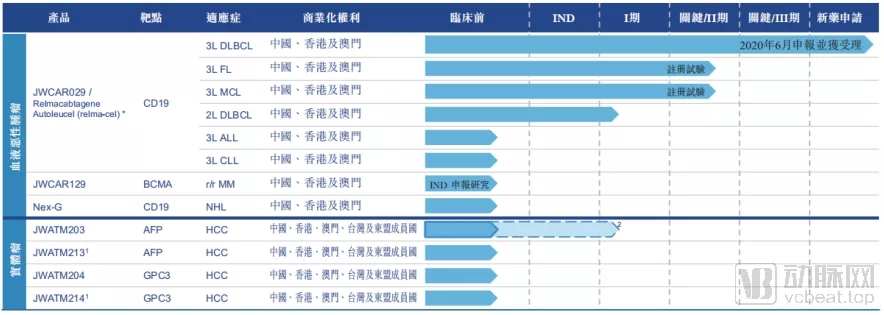
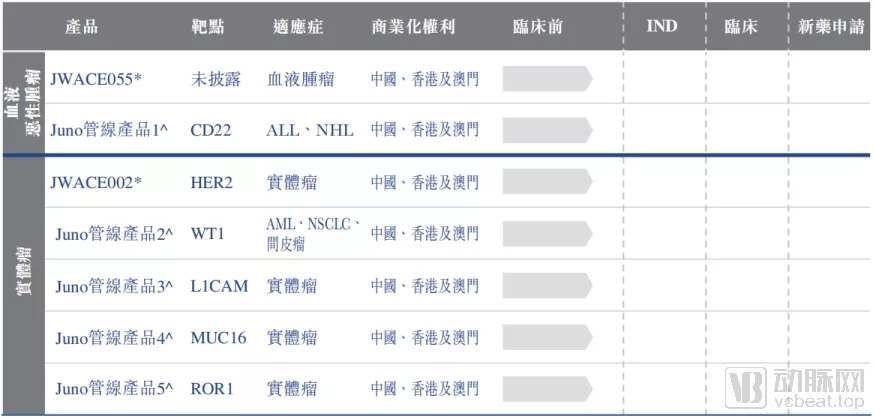
药明巨诺的在研管线
说回药明巨诺,公司目前的管线全部都来自于Licence in,其中既包括了从JUNO引进的CD19和BCMA靶点的产品,也包括了从优瑞科引入的几款AFP和GPC3靶点的相关产品。
其中针对血液瘤适应症的产品,主要来自于JUNO,核心产品为Relma-cel(JWCAR029),也就是JUNO的JCAR017。这款产品JUNO已经在国外完成了比较完整的开发过程,但却始终未在国外获批上市。药明巨诺对其进行了相应的本地化改造,并推动了其多项国内临床试验的进展。如今这款产品已经在国内申报NDA并获受理,或许药明巨诺的首款产品可以借药明巨诺之手,在国内率先上市。
Relma-cel目前申报上市的适应症为DLBCL(弥漫性大B细胞淋巴瘤)的三线治疗。在已经完成的Ⅰ、Ⅱ期临床试验中,Relma-cel顺利达到了预定的主要终点,三个月ORR为58.6%。最佳整体疗效方面,ORR和CR更是分别达到75.9%和48.3%。
另外针对滤泡性淋巴瘤和套细胞淋巴瘤的相关临床试验也已经进入了关键临床试验阶段,虽然药明巨诺未在招股书中披露这两项适应症的早期临床试验结果,但是从JUNO此前披露的结果上看,其临床价值同样不亚于已经上市的几款产品。
药明巨诺的实体瘤管线,则是引进自一家创新企业优瑞科。
优瑞科这家华人创办的细胞治疗技术企业,与JUNO之间也缘分不浅。2016年1月和6月,优瑞科先后向JUNO授权了自己两款产品的开发和商业化权益,分别针对BCMA和MUC16靶点。药明巨诺从JUNO引进的三款主要产品的其中一款,正是BCMA靶点,很可能最初也来自于优瑞科。
药明巨诺未来可能进一步引进的管线
药明巨诺拥有在中国研发及商业化JUNO构建的T细胞产品的优先购买权。因此未来,随着产品管线的推进,药明巨诺或将继续从JUNO引进多条药物管线。目前来看,CD22、HER2、MUC16等热门靶点的相关产品,都在药明巨诺的考虑范围内。
药明巨诺目前的招股书披露的主要融资用途,主要聚焦于产品的注册申报和临床开发,另有一部分资金用于未来的进一步Licence in。因此估计未来几年预计药明巨诺会继续按照当前的发展步调匀速前进。
初创企业想“快步走”,合作是关键
从2020年三家申报上市企业的发展中,我们可以看到一些细胞治疗行业的发展趋势。
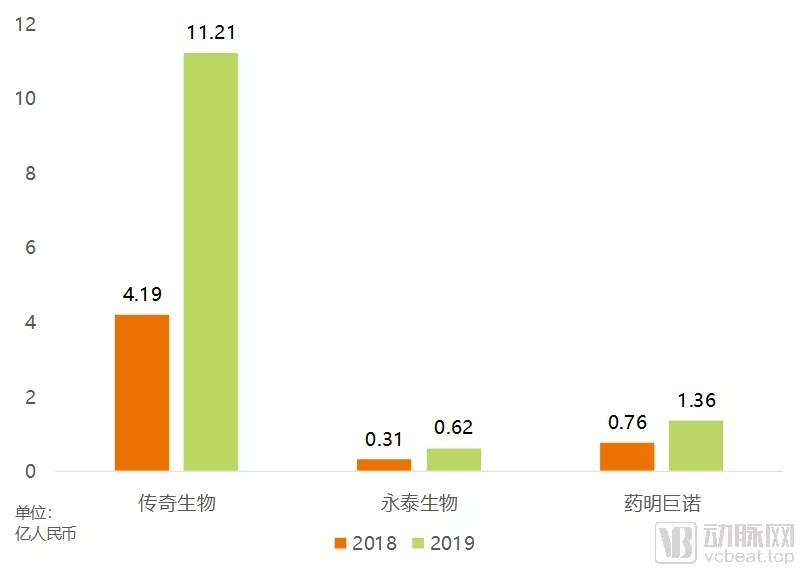
三家申请上市的国内细胞治疗企业的研发开支
研发开支方面,在已经上市的三家企业中,传奇生物2019年超过10亿元的研发开支一骑绝尘。相比之下,永泰生物和药明巨诺的研发开支就要小得多。
永泰生物的情况比较特殊,CAR-T管线都还处在临床前阶段。临床试验方面只有核心产品EAL正在推进。该产品主要是将患者的CD8+T细胞分离培养回输,本身成本不高,相应的临床试验成本也容易控制,因此不具有广泛的参考性。
传奇生物巨额的研发开支除了产品本身的研发费用之外,更多的来自于大量临床试验的开展。核心产品LCAR-B38M有一项Ⅲ期临床试验,三项Ⅱ期临床试验和一项Ⅰ期临床实验在研,其他管线也纷纷进入Ⅰ期临床。超过10项临床试验同时开展,势必会造成巨额的研发开支。
传奇生物敢于巨额投入研发,其底气在于背后的金斯瑞和杨森制药。金斯瑞作为传奇生物的控股公司,在过去的几年中,持续为传奇生物提供资金帮助。而杨森制药则已经与传奇生物达成了协议,共同开发、生产和销售LCAR-B38M,这项合作仅首笔预付款就高达3.5亿美元,已经足以覆盖传奇生物2018-2019年的研发开支。
再看药明巨诺,第一临床试验数量少,只有核心产品JWCAR029的几项临床试验在研;第二产品成熟度高,核心产品已经经过JUNO的长期研发;第三有药明康德在背后支持,顶尖CRO的支持自然有利于药明巨诺进一步控制成本。多方因素影响下,药明巨诺的研发开支始终被控制在低位。
这两家公司的情况,提示了细胞治疗企业的商业模式。创新药研发需要大量的资金投入。这样巨额的资金投入,仅靠VC/PE的支持还不够,初创企业还需要更多的寻求产业界的支持。
无论是与药企巨头合作开发提早实现商业转化,还是与CRO/CDMO合作进一步控制成本,对于创新企业来说,都是控制风险的上佳选择。优瑞科其实也是个很好的例子,几款产品管线先后Licence out给JUNO和药明巨诺,首付款和未来的里程碑付款都将为优瑞科进一步发展的动力来源。
CD19、BCMA之后,下一个热门靶点会是谁?
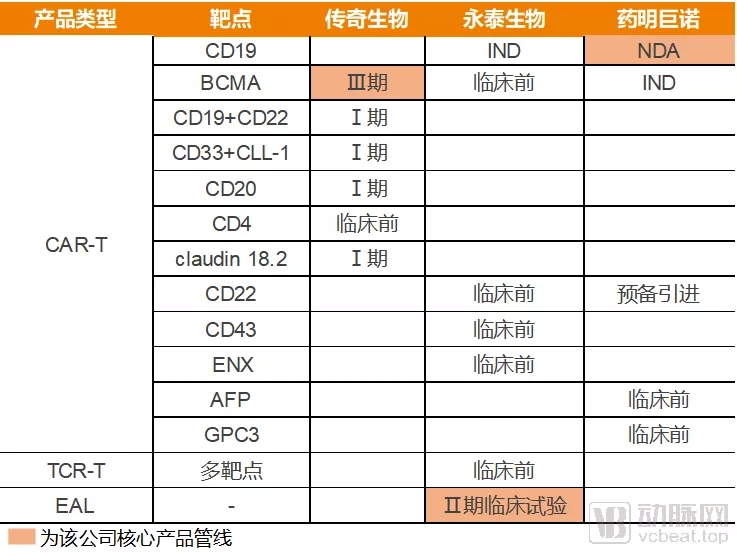
三家申报上市企业的管线情况
目前已经上市的三家企业,管线分布明显比较分散,靶点重叠的产品,只有CD19、BCMA和CD22三个。
这也是目前CAR-T细胞治疗正面临的局面。诺华、KITE和JUNO三家公司围绕着CD19靶点展开的第一轮竞争,至今为止诞生了三款产品上市,也吸引了大量的企业开始涉足CAR-T细胞治疗产品研发。但是在靶点选择方面,可以作为依据的临床数据却很少,除了已经经过临床验证的CD19之外,其余靶点大多是摸着石头过河。
在“过河”的过程中,BCMA靶点在多方验证下开始崭露头角,JUNO、Bluebird、传奇生物都先后公布了自己相应产品的临床实验结果。尤其是传奇生物的LCAR-B38M,在中国和美国开展的多发性骨髓瘤临床实验中,CR(完全缓解)都达到了70%以上,展现出优异的商业潜力。因此我们也可以看到,已经提交IPO申请的三家企业都已经在BCMA靶点产品上进行了深度布局。
但是BCMA之后,哪个靶点将会成为下一个大热门,却又没了定论。有人觉得血液瘤治疗上还有很多发展空间,有人觉得应该寻找新的实体瘤靶点,也有人认为应当控制产品成本做off-the-shelf的UCAR-T产品。
在这样的环境下,即使是KITE这样的巨头,似乎也有些迷茫。KITE刚刚获批上市的新产品虽然在套细胞淋巴瘤和急性髓性白血病上都取得了不错的临床实验结果,但靶点却仍是旧靶点,始终发展空间有限。
对于初创企业来说,这样的行业环境正代表着机会。各家企业都在迷茫之时,正是初创企业在行业中占据一席之地的机会。传奇生物正是在最初就锁定了BCMA靶点进行重点开发,才能有如今全球领先的地位。
商保,未来支付问题的解药
虽然CAR-T细胞治疗产品已经在国内进入上市阶段,但是对于国内患者而言,想要尽快用上这款产品,还有支付这个大问题。
Kymriah和Yescarta在美国47.5万美元和37.3万美元的高额定价,对于患者而言是笔不小的负担。但是美国的商业保险体系有足够的经济实力为患者提供就医保障。另外还有CMS(医疗保险和医疗补助服务中心)也已经全面覆盖CAR-T细胞治疗。
但是对于国内来说,支付环节就显得吃力得多。国内上市的产品,虽然较国外价格偏低,但是对于国内的人均收入水平而言,仍然是一笔巨款。
我们可以类比其他创新药产品来大概估计将在国内上市的CAR-T细胞治疗产品的价格。PD-1单抗Keytruda在中国的单支售价是美国价格的一半,再加上买三增三的赠药政策,Keytruda在国内的实际支付价格大概是美国的1/4。
以这样的比例来计算,未来在国内上市的CAR-T细胞治疗产品价格,也要超过50万元。
那么这笔巨款由谁来付?如果要患者自费,这样的价格对于患者的家庭来说无疑是雪上加霜。如果纳入医保支付,又要为国家医保增加不小的负担。
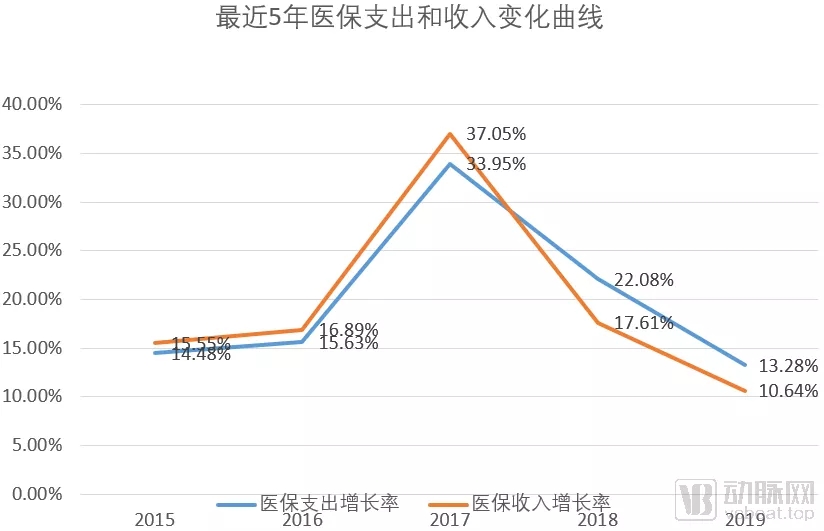
近几年医保收支变化情况
近几年医保通过医保谈判纳入了大量创新药产品,虽然另一方面也通过带量采购、两票制等压缩开支,但是2018-2019年,医保支出增速仍然高于收入增速。在这样的情况下,医保未来纳入新药品势必更加谨慎。
产品的支付问题,是中国医药行业与国际接轨过程中必须要解决的问题。CAR-T面对的问题,是国内医药行业现状的缩影。
近两年在政策的推动下,全球新药加速进入国内,国产创新药也越批越多。但是创新药高昂的价格却让医保左右为难。今年70万一针的SMA(脊髓性肌萎缩症)新药诺西那生钠注射液突然登上热搜,根据医保局的相关回应,医保局在该药品上市后就已经和渤健进行过谈判,但是却未能达成合意。
在这样患者刚需的新药产品上,医保的议价能力非常有限,而且医保也要全面考虑自己的支付能力。
总体来说,期望医保解决高价创新产品支付的问题,暂时还比较困难。
而医保近两年也开始鼓励商业医疗险快速发展。
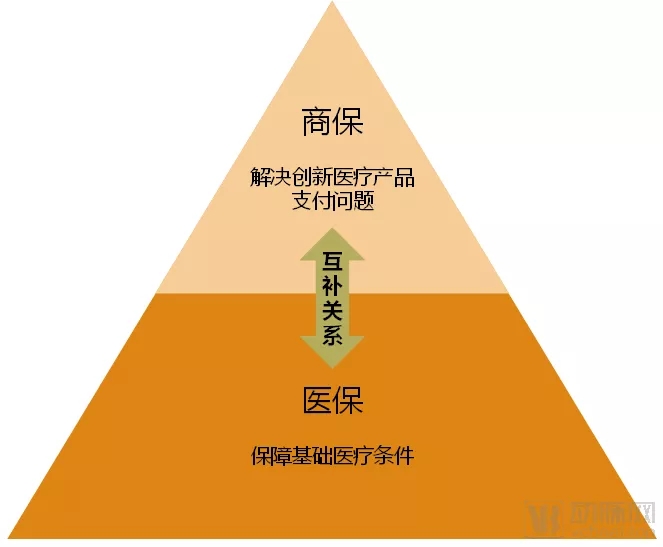
商保与医保之间的互补关系
医保与商保之间并非是要互相竞争,也不完全是合作关系,更多的是相互补足。商保的关键点在于补足医保无力偿付的那部分医疗产品,主要是高价的创新医疗产品的支付问题。这样医保与商保互相协同,医保保基础,商保保“高端”,就能够全面覆盖医疗健康产业。
我们已经看到很多优秀的特药险、重疾险、肿瘤用药险产品的出现,开始逐渐补足了医保在这些大病、特病人群上支付乏力的问题。CAR-T细胞治疗一旦获批,很大概率也会被纳入到这些大病医疗险中。
虽然前路仍会坎坷,但是我们仍然为细胞治疗产业在这半年中取得成就而振奋。相信随着国内医疗产业的变革,CAR-T在研发、支付上遇到的问题,也将随之迎刃而解。