2018年1月25日最新发表在 Cell的文章,通讯作者是Wellspring Biosciences华人科学家刘异博士。他们的研究团队研发出特异靶向KRAS突变这种“无药可靶”的癌症变构共价抑制剂ARS-1620,在体外和动物模型上都有良好抑癌效果,并且有期望作为临床研究小分子,为癌症治疗带来新曙光!
KRAS在许多癌症中会发生突变,是主要癌基因之一。科研工作者们一直致力于寻找特异有效阻断KRAS功能的药物,但是到目前为止,KRAS仍然是无药可靶向“undruggable”。45-50% KRAS基因在第12号密码子发生了错义突变G12C。这个突变激活KRAS蛋白导致下游的信号通路异常激活从而产生癌症。其中分别有11%-16%的肺腺癌病例中存在该突变,1%-4%存在于胰腺癌和结直肠癌中。科研工作者们一直寻找不到好的小分子靶向这种突变和体内药理模型。通过研究人员的不懈努力,2016年两篇报道发现可以结合GDP的KRAS G12C突变使蛋白失活的共价小分子抑制剂ARS-853,并且在细胞模型上达到良好效果,由于需要克服很大一个难题,就是该药物需最大化捕捉体内大多由GTP结合的KRAS循环到GDP结合的KRAS需要达到一个足够药物阈值浓度。因此,还没有在体内模型药代动力学(PK)中得到验证。
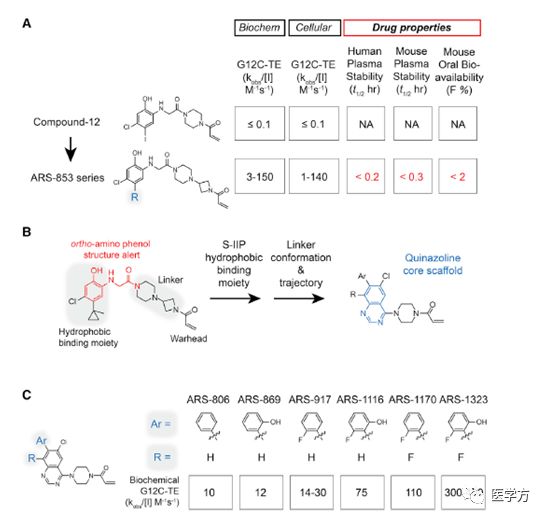
基于ARS-853系列小分子,通过化学液质联用(LC/MS-MS)直接检测共价小分子与KRAS G12C结合,本篇文章研究团队通过结构改造,优化出活性更好,药代动力学更优的化合物ARS-1620。小鼠模型口服摄入ARS-1620,体内指标显示有着极好的生物可利用性,在血液中的浓度也很稳定。

ARS-1620与KRAS G12C共晶结果,也展示了该小分子与蛋白变构口袋有直接结合,关键残基是HIS95。相较于WT未发生突变的KRAS蛋白, 小分子参与KRAS G12C与GDP结合过程, 并且小分子可以模拟SOS介导,生理情况下KRAS G12C结合GDP的过程。

根据对一系列细胞的突变靶点研究,ARS-1620可以浓度,时间依赖的抑制蛋白的表达。在非小细胞肺癌不缺失和缺失KRAS G12C细胞系中检测ARS-1620及其非活性类似物是否可以抑制RAS信号通路,发现只有在KRAS G12C的细胞系中具有活性的ARS-1620可以有效抑制激活的RAS癌通路,其活性ARS-853的10倍。
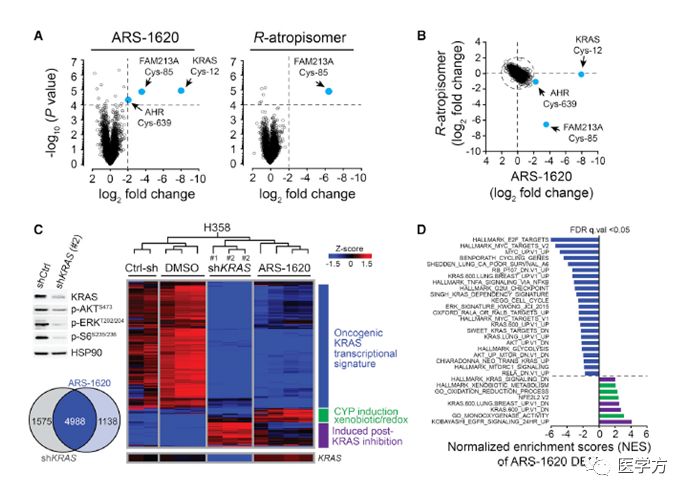
为了检测ARS-1620是否有脱靶,作者使用化学质谱筛选了3012标记蛋白8501半胱氨酸残基对ARS-1620共价结合能力,排除了该化合物的脱靶效应。此外,研究人员们也在非小细胞肺癌KRAS G12C细胞系H358中,通过分析全基因组的表达情况,确认了ARS-1620可以抑制KRAS的下游通路。

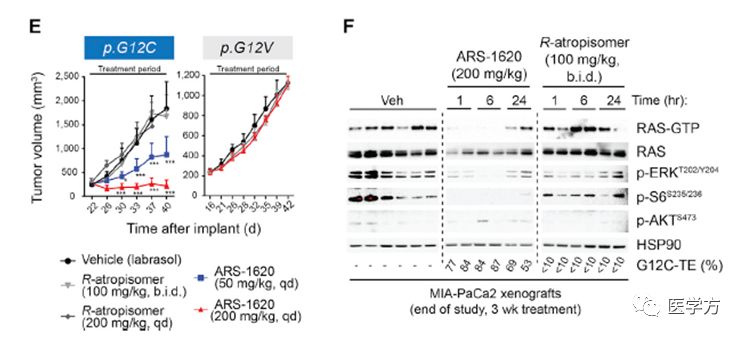
小鼠通过口服摄入了ARS-1620分析其该分子在体内的一系列指标发现其具有着很好的生物可利用性和稳定的血浆浓度。在肿瘤附近,ARS-1620也有着较好的峰值浓度,并且皮下移植瘤模型也印证该化合物浓度依赖有效抑制KRAS G12C肿瘤生长。
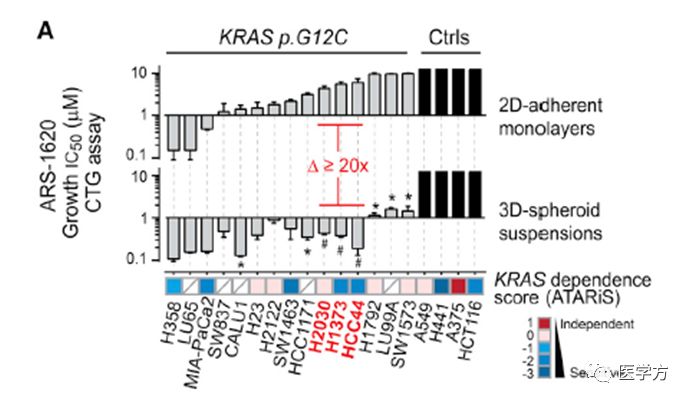
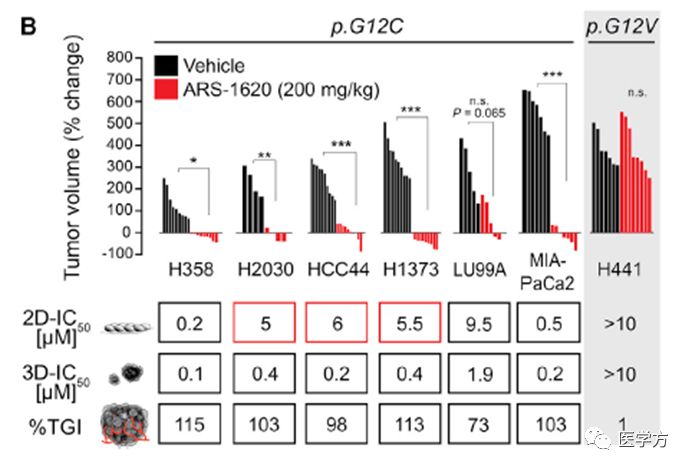
基于前人大量检测KRAS G12C突变,与敲减KRAS RNAi文库筛选细胞模型报道, 研究人员通过2D,3D培养技术排除细胞融合度可能影响突变型细胞对于该小分子抑制剂的敏感性,发现2D培养时,只有小部分突变型细胞对化合物敏感,然而3D培养有较高的普便抑制作用。另一种KRAS突变G12V的肿瘤则没有受该分子的影响,体现了该分子的特异性。
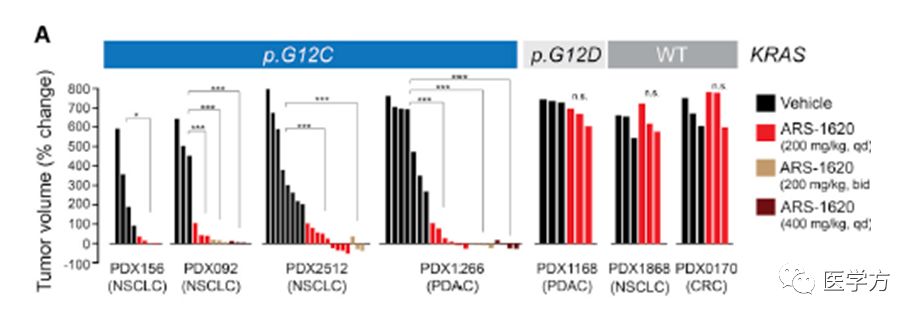
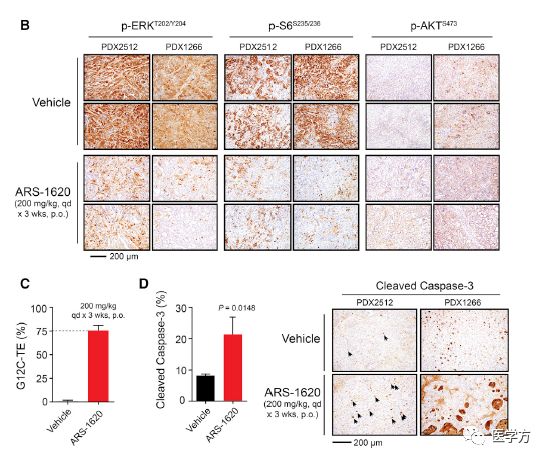
对于非小细胞肺癌和胰腺导管腺癌的病人来源KRAS突变G12C的肿瘤组织样本(PDX)异种移植,ARS-1620有着很好的抑制肿瘤产生效果,并且可以有效抑制下游ERK磷酸化激活通路,激活凋亡,小鼠口服高浓度(1000mg/kg)一周,没有观察到毒性,说明ARS-1620有很大潜力在临床治疗中发挥作用。
总结
该研究团队发现了高效特异的变构共价化合物抑制剂ARS-1620特异性靶向KRAS G12C突变,这个一直是药物研发的困难靶点。并且小鼠模型具有良好的药代动力学参数,并且在病人样本PDX模型中同样也很好的抑制效果,未来,该化合物有望进一步在体内,在临床上继续进一步深入研究,造福于广大癌症患者!