普拉替尼,普雷西替尼 普吉华 Gavreto (BLU-667)
英文名称:Pralsetinib
中文名称:普拉替尼,普雷西替尼
商品名:Gavreto
适用症:用于治疗RET融合阳性非小细胞肺癌(NSCLC)成人患者、12岁以上需要全身治疗的晚期或转移性RET突变甲状腺髓样癌(MTC)患者和需要全身治疗且放射性碘难治性晚期或转移性RET融合阳性甲状腺癌患者。
剂量和给药方法
※推荐剂量
400mg每天一次,空腹口服。如果漏服,可以补服,下次服药仍按照原间隔时间。如果服药后发生呕吐,不可补服,下次服药仍按照原间隔时间。
※剂量调整
如果因不良反应需要减量,按表1进行,当减至最低剂量时仍无法耐受不良反应时,永久停用Pralsetinib。
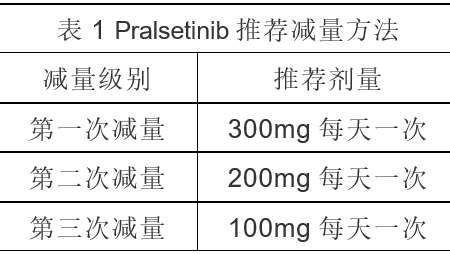
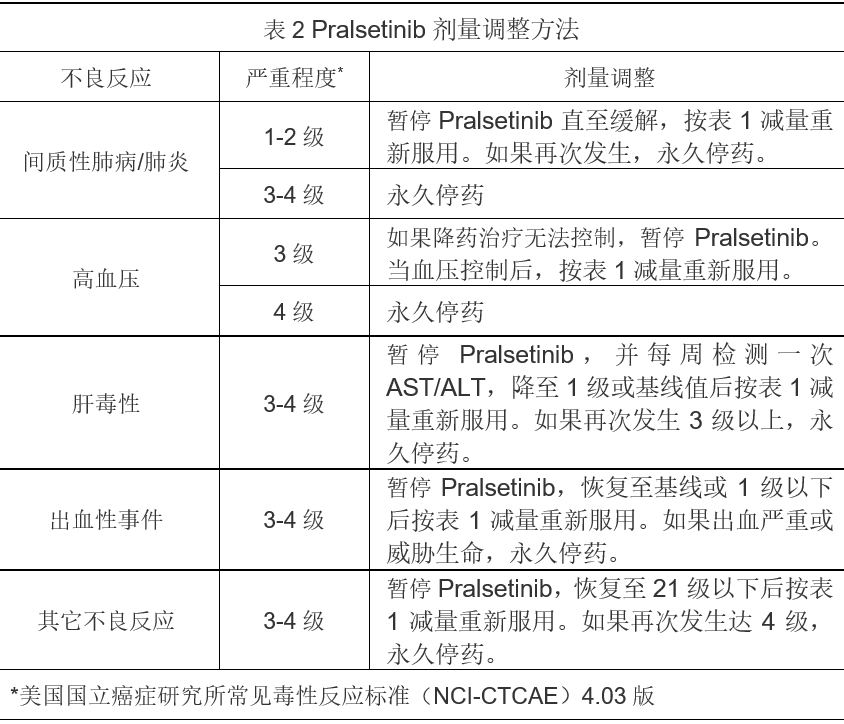
如果因不良反应需要调整给药方案,按表2进行。
在服用Pralsetinib期间尽量避免使用强效CYP3A4和 P-gp抑制剂,如果不可避免时,按表3减量服用。
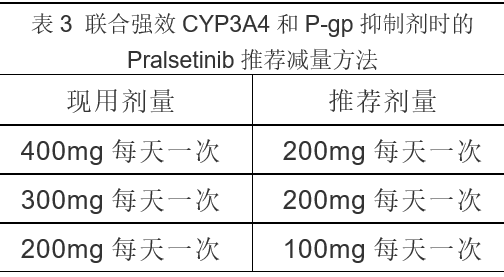
停用CYP3A4和P-gp抑制剂3-5个半衰期(约3-5天)后,恢复Pralsetinib原剂量。
在服用Pralsetinib期间尽量避免使用强效CYP3A4诱导剂,如果不可避免时,联用后第7天开始,Pralsetinib的剂量加倍。停用CYP3A4诱导剂14天后,恢复Pralsetinib原剂量。
患者轻度肝损害(总胆红素≤正常值上限和AST>正常值上限,或正常值上限<总胆红素<1.5倍正常值上限)时,无需调整剂量。
剂型和规格
胶囊:100mg。
警告和注意事项
本部分安全性数据来自Pralsetinib治疗438例RET基因改变实体瘤患者的临床研究,剂量为400mg每天一次。
※间质性肺病/ 肺炎
Pralsetinib 可导致严重的、威胁生命的和致命的间质性肺病/ 肺炎。临床研究中,间质性肺病/ 肺炎发生比例10% ,3-4 级2.7% ,致命0.5% 。
在服用Pralsetinib 期间密切注意提示间质性肺病/ 肺炎的肺部症状,当出现急性或加重的呼吸困难、咳嗽或发热等症状时,马上暂停Pralsetinib ,去医院检查。
※高血压
临床研究中,高血压发生比例29% ,3 级14% 。7% 的患者因此暂停Pralsetinib ,3.2% 的患者减量。在高血压未得到控制前,不可服用Pralsetinib。开始服用Pralsetinib前,第一周时和每个月检查血压。
※肝毒性
临床研究中,2.1% 的患者发生严重的肝毒性。谷草转氨酶(AST )升高的患者比例为69% ,3-4 级5.4% ,中位发生时间15 天(范围5 天-1.5 年),。谷丙转氨酶(ALT )升高的患者比例为46% ,3-4 级6% ,中位发生时间22 天(范围7 天-1.7 年)。开始服用Pralsetinib前,头三个月时每二周,之后每个月检查AST和ALT。
※出血性事件
Pralsetinib 可导致严重的、威胁生命的和致命的出血性事件。临床研究中,3 级以上出血性事件发生比例2.5% ,其中1 例患者死亡。
※影响伤口愈合的风险
Pralsetinib 抑制血管内皮生长因子(VEGF )信号通路,有影响伤口愈合的潜在风险。在手术前至少停药5天,在手术后至少停药2周至伤口充分愈合。
※胚胎- 胎儿毒性
动物试验显示,Pralsetinib 有胚胎- 胎儿毒性。患者和伴侣应在服药期间和停药二周内,使用有效的避孕措施。
不良反应
本部分安全性数据来自ARROW 研究,220 例RET 融合阳性转移性非小细胞肺癌患者,中位年龄60 岁,52% 女性,50% 白人,Pralsetinib 400mg 每天一次。
严重不良反应的比例为45% ,最常见(≥2% )的为肺实质病变,肺炎,败血症,尿路感染和发热。5% 的患者发生致命不良反应,其中超过1 例的为肺实质病变3 例和败血症2 例。
15% 的患者因不良反应永久停药,最常见的原因为肺炎(1.8% ),肺实质病变(1.8% )和败血症(1% )。
60% 的患者因不良反应暂停药物,最常见的原因为中性粒细胞减少,肺炎,贫血,高血压,肺实质病变,发热,AST 升高,肌酸激酶升高,乏力,白细胞减少,血小板减少,呕吐,ALT 升高,败血症和呼吸困难。
36% 的患者因不良反应减量,最常见的原因为中性粒细胞减少,贫血,肺炎,乏力,高血压,肺实质病变和白细胞减少。
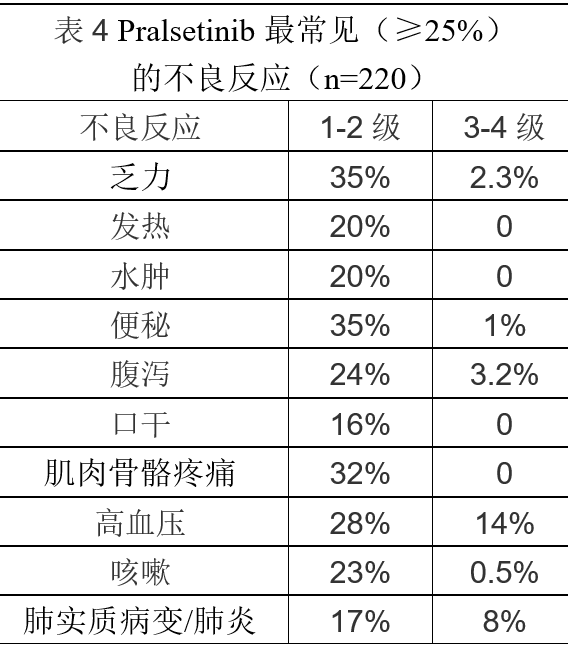
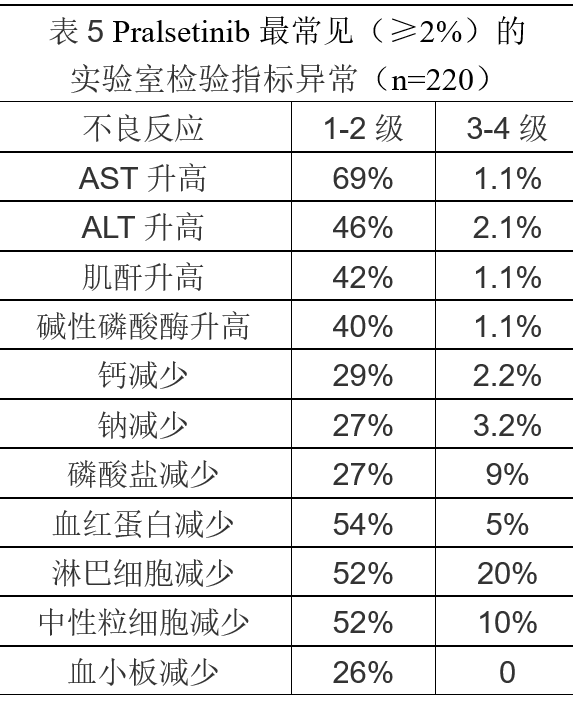
最常见(≥25% )的不良反应为乏力,便秘,肌肉骨骼疼痛和高血压,见表4 。最常见(≥2% )的3-4 级 实验室检验指标异常为淋巴细胞减少,中性粒细胞减少,磷酸盐减少,血红蛋白减少,钠减少,钙减少和ALT升高,见表5。
药代动力学
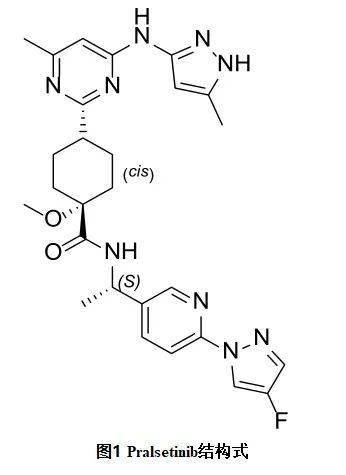
Pralsetinib结构式见图1,分子量533.61克每摩尔,在水里的溶解度随着pH值升高而降低。
Pralsetinib 空腹口服2-4 小时后达到血药浓度峰值,平均半衰期为(单药给药时14.7 小时,连续给药时22.2 小时),连续给药3-5 天后达到稳态,400mg 每天一次时C max 2830ng/mL ,AUC 0-24h 43900h•ng/mL ,血药浓度蓄积倍数<2 。血浆蛋白结合率97.1% ,表观分布体积228 升,表观清除率9.1 升每小时。
与高脂食物随餐口服时,Pralsetinib 的C max 增加了104% ,AUC 增加了122% 。
Pralsetinib 主要通过肝CYP3A4 酶代谢,其次是CYP2D6 和CYP1A2 。Pralsetinib 主要通过粪便排泄,少量通过尿。患者的年龄、种族、性别和体重的差异对Pralsetinib 的代谢没有影响。轻度至中度的肾功能不全或轻度的肝功能不全不影响Pralsetinib 的代谢。
Pralsetinib 是CYP3A4/5 的时间依赖性抑制剂,CYP3A4/5 ,CYP2C8 和CYP2C9 的抑制剂和诱导剂,P-gp 和BCRP 的底物。
如果与强效CYP3A4 和P-gp 抑制剂合用,将会显著增加血药浓度,比如联用伊曲康唑时,Pralsetinib 的Cmax 增加84% ,AUC 增加251% 。
如果与强效CYP3A4 诱导剂合用,将会显著降低血药浓度,比如联用利福平时,Pralsetinib 的Cmax 减少30% ,AUC 减少68% 。
抗酸剂对Pralsetinib 的代谢 没有临床意义上的影响 。
临床疗效
※一线治疗数据
ARROW 研究中,27 例初治的RET 融合阳性转移性非小细胞肺癌,中位年龄65 岁,52% 女性,59% 白人,33% 亚洲人,96%PS 评分0-1 分,37% 脑转移。RET 基因经NGS 检测比例67% ,经FISH 检测比例33% ,最常见的RET 融合伴侣为KIF5B (70% )和CCD6 (11% )。
完全缓解率11% ,部分缓解率59% ,总有效率70% ,中位缓解持续时间9.0 月。
※二线治疗数据
ARROW 研究中,87 例初治的RET 融合阳性转移性非小细胞肺癌,中位年龄60 岁,49% 女性,53% 白人,35% 亚洲人,94%PS 评分0-1 分,43% 脑转移。所有患者均接受过含铂化疗,45% 使用过PD-1/PD-L1 单抗,25% 使用过靶向药。RET 基因经NGS 检测比例77% ,经FISH 检测比例21% ,最常见的RET 融合伴侣为KIF5B (75% )和CCD6 (17% )。
完全缓解率5.7% ,部分缓解率52% ,总有效率57% ,中位缓解持续时间未达到(>15.2 月),80% 有效患者的缓解时间超过6 个月。
其中39 例接受过PD-1/PD-L1 单抗治疗的患者,总有效率59% ,中位缓解持续时间未达到(>11.3 月)。
8 例具有可测量脑转移病灶的患者,入组前2 个月内均未接受过放疗,2 例颅内病灶完全缓解,2 例颅内病灶部分缓解,总有效率50% ,75% 有效患者的缓解时间超过6 个月。
储存
于室温(20℃-25℃)保存,避免受潮,允许短期储存于15℃-30℃环境下。





