临床数据
2019年6月24日至2021年2月25日期间,共有301例患者纳入试验。入组患者接受ASK120067(160mg,每日两次)治疗,直至疾病进展或出现不可接受的毒性。截止2021年9月9日,76例(25.2%)患者仍在接受治疗。
入组患者的人群特征包括:62.1%的患者为女性;98.3%的患者为肺腺癌;77.4%的患者在参与本研究前接受了一线治疗;EGFR突变类型包括外显子19缺失(61.1%)、L858R(33.2%)和其他(2%);32.9%的患者发生中枢神经系统转移。
该试验的主要终点是独立审查委员会(IRC)根据实体瘤反应评估标准1.1版评估的客观缓解率(ORR)。次要终点包括疾病控制率(DCR)、无进展生存期(PFS)、反应持续时间(DOR)、总生存期(OS)和安全性。
中位随访时间为10.4个月,经IRC评估的ORR为68.8%,DCR为92.4%。所有预先指定的亚组均获得客观缓解,组织样本检测EGFR T790M突变患者的ORR为75.6%,血浆样本检测的患者ORR为60.7%。
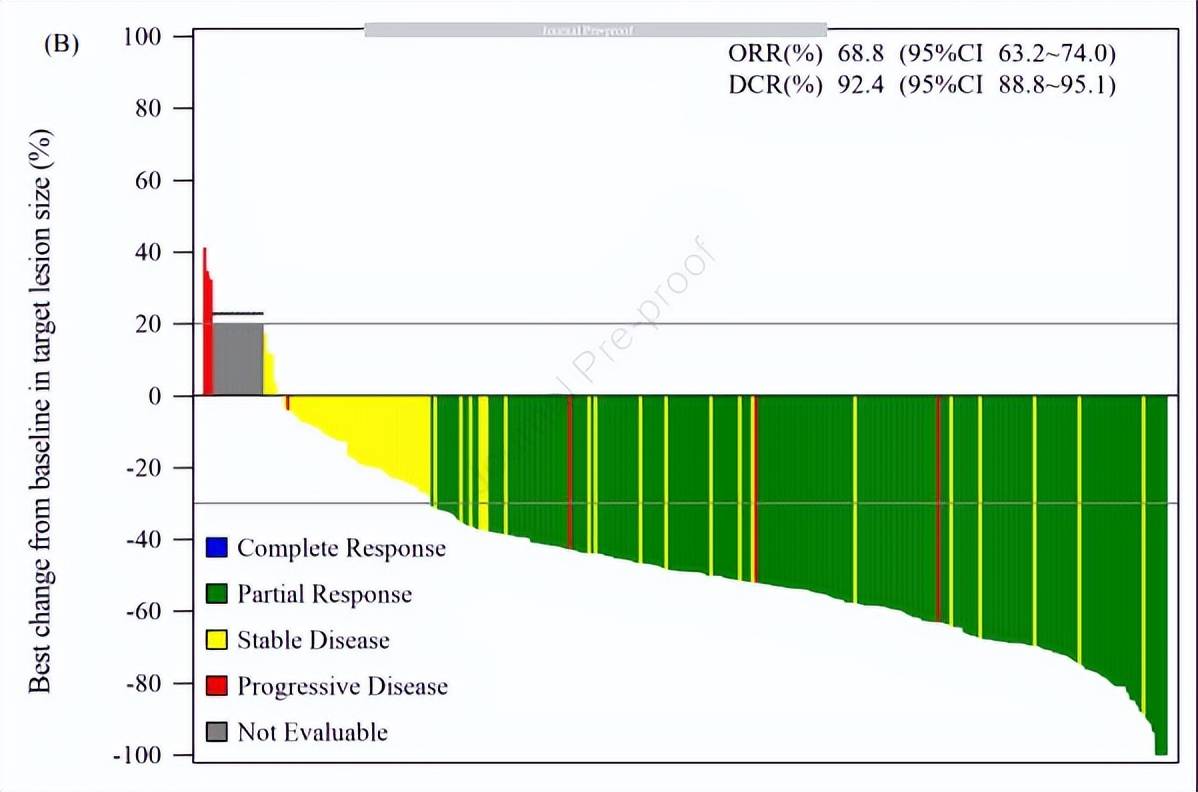 图注:ASK120067治疗EGFR T790M 突变非小细胞肺癌的临床数据
图注:ASK120067治疗EGFR T790M 突变非小细胞肺癌的临床数据
中位PFS为11.0个月,3个月PFS率为89.7%,6个月PFS率为77.4%,12个月PFS率为47.1%。
中位DOR为11.1个月,3个月DOR率为96.1%,6个月DOR率为82.5%,12个月DOR率为46.3%。
中位OS尚未达到(NR)。3个月OS率为95.8%,6个月OS率为90.1%,12个月OS率为72.9%。
值得一提的是,在所有患者中,有276例(91.7%)患者出现肿瘤缩小。
此外,在99例(32.9%)中枢神经系统(CNS)转移的患者中,ORR为64.6%,中位PFS为9.7个月,中位DOR为9.6个月。在41例具有可评估CNS病变的患者中,ORR为56.1%,DCR为100%,中位PFS为10.6个月。
不良反应
在安全性方面,289例(96.0%)患者经历了至少一种与治疗相关的不良反应(TRAE),最常见的包括:腹泻(81.7%)、贫血(32.6%)、皮疹(29.9%)和食欲下降(28.2%)。
104例(34.6%)患者发生≥3级不良反应,最常见的包括:腹泻(13.0%)、低钾血症(4.3%)、贫血(4.0%)和皮疹(3.3%)。
小结
在这项IIb期研究中,ASK120067在局部晚期或转移性EGFR T790M突变的NSCLC患者中显示出良好的疗效和可管理的安全性。
ASK120067有望成为中国第一代和第二代EGFR-TKI治疗进展后局部晚期或转移性EGFR T790M突变NSCLC患者的新治疗选择。