度伐利尤单抗,德瓦鲁单抗 英飞凡 Durvalumab(Imfinzi) (MEDI4736)
【药品名称】
通用名称:度伐利尤单抗注射液
商品名称:英飞凡 IMFINZI
英文名称:Durvalumab Injection
【药品成分】
活性成分:度伐利尤单抗
辅料: L-组氨酸、L-组氨酸盐酸盐一水合物、α,α-海藻糖二水合物、聚山梨酯 80和注射用水
【作用类别】
PD-L1免疫检查点抑制剂
【适应症】
本品适用于在接受铂类药物为基础的化疗同步放疗后未出现疾病进展的不可切除、III期非小细胞肺癌患者的治疗。
【药品规格】
120mg/2.4mL
【用法用量】
本品推荐剂量为静脉输注10mg/kg,每2周一次,每次输注需超过60分钟,直至出现疾病进展或不能耐受的毒性。本品最长使用不超过12个月。
【用量调整】
不推荐减少本品剂量。当出现严重不良反应时,按照下表所述暂停用药或中止用药。
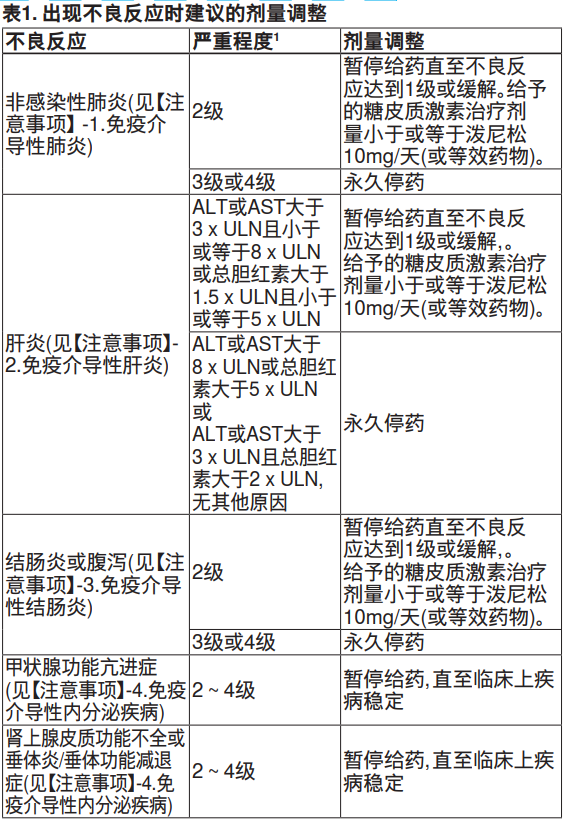
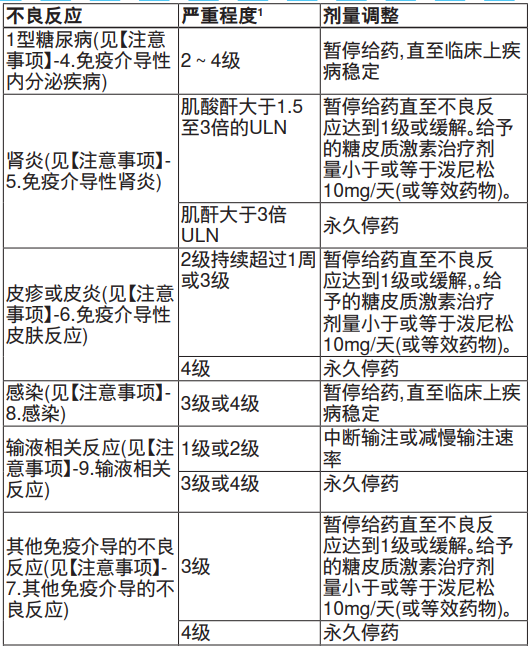
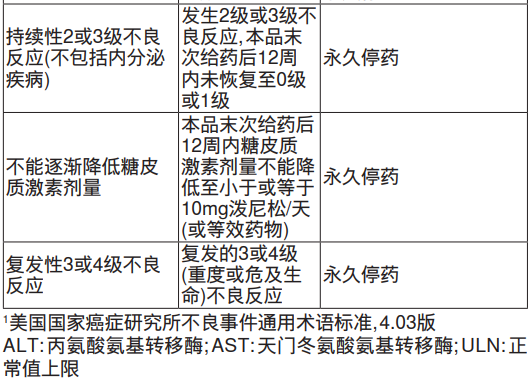
【特殊人群】
肝损伤 :
轻度肝功能损伤患者无需进行剂量调整。本品在中度或重度肝功能损伤患者中使用的安全性及有效性尚未建立,如经医生评估使用本品预期获益大于风险,需在医生指导下谨慎使用。
肾损伤 :
轻度和中度肾功能损伤患者无需进行剂量调整。本品在重度肾功能损伤患者中使用的安全性及有效性尚未建立,不推荐使用,如经医生评估使用本品预期获益大于风险,需在医生指导下谨慎使用。
儿童人群 :
尚未确立本品在18岁以下儿童及青少年中的安全性和有效性,无相关数据。
老年人群 :
本品目前在老年患者(65岁及以上)和年轻患者之间未发现总体安全性或疗效差异,无需进行剂量调整。
【孕妇及哺乳期妇女用药】
基于本品的作用机制和动物研究数据,孕妇使用本品可能会对胎儿造成损害。动物生殖毒性研究表明,从器官形成期开始至分娩给予食蟹猴度伐利尤单抗会导致早产、流产和新生胎仔死亡率增加。
告知孕妇本品对胎儿具有潜在风险。在本品治疗期间以及本品末次给药后至少3个月内,建议具有生育能力的女性采用有效的避孕措施。
【副作用和不良反应】
在临床试验中,度伐利尤单抗(英飞凡)最常见(≥20%)的副作用和不良反应有:
咳嗽、疲劳、非感染性肺炎或放射性肺炎、上呼吸道感染、呼吸困难和皮疹。
度伐利尤单抗(英飞凡)常见的(≥10%)的副作用和不良反应包括:
副作用和不良反应发生率
咳嗽/痰咳40%
非感染性肺炎/放射性肺炎34%
呼吸困难25%
腹泻18%
腹痛10%
甲状腺功能减退12%
皮疹23%
瘙痒12%
疲劳34%
发热15%
上呼吸道感染26%
感染性肺炎17%
度伐利尤单抗(英飞凡)治疗组低于10%的副作用和不良反应有:
发声困难、排尿困难、盗汗、外周性水肿,感染易感性增加。
【药品贮藏】
密封
【批准文号】
进口药品注册证号S20190039
【生产企业】
AstraZeneca UK Limited


