Sapanisertib是一种口服的mTORC1/mTORC2的高选择性抑制剂。在近期发表在british journal of cancer期刊上的一项研究中,来自美国纪念斯隆-凯特琳癌症中心的科学家们进行了一期剂量递增/扩张研究,评估了sapanisertib在晚期实体肿瘤中的安全性/耐受性。

符合条件的患者接受了每日一次(QD; 31例)、每周一次(QW;30例)、每周3日 (QD×3dQW;33例)和每周5日(QD×5dQW;22例)增加剂量的sapanisertib。在扩张型队列中,82例肾细胞癌(RCC)、子宫内膜癌或膀胱癌患者分别被给予sapanisertib 5 mg QD(39例)、40 mg QW(26例)和30 mg QW(17例)。
结果显示,最大耐受剂量分别为6 mg QD、40 mg QW、9 mg QD×3dQW和7 mg QD×5dQW。常见的剂量限制毒性(DLTs)包括高血糖、斑丘疹(QD)、虚弱和口炎(QD * 3dQW/QD * 5dQW);扩张期剂量5 mg QD和30 mg QW是根据DLT评估期后的耐受性选择的。1例肾细胞癌患者达到完全缓解;9例出现部分反应(肾细胞癌:7例;类癌/子宫内膜癌:各1例)。Sapanisertib的药代动力学是呈时间线性的,支持多次给药。药效动力学结果显示出与治疗相关的TORC1/2生物标志物的减少。
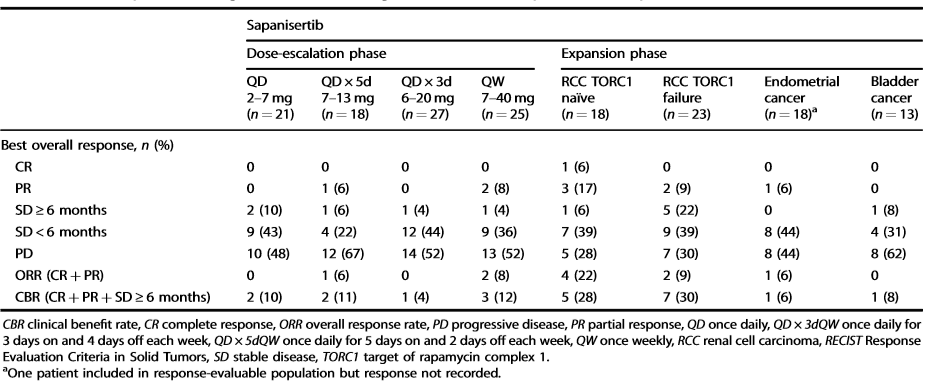
患者的肿瘤反应情况评估
该研究表明,Sapanisertib的安全性可控,并可观察到其在肾细胞癌和子宫内膜癌中具有初步抗肿瘤活性。
原始出处:
Voss, M.H., Gordon, M.S., Mita, M. et al. Phase 1 study of mTORC1/2 inhibitor sapanisertib (TAK-228) in advanced solid tumours, with an expansion phase in renal, endometrial or bladder cancer. Brit J Cancer (2020).