近日,世界顶级儿科研究机构之一西雅图儿童研究所和贝纳罗亚研究所宣布,他们开发了一种基因编辑T细胞疗法,以阻止1型糖尿病破坏性的自身免疫反应。
在自身免疫性疾病中,效应T细胞(Effective T cells, Teff)将会过度激活并对身体造成伤害。该研究的通讯作者,西雅图儿童研究所的免疫科主任、免疫治疗中心主任David Rawlings博士说:“一个健康的免疫系统需要调节性T细胞(Treg)来平衡效应T细胞,Treg会使效应T细胞冷静下来,并限制其对自身组织的损伤。”
但是,天然的Treg在自身免疫性疾病中也不能正常发挥作用。且另外一个问题是,Treg在外周血中数量很少,且很难在保持功能性的同时扩展到体外。
因此,Rawlings博士的团队对T细胞进行基因工程,使它们功能类似正常的Treg,希望这些基因工程改造的T细胞能够帮助抑制自身免疫性疾病中过度活跃的免疫反应,控制疾病。该研究发表在 Science Translational Medicine 。
▲ HDR编辑T细胞(图片来源:sciencemag)
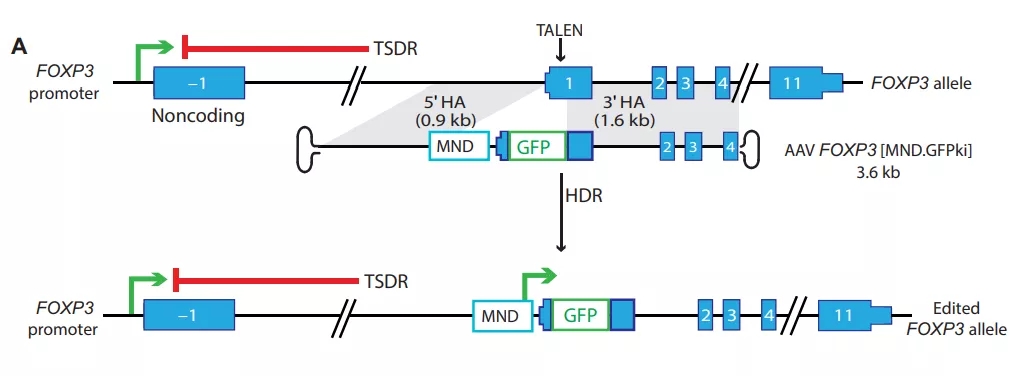
该研究团队从患者的外周血中分离出CD4+ T细胞,并利用同源性定向修复(HDR)介导的基因编辑增强 Foxp3 的表达(Treg的生成由转录因子 Foxp3 调控),以绕过常规CD4+ T细胞中 Foxp3 的正常沉默,从而转化为Treg样细胞。
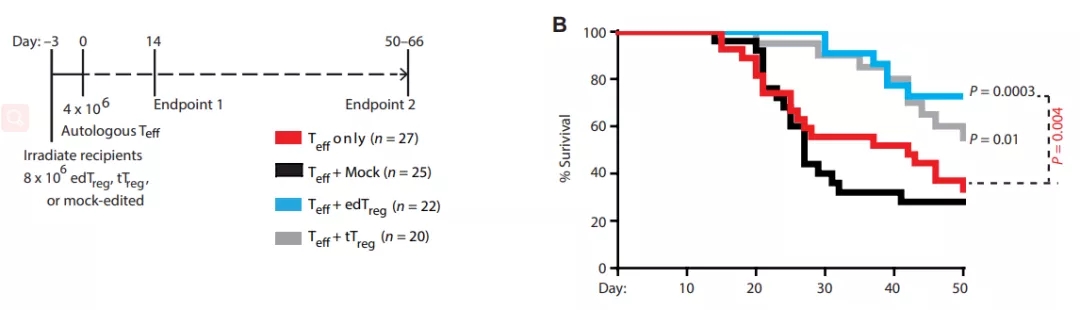
在体外实验中,研究团队观察到这些HDR编辑的T细胞(edTreg)克服了天然Treg存在的局限性(如难以分离和扩增),稳定表达 Foxp3 的edTreg能够在体外产生抑制表型。研究小组报告说,在移植物抗宿主病(GvHD)小鼠模型中,输注 edTreg 可以预防症状并改善了动物模型的存活率。
▲ edTreg改善GvHD模型存活率(图片来源:sciencemag)
另外,该工程策略允许产生抗原特异性edTreg,将TCR附着在工程免疫细胞的表面,且抗原特异性edTreg拥有更强大的活性。在多发性硬化(MS)模型中,抗原特异性 edTreg 具有更强的对致病性T细胞的抑制性。
尽管,该研究中展现了治疗GvHD和MS的潜力,但是该团队表示最终目标还是集中在罕见的自身免疫性疾病,包括T1D。
1型糖尿病(T1D)是一种自身免疫性疾病,由胰岛素分泌缺陷引起,而胰岛素由胰岛β细胞产生,T1D中,效应T细胞会攻击胰岛β细胞。一旦胰岛β细胞遭到破坏,就无法释放胰岛素,导致血液中的葡萄糖水平持续升高,从而引起糖尿病的早期症状,如尿频、口渴、饥饿和极度疲劳等。
因此,利用 edTreg 策略抑制致病性T细胞来保护胰岛β细胞以控制T1D,从理论上是可以实现的。此前研究人员还在5月份举行的美国基因与细胞治疗学会(ASGCT)年会上报告了 edTreg 治疗T1D的积极临床前结果。
结果显示:与1型糖尿病效应T细胞匹配的TCR工程的特异性edTreg归巢于胰腺,阻断了模型糖尿病的发生,而多克隆Treg未能做到。
这些结果的验证,进一步有助于推进 edTreg 进入临床试验,以治疗1型糖尿病。
▲ 贝纳罗亚研究所Jane Buckner博士(左)和David Rawlings博士(右)
在过去的十年间,Rawlings博士一直梦想着为1型糖尿病儿童开发一种疗法,不需要注射胰岛素,而是利用人体自身的免疫细胞来治疗1型糖尿病。
Rawlings博士表示:“现在,我的梦想已经开始实现了。这些数据证明了对Foxp3的工程化足以制造出类似Treg的细胞产品,这不仅仅是是一项具有里程碑意义的研究发现,而且可以直接转化为临床用途。”
该项研究得到了,赫尔姆斯利慈善信托基金(Helmsley Charitable Trust)和BRI的400万美元赠款。BRI的Buckner说:“我们想确定edTreg的TCR,使得edTreg更容易进入胰腺,阻止效应T细胞的攻击,从而减缓疾病进展和预防1型糖尿病。”
目前糖尿病是全球性的健康问题是导致死亡的最重要原因之一,影响着全球超过4亿人口,并且患病率正在逐年上升。2019年,国际糖尿病联盟(IDF)发布的全球糖尿病地图(第9版)显示,全球糖尿病患病人数不断上升,全球平均增长率为51%,目前有4.63亿糖尿病患者,按照增长趋势到2045年全球将有7亿糖尿病患者。而中国患有糖尿病的人数位居世界第一,约为1.164亿人。
T1D约占糖尿病患者总量的5%~10%,很明显的特点就是早发,一般在儿童或青少年时期就已经发病。目前,糖尿病治疗的主要手段是注射胰岛素并配合血糖监控。然而,传统的胰岛素补充并不能实现根本性的治疗,并且对糖尿病并发症的控制力也不足。存在高度未满足的医疗需求。
因此,很多的公司/机构都在开发针对T1D的项目。
2020年4月,圣路易斯华盛顿大学的科学家提出利用CRISPR-Cas9对诱导性多功能干细胞(iPSCs)(由患者的成纤维细胞转化而来)进行基因编辑,纠正突变的基因,再将iPSCs分化为胰腺β细胞输注回患者体内,以治疗由基因突变引起的糖尿病。该研究发表在Science Translational Medicine。
2020年3月,威斯康星大学麦迪逊分校(University of Wisconsin - Madison)的研究团队在发表在Cell Metabolislm杂志上的一篇文章中,提出了一种预防1型糖尿病的方法:敲除糖尿病小鼠模型β细胞的 IRE1α 基因,然后这些β细胞就会“去分化”成未成熟细胞,然后转变成正常的β细胞,正常分泌胰岛素且不被免疫细胞所攻击。
2018年,CRISPR Therapeutics和ViaCyte公司达成了一项协议,开发一种“现货”(off-the-shelf)、CRISPR-Cas9编辑的干细胞衍生胰腺细胞替代疗法,以治疗1型糖尿病(T1DM)。该策略是使用CRISPR-Cas9技术编辑健康的人多能干细胞,使它们缺失B2M基因,并表达PD-L1,然后将其分化为胰腺前体细胞。在2019年9月,CRISPR Therapeutics公布了该疗法的积极临床前数据。
总部位于意大利米兰的基因治疗公司Altheia Science,致力于开发基于慢病毒的自体造血干细胞基因疗法,通过上调免疫细胞中的PD-L1表达,使T细胞失活,从而避免其对健康组织的攻击,以治疗自身免疫性疾病,例如1型糖尿病和进行多发性硬化症等。该公司于2018年12月宣布完成A轮融资,筹集资金达到了1,930万美元。
Cell Stem Cell上一项来自匹兹堡大学医学院的研究,利用腺相关病毒(AAV)载体将两种蛋白(Pdx1和MafA)输送到小鼠胰腺中,结果证明Pdx1和MafA能将α细胞重编程为功能性的β细胞,生成胰岛素。该研究为1型糖尿病的治疗策略提供了新的思路。
当然,中国的科学家在开发糖尿病治疗新技术方面同样不甘示弱。由广东工业大学生物医药研究院的赵子建教授以及李芳红教授领军的科研团队,在治疗糖尿病和自身免疫疾病技术上的重大突破——运用基因治疗技术,让1型糖尿病小鼠体内产生大量ω-3脂肪酸,成功逆转了糖尿病的进程。
干细胞治疗策略
2019年,美国《时代》周刊将干细胞治疗糖尿病纳入改变未来十年医疗的12大创新发明列表中。
为此,许多公司正在探索使用干细胞疗法来治疗糖尿病,例如Seraxis、Unicyte、Sernova、Betalin Therapeutics、AltuCell、NextCell Pharma、Osiris Therapeutics、Mesoblast、Evotec和赛诺菲(Sanofi)、Semma Therapeutics、诺和诺德(Novo Nordisk)、礼来(Eli Lilly)和Sigilon、PharmaCyte等。
值得一提的是,专注于1型糖尿病(T1DM)的Semma Therapeutics开发了一套从人类多能干细胞(这种干细胞能够在体内分化成任何细胞类型)产生几乎无限数量的高质量干细胞衍生胰岛(SC-islets)的程序。并于2019年国际干细胞研究学会(ISSCR)的全体会议上公布了在动物模型上的试验数据,实现了两个领先项目的临床前概念验证。此外,Semma于2019年9月被Vertex Pharmaceuticals斥资近10亿收购。
2015年3月,我国科技部召开国家首次精准医学战略专家会议,计划启动精准医疗计划。同时,精准医疗拟被列为“十三五”健康保障发展问题研究的重大专项之一。
自身免疫性疾病作为继心血管疾病、癌症后威胁人类健康的第三大杀手,也被列入我国十类重大疾病。伴随国家对“精准医学”的关注,以及干细胞治疗在狼疮、风湿性关节炎、多发性硬化症等自身免疫性疾病取得了较大的突破,越来越多的人关注到这个领域。