HER2 CAR-T治疗实体瘤获突破:患者已无癌症迹象
CAR-T疗法是指从患者体内分离出T细胞,然后在体外对T细胞进行改造,使其表达能够识别癌细胞表面抗原(如CD19、BCMA、CD22)的嵌合抗原受体(CAR),接着再将CAR-T细胞进行扩增,最后回输到患者体内,发挥消灭癌细胞的作用。目前,已有3款CD19 CAR-T疗法获批上市,这类疗法在治疗血癌方面临床疗效显著,其“代言人”Emily Whitehead(6岁时急性淋巴细胞白血病复发)在2012年接受CD19 CAR-T疗法治疗后癌症完全消失,目前已保持无癌生存8年。
不过,虽然在治疗血癌方面表现惊人,但利用CAR-T细胞治疗实体瘤仍面临诸多挑战,如肿瘤特异性实体瘤靶点数量有限、CAR-T细胞无法有效浸润到实体瘤中、CAR-T细胞的持久性不足等。
7月15日,来自美国贝勒医学院的一个研究团队在Nature Communications杂志上报道了CAR-T治疗一种肌肉癌症(实体瘤)的突破进展。在一项评估自体HER2 CAR-T疗法治疗儿童转移性横纹肌肉瘤的临床试验中,患者在接受这种新型免疫疗法治疗后,不再能检测到癌症迹象。
该研究的共同通讯作者Meenakshi Hegde博士解释说,这名儿童的癌症是高风险的,因为它对标准化疗没有响应。这也是他们选择该患者接受新型CAR-T疗法治疗的原因。
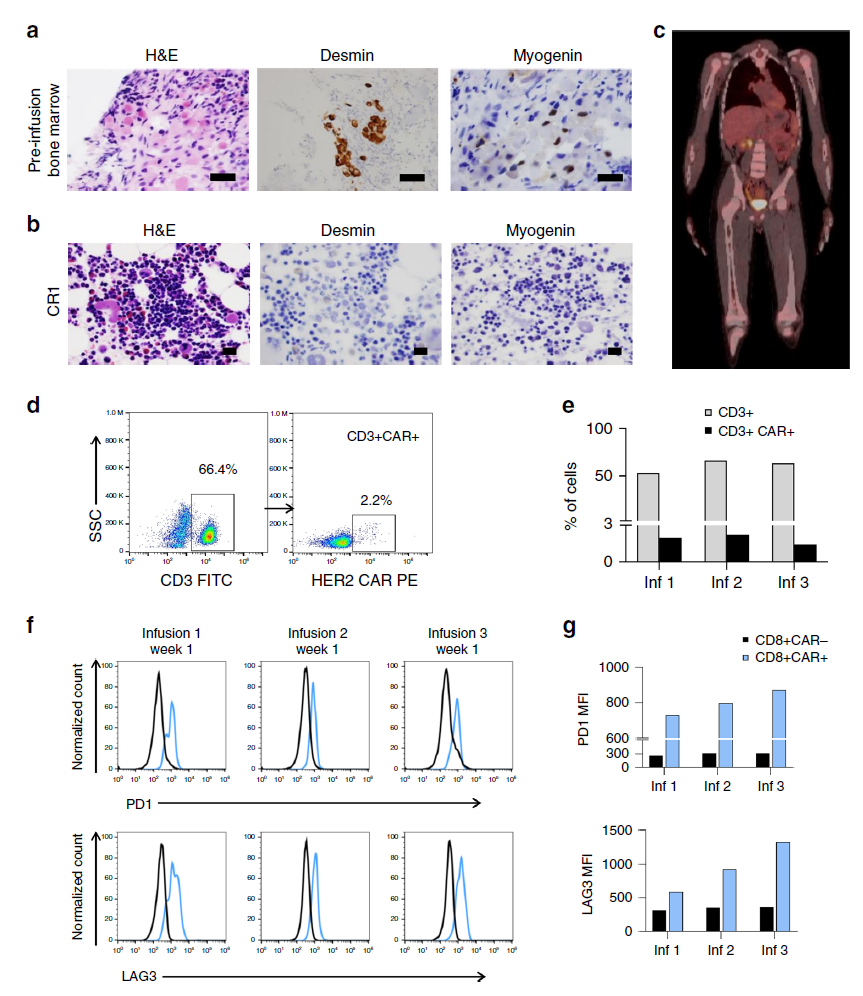
具体来说,在这项研究中,由于这名患者约75%的肿瘤细胞表面都有一种名为HER2的蛋白质。因此,研究人员设计了可靶向该蛋白的CAR-T细胞,用于识别和攻击HER2阳性癌细胞。
在之前一项相关临床试验中(代号为HEROS),研究人员已发现他们所设计的靶向HER2阳性肿瘤细胞的CAR-T细胞尽管具有良好的安全性,但仅为一小部分患者带来了临床益处,且没有根除他们的肿瘤。这可能与HER2 CAR-T细胞虽然可在患者体内扩增但不会持续太久有关。
为了克服这一限制,Hegde博士及其同事在HEROS 2.0试验(一项正在进行的I期临床试验,代码为NCT00902044)中,除了给患者回输HER2 CAR-T细胞,还添加了低剂量化疗,目的是清除患者体内正常的T细胞,以改善患者体内的HER2 CAR-T的扩增和持续性。因为,在回输HER2 CAR-T之前进行淋巴耗尽性化疗可清除患者现有的免疫细胞,进而为HER2 CAR-T在患者体内扩增创造空间。
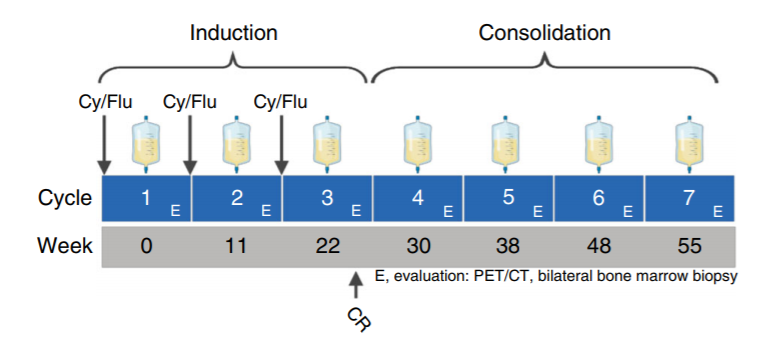
在HEROS2.0试验中,患儿在接受3个周期的“淋巴耗尽性化疗序贯HER2 CAR-T细胞治疗”后获得完全缓解,之后,研究人员又额外回输了4次HER2 CAR-T细胞以巩固疗效(上图)。虽然患者对HER2 CAR-T细胞产生了持久的响应,首次治疗后不再能检测到肿瘤,但在HER2 CAR-T细胞回输停止6个月后,癌症又复发了。
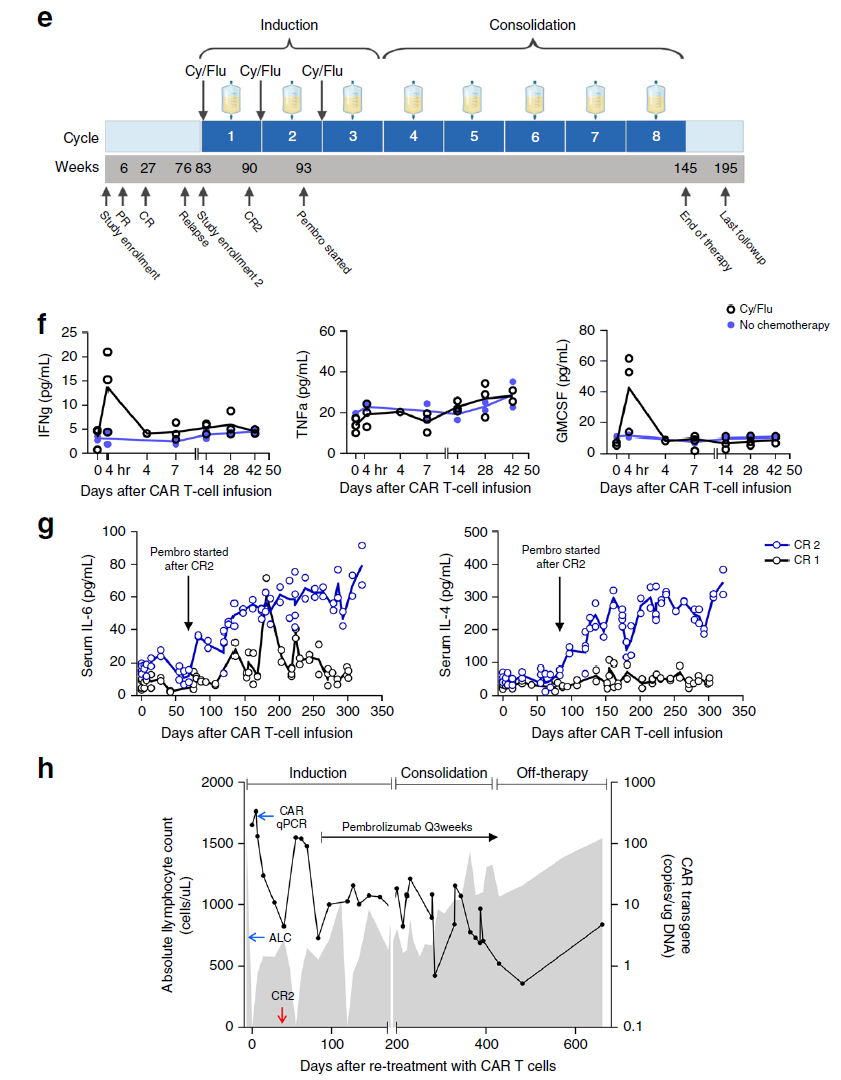
不过,幸运的是,再次接受HER2 CAR-T疗法治疗后(1个周期的淋巴耗尽、1次HER2 CAR-T细胞回输),这名患者获得了第二次完全缓解。为了巩固疗效,研究人员在患者二次缓解后又进行了额外的CAR-T细胞回输联合PD-1抗体帕博利珠单抗治疗(下图e)。
在论文发表时,这名儿童已经停止HER2 CAR-T细胞治疗20个月,且保持着健康和无癌状态。由于CAR-T治疗实体瘤充满各种挑战,因此,这名患者这种特殊的肿瘤反应非常令人鼓舞。
对于患者的癌症为何能够被完全清除,尤其是HER2阴性癌细胞是如何被根除的,研究人员解释说,虽然他们的CAR-T细胞是被开发用于识别和攻击HER2阳性癌细胞,但是在HER2特异性CAR-T细胞被回输到患者体内后,患者自身的免疫系统也被招募来对抗肿瘤,这可能是患者能够持续完全缓解的原因。
Hegde博士表示,他们计划在更多接受HER2 CAR-T细胞治疗的患者中进行更详细的实验,以更好地了解患者免疫系统在消除癌症中的作用。
“总结来说,我们的研究表明,CAR-T细胞或许能够像疫苗一样起作用:将癌症蛋白暴露给患者的免疫系统。随着科学家们对CAR-T细胞设计的进一步理解和改善,这类细胞治疗有可能对一些不能治愈的恶性肿瘤也有效。”领导该研究的Nabil Ahmed博士说。
专家点评
钱程教授
实体瘤免疫治疗目前的难点之一在于实体瘤复杂的肿瘤微环境。肿瘤组织通过肿瘤微环境促进浸润其中的免疫细胞高表达免疫检查点抑制分子(如PD-1、TIM-3和LAG-3),促进免疫细胞过早衰亡,从而抑制免疫细胞功能达到免疫逃逸的目的。
虽然在血液系统肿瘤中CAR-T治疗取得了优异的成效,但是在大多数肿瘤尤其是实体瘤治疗中,由于瘤复杂的抑制微环境,在进行CAR-T细胞回输后会存在扩增不良、存续时间短的缺点。除此之外,实体瘤免疫治疗还存在另一个问题,就是抗原异质性或抗原突变,这将导致在CAR-T细胞治疗之后肿瘤表面的靶抗原发生突变或下调,存在复发的风险。研究者们针对肿瘤微环境引起的CAR-T存续性差和靶抗原突变方向进行研究,例如1)设计双靶点甚至多靶点CAR-T,2)调整胞外识别区域的亲和力以提高CAR-T识别低表达靶抗原的能力,3)共表达细胞因子提高CAR-T体内扩增能力。
此次贝勒医学院Stephen Gottschalk & Nabil Ahmed团队通过靶向HER2 CAR-T细胞成功治疗了Rhabdomyosarcoma (RMS,儿童及青少年恶性软组织肿瘤),首先对于目前治疗效果极其有限的RMS而言,CAR-T细胞治疗的应用给这些平均中位生存时间仅有1.5年的儿童及青少年患者提供了更长的生存时间和新的临床应用方案。报道的患者在完成第一次3个循环的1 × 108cells/m2 CAR-T细胞回输6个月后发生了复发;研究者继续进行了淋巴细胞清除和CAR-T回输,患者获得CR,在完成治疗后4周患者发生了肿瘤转移,研究者采用了PD-1抗体帕博利珠单抗进行治疗促进CAR-T细胞功能,在给予帕博利珠单抗后再次进行CAR-T细胞回输治疗,在患者达到第2次CR后12个月内研究者给予患者进行了5个循环的CAR-T回输巩固治疗,最终在回输CAR-T细胞4.3年后,文献报道的小患者的两个风险指标仍在缓解中。研究者对回输前和回输后的免疫细胞进行了基因分析,发现在CAR-T回输后存在外周血T淋巴细胞表面TCRβ的重排,检测到在CAR-T细胞回输前不存在的8个免疫显性克隆,是否这些克隆的存在,使得在后续多循环回输的CAR-T更有效的发挥功能,还需要研究者进一步的研究。
当然,我们也可以看到整个治疗过程更倾向于治疗方案的优化而非在于CAR结构的优化,这就导致CAR-T细胞在体内的存续问题仍然有待解决,肿瘤局部的CAR-T细胞表达的免疫抑制分子显著升高,导致CAR-T疗效有限和出现复发。想要提高CAR-T细胞在实体瘤治疗的疗效,除了在临床方案优化外,CAR结构本身的优化也必不可少:1)首先要解决CAR-T细胞体内存续的问题,越来越多的报道显示,CAR-T细胞的体内持续对于其治疗效果至关重要,如果CAR-T细胞在体内不扩增或者扩增有限,持续性差将会严重影响其疗效,需要反复回输以巩固疗效,但是反复回输又存在细胞来源问题。2)其次要解决CAR-T细胞受免疫微环境影响高表达免疫抑制分子的问题。免疫抑制分子的高表达会使CAR-T细胞的杀伤功能严重衰减,并且过快衰亡,又进一步影响了CAR-T细胞的存续能力。
针对上述两个问题,我们团队对CAR结构进行了诸多改造,在CAR-T持续性上,通过对ScFv设计、铰链的优化和胞内信号最优组合的选择多个方向进行验证,相关工作已经完成了临床前研究,动物实验体内有效性显著,并且CAR-T细胞在体内存续显著增强。在免疫抑制方向,我们对多种免疫抑制分子进行了筛选设计,相关工作也已经完成临床前研究,正在进行稳定性验证。相信CAR-T细胞在体内存续能力的解决可以对CAR-T治疗临床应用起到关键性推动作用。