PROTAC唤起小分子药物“第二春”
在抗体药、基因编辑、细胞治疗新技术层出不穷、风头正盛的今天,曾经的江湖霸主小分子药似乎正走向低谷。然而PROTAC的出现,以其颠覆性的设计、颠覆性的作用机制、挑战“不可成药”靶点的想象空间,近年来受到众多大药厂和资本追捧,重又将小分子药拉回聚光灯下。
并且随着今年3月FDA批准第一个PROTAC药物ARV-110进入I期临床,进一步点燃了业界的热情。PROTAC是什么?有怎样颠覆性的优势和挑战?我们一起来看看吧。
不寻常的合作
2013年,耶鲁大学Craig Crews教授创办了一家小型生物技术公司Arvinas。
2015年4月,制药巨头默沙东出资4.3亿美元与Arvinas达成战略合作。
2017年11月,另一巨头罗氏基因泰克加码至6.5亿美元与Arvinas合作。
紧接着3个月后的2018年1月,宇宙第一药厂辉瑞出手,豪掷8.3亿美元。
业界震动,路人侧目,啥情况?药企巨头齐聚Arvinas,是因为一致看好它的靶向蛋白降解平台——PROTAC。
从诺奖说起
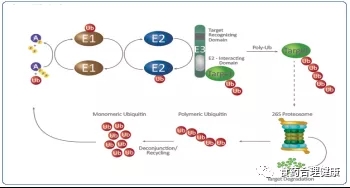
2004年诺贝尔化学奖颁发给了以色列科学家Aaron Ciechanover、Avram Hershko和美国科学家Irwin Rose,表彰其共同发现了细胞是如何清理异常蛋白质的,即泛素(Ubiquitin, Ub)调节的蛋白质降解过程。
简单来说,这个过程就像是细胞将不用的文件(异常蛋白质)交给秘书(E3酶)盖上作废章(泛素化),扔到碎纸机里(蛋白酶体)。
基于这个发现,就有学者开始琢磨:利用泛素介导蛋白降解机制,是否可以人为降解一些蛋白?
Raymond. Deshaies(美国两院院士)和Craig. Crews等人在2001年最早提出了PROTAC这个概念,并成功地设计和合成了第一批PROTAC双功能分子用于降解甲硫氨酰氨肽酶2(MetAP-2)。
Craig M. Crews
PROTAC是什么?
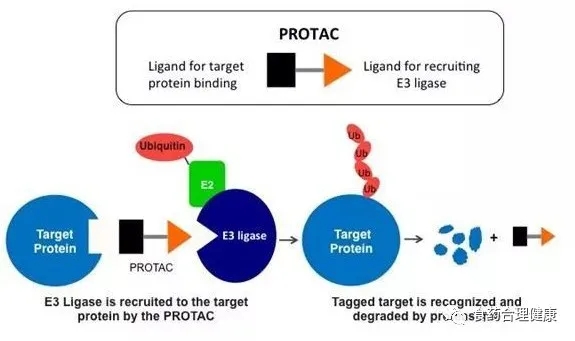
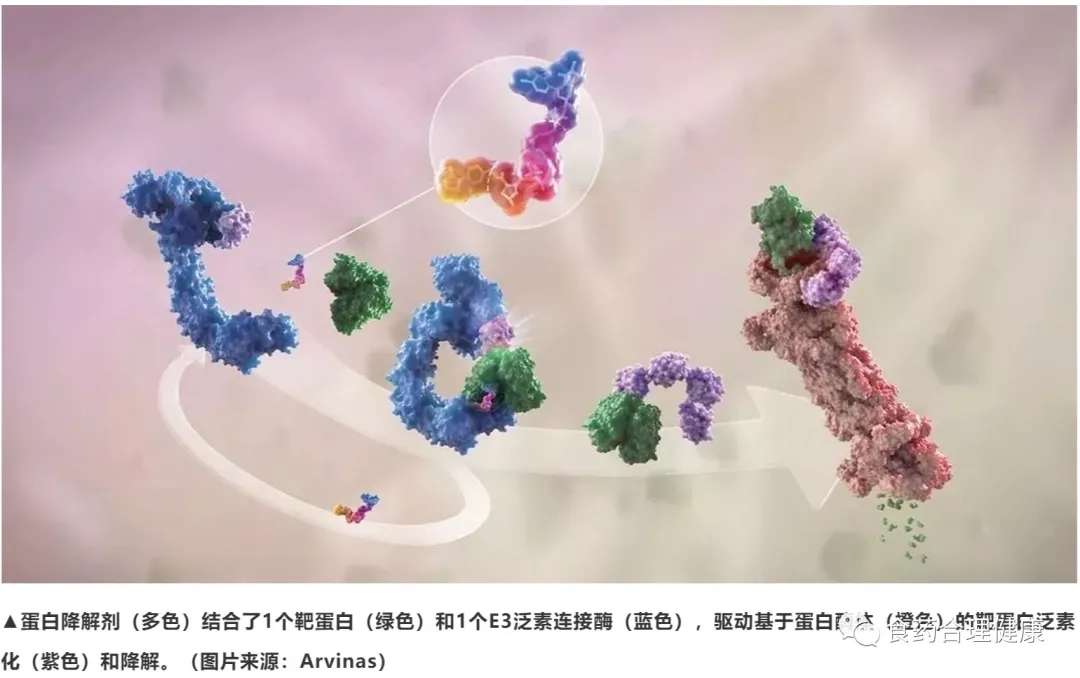
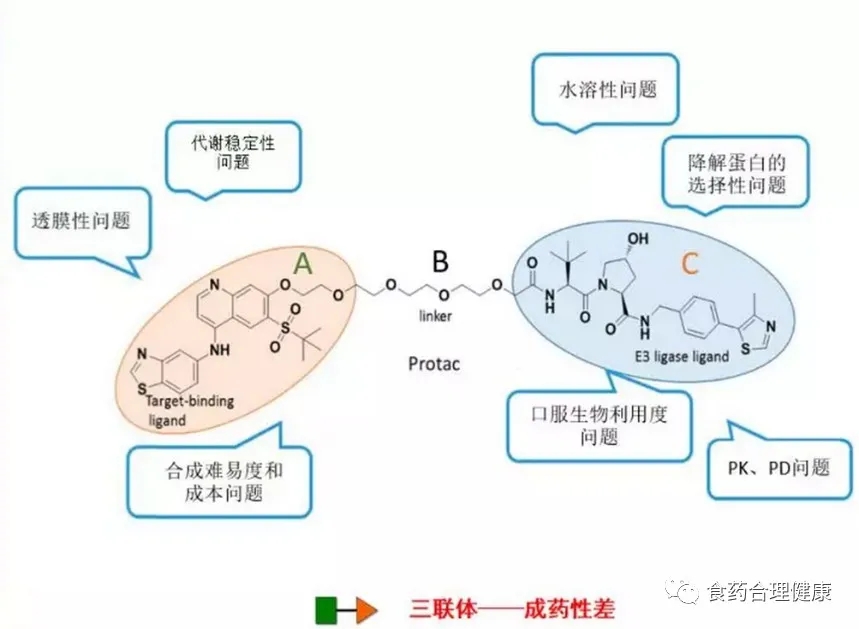
PROTAC是 PROteolysis TArgeting Chimera的缩写,蛋白降解靶向嵌合体,是一种双功能小分子,一端是结合靶蛋白的配体,另一端是结合E3泛素连接酶的配体,通过一段链条连接。在体内可以将靶蛋白和E3酶拉近,使靶蛋白被打上泛素标签,然后通过泛素—蛋白酶体途径降解。
这是一种全新的药物设计策略,通过设计这样的三联体小分子药物,理论上可以将任何过表达和突变的致病蛋白清除,从而治疗疾病。
在2015年小分子PROTACs引发热潮后,Deshaies博士曾发表过一个观点:PROTACs有潜力成为一种主要的新型药物,且可能会超越有史以来最热门的两个药物开发领域——蛋白激酶抑制剂和单克隆抗体。
PROTAC作用特性和优势
“事件驱动(event driven)”,而非“占位驱动 (occupancy driven)”
无论小分子抑制剂,还是大分子抗体,都需持续占据靶蛋白的活性位点以阻断功能,属于“占位驱动 (occupancy driven)”。
这就需要药物满足:足够大的剂量,使靶点饱和;足够长的半衰期,能持续抑制;足够高的亲和力,“抢得过原装(配体/受体)”。因此产生很多问题,如剂量大,毒副作用也大;亲和力太高,容易导致脱靶毒性;靶点突变/过表达,出现耐药。
而PROTAC的优势明显:
1、催化降解功能。
传统的小分子采用的药理学作用模式为占据驱动模式,为了提高靶点占有率,往往需要高剂量的药物,反而会带来很大的毒副作用。PROTAC采用的是事件驱动(event-driven)的药理学作用模式,其对目的蛋白的降解过程是一种催化作用,因此只需较低的化合物浓度便可以达到很好的降解效率。
2、选择性。
现代药物开发的一个关键目标是设计高选择性分子,降低药物毒性和副作用。PROTAC分子发挥催化作用时,可以选择性的作用于特定的靶蛋白。最近的多项研究表明, PROTAC对同源靶蛋白的选择性高于传统抑制剂。
3、作用靶点广。
泛素-蛋白酶体系统是细胞内蛋白质降解的主要途径,参与细胞内80%以上。E3泛素连接酶在多种细胞中广泛表达,PROTAC分子只需将靶蛋白与E3泛素连接酶拉近,再通过蛋白溶酶体降解靶蛋白。因此PROTAC技术可以广泛应用不同的靶点。
4、延长作用时间。
靶蛋白的降解是时间依赖性的,PROTAC可以在几分钟内将细胞内靶蛋白消耗到接近基础水平。一旦先前存在的蛋白耗尽,PROTAC只需要降解重新合成的靶蛋白,大多数蛋白质的再合成速度很慢,即使在PROTAC完全清除后,细胞可能仍需要一段相当长的时间,才能将蛋白质库恢复生理信号的水平,从而大大延长作用时间。虽然口服给药通常被认为是小分子药物的首选给药途径,但患者的依从性,特别是对于更慢性的疾病,可能非常差,严重限制了治疗效果。PROTAC可以通过多种途径提供,提供更多有吸引力的临床给药方式。
5、新的药理学作用模式。
许多蛋白靶点对药物研发提出了挑战,它们可能没有一个特定的催化活性位点,需要依赖于更大的蛋白质界面来介导信号,或者蛋白质可能具有多个功能和催化结构域。识别高亲和力抑制剂对于这些靶点来说几乎是一个不可能的事件,但是PROTAC技术可以提供一种解决方案,因为只需要粘合剂(与传统抑制剂相反)来促进E3连接酶的募集和降解级联的启动。PROTAC的另一个优势是其表型基因敲除的能力,利用PROTAC可以作为研究靶基因功能序列丢失的有力补充手段。
更为重要的是,由于PROTAC只是提供结合活性,触发靶蛋白与E3酶结合从而引发降解这一事件,属于“事件驱动(event driven)”,不需要直接抑制目标蛋白的功能活性,药物不需要与目标蛋白长时间和高强度的结合,因此可以靶向传统难以成药的蛋白(undruggable target)。
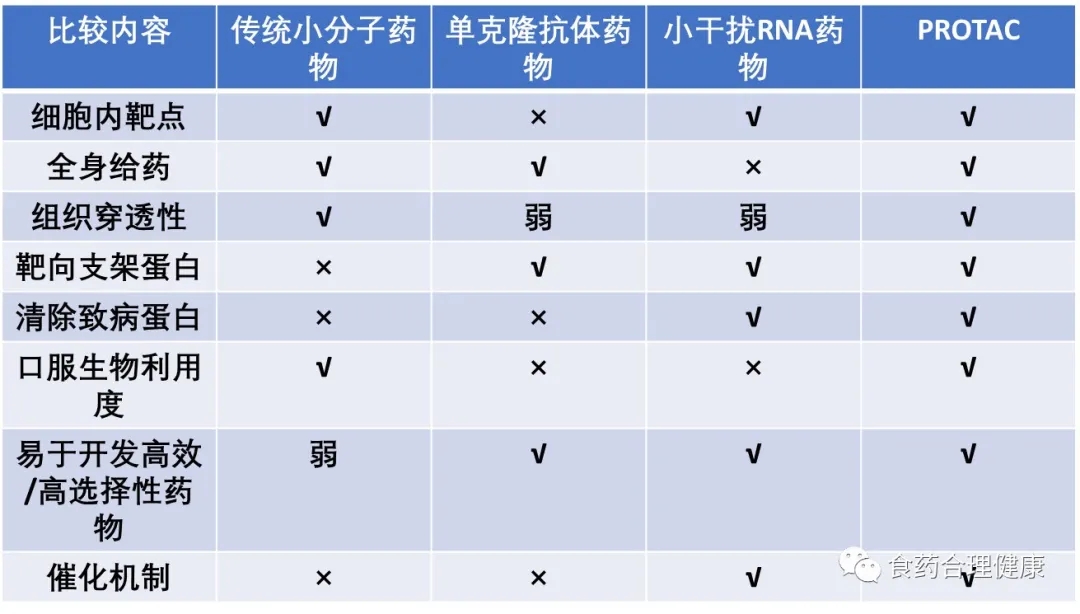
与传统小分子、单抗、核酸三大类药物相比,PROTAC可以说是集众家所长于一身:
PROTAC重新定义小分子药物
PROTAC对药物研发的重大意义,不仅体现在它是一项新技术,更是它打破了人们原有的一些理念,重新定义了小分子药物。
传统药物发现策略的局限性
传统药物设计常常专注于优化药物结合亲和力,但往往限制了更多高效药物的发现,因为识别一种高效能和高选择性的药物来调节一个生物靶点并不总是那么简单,面对越来越多缺乏高亲和力配体结合位点的药物干预靶点的发现,传统的小分子成药技术显得无计可施。
越来越多的方法被用来规避这些限制,单克隆抗体和其他蛋白制剂虽然具有高亲和力和选择性的优势,但这些制剂目前只能应用于细胞外或细胞表面靶点,而大多数基因组蛋白质和当代药物靶点是在细胞内发挥作用。通过基因沉默或RNA抑制剂作用于靶点,虽然在临床前是非常有效的,但必需的寡核苷酸制剂本身也存在着多项挑战(细胞传递、稳定性、生物分布、选择性等),必须克服这些挑战才能开发出成功的药物。
PROTAC违反了药物化学领域的信条:
尽管五原则后来也进行了修改,去掉了氢键受体数目和可旋转键数量的限制,但是对三联体的PROTAC而言,无论从分子量上还是复杂性上都违背了小分子成药原则。
药效学与药代动力学分离。
由于PROTAC分子更像是催化剂,结合-触发(催化)-脱离,因此短暂暴露即会对蛋白通路产生持续影响,意味着药效与药代动力学不同步。
在药物的结合能力,特异性和剂量等概念上与传统观念也出现了偏离。
对PROTAC的衡量标准不是它们与蛋白的结合有多紧密,而是能够以多快的速度将各个蛋白连接起来,让靶蛋白能够被泛素标记并且运送到蛋白酶体中。
颠覆,同时也意味着挑战
正如再高强的武功也有其命门,PROTAC 技术当然也有其硬伤,这类药物是双靶点药物所以分子量、分子刚性、水溶性都不甚理想,所以口服吸收和过膜性都会较差,PROTAC 分子通常很大,PK 是一个主要障碍。虽然现在已有体内活性 PROTAC 化合物的报道,甚至今年就会进入人体临床研究。但总体而言,PK 仍旧是多数 PROTAC 小分子成药的主要障碍。化学合成也要困难得多。
从2001年提出至今,PROTAC成药之路并不顺利,最开始Craig Crews试图用多肽做,但因其穿透细胞活性和半衰期都很差,最终在2008年放弃多肽转向小分子,然而小分子同样面临诸多挑战:
1.三联体成药性
由于是三部分组成的类似哑铃形分子,其水溶性、口服生物利用度、代谢稳定性、透膜性、合成难度和成本、PK/PD等等,依然是需要逐一克服的难题。
2.如何有效形成三元复合物,并有效激活降解系统
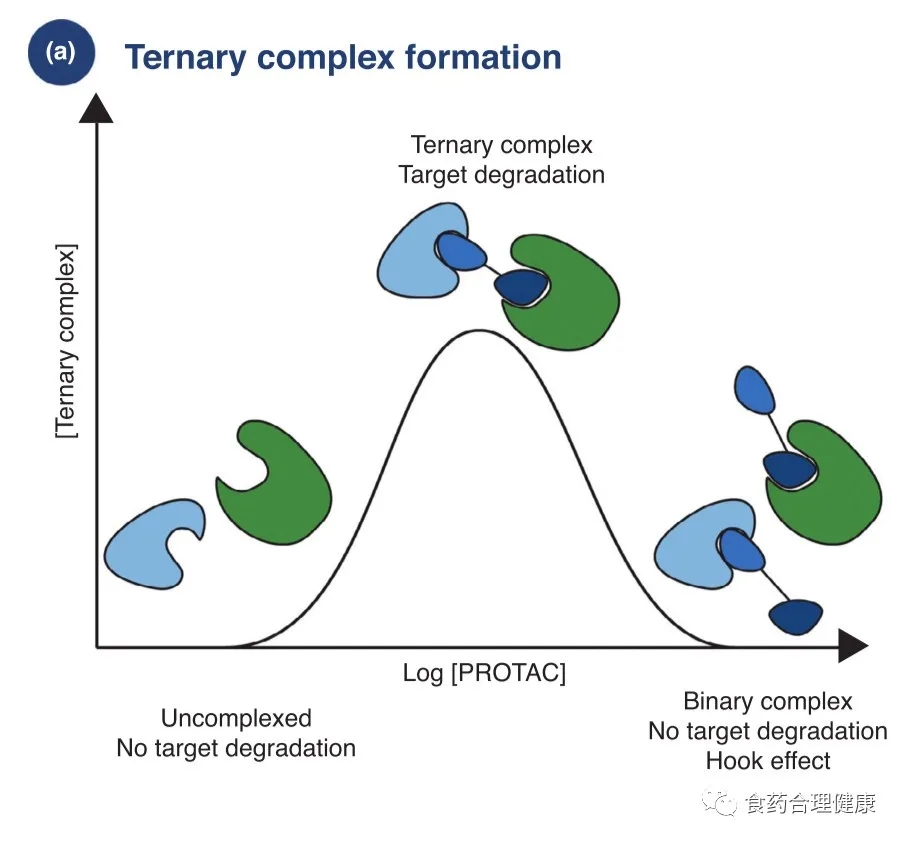
PROTAC发挥药效必须与靶蛋白和E3酶形成有效的三元复合物,而此过程对PROTAC来说,如何控制浓度以避免药物分子与靶蛋白和E3酶分别形成二元复合物(钩子效应,hook effect),以及充分考虑靶蛋白与E3酶接触区域的电荷排斥和立体结构排斥,显得非常重要。
而当三元复合物形成后,能否有效降解,还需要与去泛素化酶以及靶蛋白重合成作斗争,直到达成一定程度的平衡。
3.脱靶毒性及其检测,尤其长毒和生殖毒
PROTAC 作为更为彻底靶标蛋白降解者,可能会误伤到其它脱靶蛋白,即使是以前验证过的靶点,会不会带来更为严重的毒性,需要在未来的临床实验中密切监测。另一个隐患是降解的脱靶效应在临床前毒性筛选中不易检测、跟踪,增加了药物后期开发中的风险。
PROTAC国内外主要玩家
回顾PROTAC技术20年的发展历史,有很多学者做出了重要贡献,一些里程碑事件助力了PROTAC技术的发展,接下来将简述下PROTAC技术的发展历程。人工诱导蛋白质降解的最早报道之一是在1995年设计了一系列与Ig结合基序融合的修饰E2结合酶(如TaUBC4),首次表明人工诱导的泛素化特征可被诱导降解的蛋白酶体识别。
2001年, Deshaies和Crews实验室利用了含SCFβ-TRCP的E3诱导了MetAp-2的降解,首次引入了靶向嵌合蛋白水解(PROTAC)一词。这篇早期开创性论文选择了一种卵白蛋白衍生物,它通过共价相互作用与Met-AP2结合。这种对共价键的依赖阻止了PROTAC的独特优点之一,即其催化作用(见下文),潜在地限制了所观察到的降解效率。在接下来的几年里, PROTAC发展到能够降解诸如雌激素受体(ER)和雄激素受体(AR)等靶点,由于早期的PROTAC分子多为小肽,细胞渗透性比较差,细胞活性也较低,无法应用到药物的开发中。
直到2008年,Crews课题组首次报道了小分子PROTAC-nutlin,典型的小分子PROTAC结构如图4所示,作用机制如图5所示。Nutlin通过与E3连接酶Mdm2结合,诱导雄激素受体(AR)的降解,但其细胞活性仍不理想,在10μM浓度下才诱导AR降解,与此同时,尽管从所报道的有数据来看,降解是蛋白酶体依赖性的,但考虑到许多AR配体可以自发地破坏其同源受体的稳定性,引起自身泛素化和降解。因此,其在药物发现的应用仍然有限。
Craig Crews无疑是该领域的先驱,研究积累最为深厚,其2013年创办的Arvinas也是目前进展最快的公司,用于治疗前列腺癌的雄激素受体(AR)降解剂ARV-110,现已进入Ⅰ期临床试验,后续还有针对雌激素受体ER和针对τ蛋白的降解剂。
除Arvinas外,包括诺华在内的其它公司也有一些同类分子已经接近临床试验,如Kymera公司靶向IRAK4的蛋白降解剂预计在明年上半年开展临床试验。
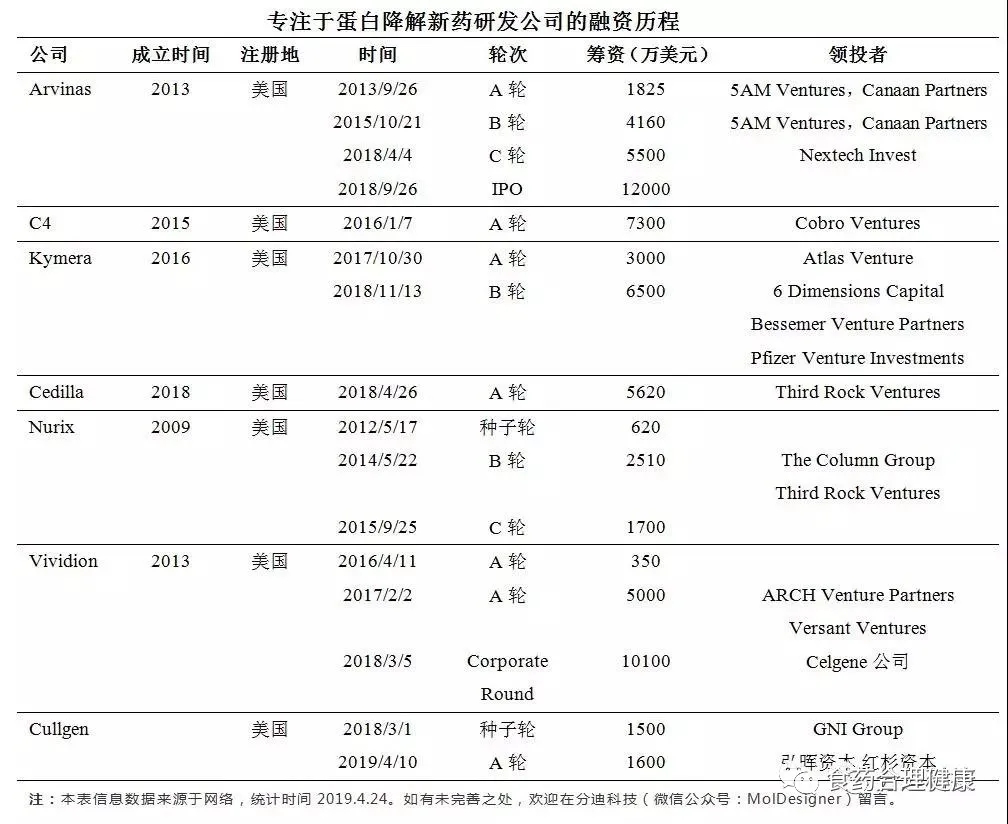
该领域其他bio-tech公司还有C4 therapeutics、Captor therapeutics、nutrix、Cellida、Vividion、cullgen(睿因科技)等,这些公司几乎都受到资本市场的追捧:
另外大部分跨国药企都有布局,除文章开头提到的辉瑞、默沙东、基因泰克外,还有阿斯利康、勃林格殷格翰、葛兰素史克、新基、安进、礼来、吉利德、艾伯维、强生……
华人研究者
虽然泛素蛋白酶系统和PROTAC都发端于欧美,但令人欣喜的是,华人学者在相关领域的研究和开发也并不逊色,包括但不限于:密歇根大学王少萌教授、北卡大学熊跃教授、西奈山伊坎医学院金坚教授、清华大学饶燏教授、复旦大学鲁伯埙教授、中国药大姜正羽教授、上科大仓勇教授、杨小宝教授等等。
同样在产业界,有研发实力的药企或多或少都有布局,而新兴bio-tech公司也不断涌现……
随着时间慢慢推移,近几年来PROTAC技术进入前所未有的发展阶段。科学家们逐渐看到了该技术绝对的优势,不仅可以让非药物靶点(undruggable)转变为可行的药物靶点(druggable),还能化解现有靶点耐药性的问题。或许新型抗肿瘤重磅药物已悄然来临。
2018年6月6日,清华大学药学院饶燏教授及其团队在《Cell Research》杂志上发表了一篇论文在体外实验中证实:针对B细胞恶性肿瘤临床一线药物依鲁替尼(全球首个获批上市的BTK抑制剂) 的耐药性,可借助PROTAC技术通过 BTK蛋白降解剂靶向降解C481S突变的BTK蛋白来有效克服。
展望PROTAC技术的未来
PROTAC技术为新药研发打开了新篇章,也给学术界和工业界带了前所未有的机遇。当然,PROTAC作为一种新兴的技术,必然也会面临很多问题和挑战,只有克服了这些困难,PROTAC技术才能更好的发展。
据估计仅有 10% 的蛋白能用小分子调控,10% 能用生物大分子调控的蛋白在细胞表面,而高达 80% 的蛋白无法用现有药物调控。靶向蛋白降解最有吸引力的地方在于它可以针对那些传统上认为不可成药的蛋白靶点,这些蛋白可能占了人类蛋白质组的 80% 以上。由于靶向蛋白降解策略可以通过结合蛋白上的几乎任何一个位点,而不是活性位点,来达到选择性的降解蛋白的目的,因此理论上这个策略可以用于任何一个蛋白质。此外,这个策略的另一个优势是可以对那些已经产生抗药性的肿瘤发挥作用。而且靶向蛋白降解在除了癌症以外的其它疾病领域中也具有相当的潜力。PROTAC 小分子研究最近的突破还主要集中在可靶向的靶点上。而它的未来最大潜力之一是要靶向传统意义上不可靶向的靶点,比如转录因子、蛋白的骨架功能等,或是不可成药的靶点之王 KRAS 突变。
但迄今为止,只有一小部分被证明适合于PROTAC的开发,为了进一步发展PROTAC技术,未来需要努力确定其他可利用的E3泛素连接酶。设计更有效的PROTAC的另一个关键方面在于连接体Linker,连接体的长度和连接点都可能会影响选择性和降解效率。同时为了简化并加速PROTAC分子的发现,需要建立可靠的PROTAC技术平台。随着PROTAC分子进入临床试验研究,PROTAC技术未来的发展空间是毋容置疑的。
诺华的研发总监 J Bradner 说现在他们已经成功降解了 30 多个蛋白,他认为将来几乎所有蛋白都可能被 PROTAC 降解,而今年 Arvinas 公司今年即将会把一个雄激素受体和一个雌激素受体 PROTAC 推进临床。
基于泛素 - 蛋白酶体系统的新药开发,代表着一个方兴未艾的热门研究领域,吸引了多家跨国药企、学术机构和投资机构的青睐。大量风投资金的涌入和大型医药公司的合作参与将帮助加速 PROTAC 技术发展完善以及相关药物研发的进程。基因泰克、辉瑞、Atlas、诺华(NIBR)、UC Berkeley 等都已纷纷进军该领域,并催生了一批与此相关的生物技术新锐公司,除上面提及的公司外,如 Vividion Therapeutics、Warp Drive Bio 以及刚刚成立的 Cullgen 公司都有各自独特的基于化学蛋白质组学(Chemical Proteomics)的小分子药物研发平台。这些都预示着小分子药物研发蛋白降解时代可能已经悄悄来临。