肿瘤免疫治疗产生耐药性的原因
近年来,随着研究的不断深入,科学界和制药工业界纷纷把目光转向免疫疗法,探索通过增强患者免疫系统的活性来治愈肿瘤的可能性,然而如何解决肿瘤对免疫治疗的低应答率仍然是目前亟待解决的难题。这篇文章对肿瘤抵抗免疫治疗的机制进行简单的探讨。
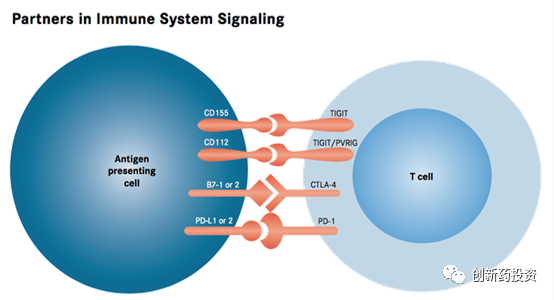
免疫检查点阻断如PD-1/PD-L1、CTLA4等靶点阻断是近年来得到快速发展的一种疗法。生物体内的免疫系统受到多种因素的调节,其中免疫检查点是一种免疫系统的负向调节机制,它在限制免疫系统的活性、避免免疫系统过度激活等方面发挥了重要作用。然而肿瘤组织会通过多种手段,来利用免疫系统的这种负向调节机制抑制免疫系统对抗肿瘤的活性从而逃脱免疫系统的免疫监视和杀伤。免疫检查点阻断就是通过一些特异性的药物(通常为单克隆抗体)来阻断这种肿瘤细胞负向调节免疫系统活性的过程,从而重新激活免疫系统的活性:
然而到目前为止,在临床实践中仍然有相当一部分的患者对免疫检查点阻断无应答。由于我们对肿瘤免疫反应的机制上的研究还不甚透彻,因此在很多时候对这种不响应免疫治疗的患者往往束手无策。下面就对肿瘤抵抗免疫治疗的机制进行简单的探讨。
01
肿瘤抵抗免疫治疗的能力很大程度上由肿瘤细胞本身的性质决定
肿瘤抵抗免疫治疗的能力与诸多因素相关,如患者自身的特质(如性别/HLA分型)、肿瘤基质的特性、肿瘤环境因素(如患者自身的微生物组)等,然而其中最重要的当属肿瘤细胞自身的因素(tumour cell intrinsic factors)。肿瘤细胞自身的因素指的是由肿瘤细胞的基因组、转录组等性质所决定的肿瘤抵抗免疫治疗的能力,包括:
-
肿瘤细胞的抗原性:抗原性较弱的肿瘤细胞将难以被免疫系统识别
-
肿瘤细胞IFN-γ信号通路的活性:干扰素-γ信号通路在调控PD-L1的表达、MHC相关的抗原呈递等过程中发挥重要的功能
-
肿瘤下调MHC蛋白的表达:MHC蛋白表达的下调将会导致肿瘤细胞抗原呈递能力的减弱
-
肿瘤相关的信号通路的活性:其中比较重要的是WNT–β-catenin信号通路、CDK4–CDK6信号通路、MAPK信号通路、PTEN蛋白丢失等。
下面依次对上述4种因素进行简要的讨论。
抗原性较低的肿瘤细胞抵抗免疫治疗能力较强
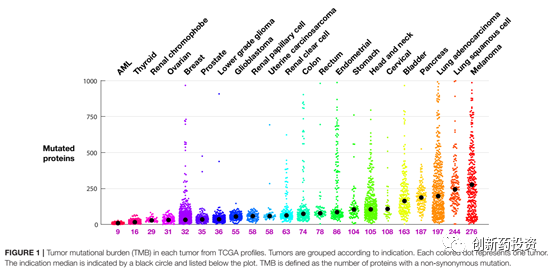
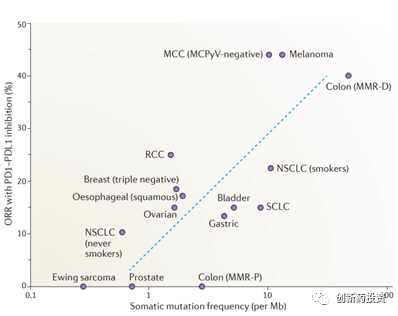
免疫系统主要依靠肿瘤细胞表面的抗原来特异性识别肿瘤细胞。那么,什么样的抗原能够将肿瘤细胞与正常细胞区分开呢?目前的研究认为,一类被称作肿瘤新生抗原(tumor neoantigens)的抗原发挥了这种功能。肿瘤新生抗原主要由基因突变产生,突变的基因翻译成蛋白并经过MHC的抗原呈递到达细胞膜形成肿瘤新生抗原。不同的肿瘤细胞内部的基因突变含量不同,肿瘤突变负荷(tumor mutational burden,TMB)便是用来衡量基因突变含量多少的一个指标。TMB较高的肿瘤,如黑色素瘤(如下图所示),对于免疫治疗的应答相对较高。除此之外,微卫星不稳定性(microsatellite instability,MSI)也可以反映肿瘤抗原性的高低。MSI反映了肿瘤细胞DNA错配修复能力,错配修复能力较弱的肿瘤细胞不仅MSI水平较高,也会在基因组上引入较多的突变从而增加其抗原性。
IFN-γ信号通路失活将导致免疫治疗无应答
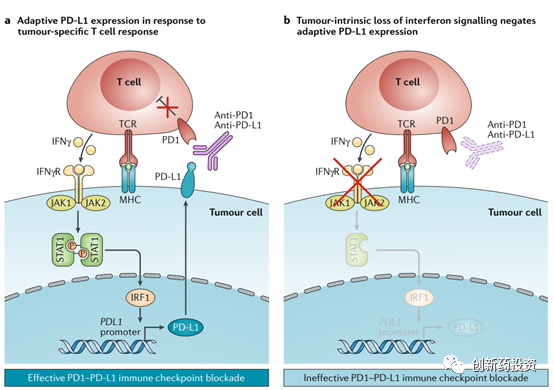
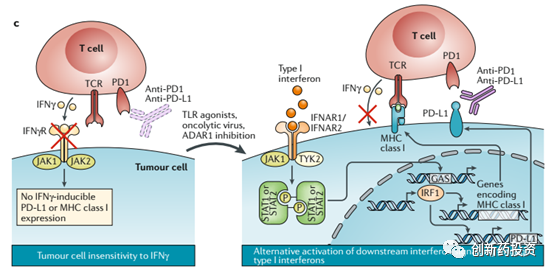
释放IFN-γ到肿瘤微环境中来杀伤肿瘤细胞是T细胞杀伤肿瘤细胞的重要手段,然而肿瘤细胞内部也存在着对抗这种IFN-γ杀伤的信号机制:IFN-γ与肿瘤细胞表面的受体(IFNγR)结合可以激活肿瘤细胞内部的JAK-STAT信号通路,并后续激活IRF1从而上调PD-L1的表达水平,而PD-L1水平的上升会对T细胞的活性产生抑制并因此而对抗T细胞的进攻(下图a)。在这种情况下,采用PD-1或PD-L1单抗治疗能够将T细胞从PD-L1的抑制状态中解救出来并恢复其功能。然而,许多肿瘤细胞的JAK1、JAK2等基因往往会发生突变,这会导致上述信号通路的失活(下图b),因此对这样存在着JAK1、JAK2等基因突变的肿瘤细胞进行PD-1、PD-L1单抗治疗,其效果将会大打折扣(毕竟这些肿瘤细胞并不依靠PD-L1来抑制T细胞的活性)。
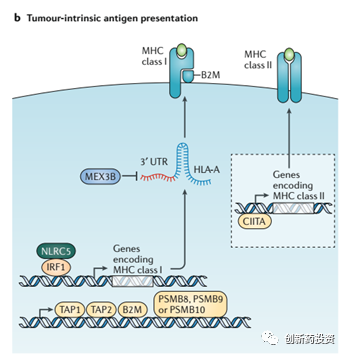
肿瘤细胞通过下调MHC逃脱免疫监视
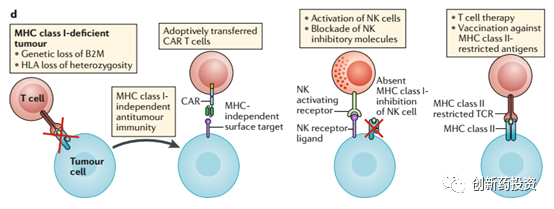
MHC分子是细胞表面负责抗原呈递的主要分子。人类细胞中MHC主要有MHC I和MHC II两类,而在肿瘤细胞表面表达的主要是MHC I类型的MHC蛋白。如下图所示,MHC蛋白的表达和发挥功能需要IRF1、TAP1、TAP2、B2M、PSMB8、PSMB9、PSMB10等诸多蛋白的协同作用。其中任何环节的功能缺失都会导致MHC蛋白的功能受损,从而导致肿瘤细胞表面抗原呈递能力的下降。例如,有研究表明,在免疫检查点抑制剂治疗之后复发的肿瘤组织中检测到了B2M基因发生了突变。
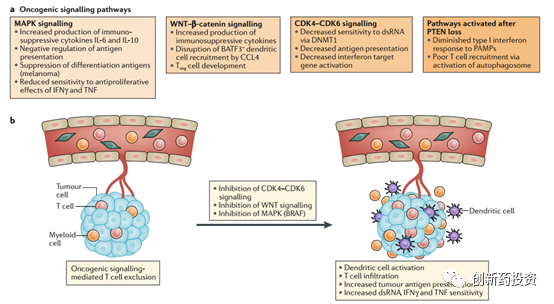
肿瘤细胞通过MAPK、WNT、CDK4/6、PTEN等信号通路获得免疫耐受
肿瘤细胞通过多种信号通路来获得对免疫治疗的耐受,其中最主要的信号通路为以下四种:
-
WNT–β-catenin signalling:WNT家族蛋白与细胞膜表面的受体结合并导致β-catenin的亚细胞定位发生变化以及下游靶基因的激活。WNT–β-catenin信号通路在细胞水平上发挥着多种功能,有证据显示,WNT信号通路在肿瘤的发生发展过程中也发挥着重要功能。例如,WNT–β-catenin信号通路激活的黑色素瘤中T细胞浸润水平较低,这反应了WNT–β-catenin信号通路能够增强肿瘤对抗免疫系统的功能。
-
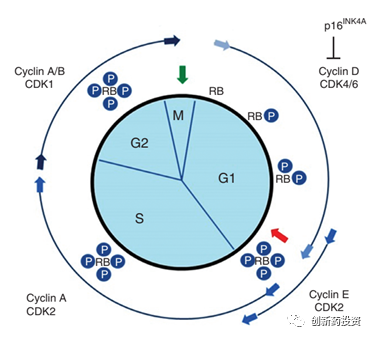
CDK4/6和细胞周期:CDK4和CDK6是调控细胞周期的重要蛋白,在细胞周期由G1期进入M期的过程中扮演了主要角色(如下图所示)。自从第一个CDK4/6抑制剂palbociclib上市以来,有越来越多的研究证实CDK4/6在调控肿瘤细胞的免疫逃逸方面具有不可或缺的功能。有研究证实,CDK4/6的抑制剂与PD-L1单抗联合用药可以有效抑制肿瘤的生长并远超单独用药的效果。
-
MAPK信号通路:MAPK信号通路主要通过上调肿瘤细胞IL-6、IL-10等细胞因子的释放来抑制肿瘤微环境中免疫细胞的活性。例如,MAPK家族重要成员之一BRAF的激活突变V600E会导致肿瘤细胞耐药性的上升,而BRAF突变的抑制剂Vemurafenib则可以有效增加T细胞对肿瘤细胞的杀伤。
-
PTEN蛋白的失活:PTEN蛋白的肿瘤抑制功能于20世纪末发现,研究证实PTEN蛋白的失活突变能够增强肿瘤细胞对细胞毒性T细胞的抵抗能力。此外,PTEN的表达量与PD-1疗法的响应水平正相关,PTEN表达量高的肿瘤组织中能够监测到含量更多的肿瘤浸润淋巴细胞(TILs)。PTEN还可以上调I型干扰素信号通路。这些证据都表明PTEN失活是肿瘤细胞对免疫治疗耐受的重要因素。
02
如何增加肿瘤细胞对免疫治疗的应答?
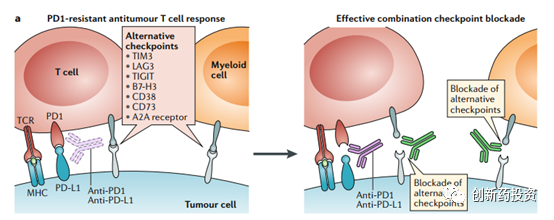
如何增加肿瘤细胞对免疫治疗的应答?一个最直观的解决方案就是采用多种免疫检查点抑制剂联合用药。已有大量数据显示,CTLA-4与PD-1/L1抑制剂联合用药可以获得较为理想的免疫应答。除了CTLA-4与PD-1/L1之外,LAG3,VISTA, TIM3等靶点的免疫治疗药物也在紧锣密鼓的研发之中。不同的免疫检查点下游信号通路不同,联合用药将能有效解决耐药问题。
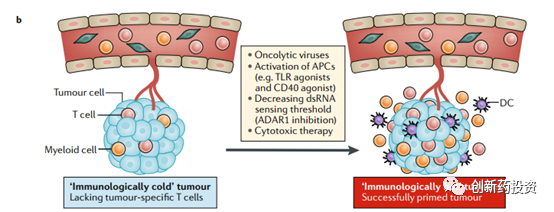
但仅管如此,目前仍然有一些肿瘤对于免疫检查点阻断的应答率极低,在这些肿瘤中即使是联合用药也难以收获理想的结果(我们称这样的肿瘤为冷肿瘤cold tumor)。对于这样的病人,我们需要先采用一些手段 “启动”(prime)免疫反应,在免疫反应成功“启动”之后再用免疫检查点抑制剂来增强(enhance)T细胞的功能从而将cold tumor转化为hot tumor是较为可行的技术路线。比如,可以通过溶瘤病毒裂解肿瘤细胞释放抗原、通过TLR、CD40的激动剂来激活抗原呈递细胞、通过激活肿瘤细胞对dsRNA的敏感程度来增加肿瘤细胞的抗原性:
除了上述手段以外,采用一些先天性免疫激活剂(agonists of innate immune sensors)来增加肿瘤细胞的抗原性也是可行方案之一。例如可以利用type I interferon的激动剂来激活肿瘤细胞的抗原提呈过程,这种手段尤其适合IFN-γ信号通路失活的肿瘤细胞(原因上面已经提到):
我们已经知道,肿瘤细胞可以通过下调MHC的表达来减少细胞表面抗原的呈递来逃脱免疫监视。过继细胞疗法如CAR-T和CAR-NK疗法可以不依赖于MHC对肿瘤细胞进行杀伤,从而可以有效对抗免疫耐受的肿瘤细胞(如下图所示)。这方面的内容因篇幅所限这里不再赘述,有时间的话我会写一篇文章对CAR-T和CAR-NK疗法进行详细讨论:
03
总结
近年来,随着研究的不断深入,科学界和制药工业界纷纷把目光转向免疫疗法,探索通过增强患者免疫系统的活性来治愈肿瘤的可能性,然而如何解决肿瘤对免疫治疗的低应答率仍然是目前亟待解决的难题。本篇文章就肿瘤细胞对免疫治疗产生耐受的原因和分子机制进行了简单的探讨,肿瘤内部多种信号通路在逃脱免疫监视和免疫细胞杀伤等方面发挥了重要功能,对肿瘤发生和发展过程中分子机制的研究仍然是当下基础研究的重点。相信随着生命科学领域研究的不断深入,以及肿瘤耐药机制的进一步阐明,肿瘤免疫治疗之路上的难题会被逐步攻克。
参考资料
Kalbasi A, Ribas A. Tumour-intrinsic resistanceto immune checkpoint blockade[J]. Nature Reviews Immunology, 2019: 1-15.
Sherr C J, Beach D, Shapiro G I. Targeting CDK4and CDK6: from discovery to therapy[J]. Cancer discovery, 2016, 6(4): 353-367.
Yarchoan M, Johnson III B A, Lutz E R, et al.Targeting neoantigens to augment antitumour immunity[J]. Nature Reviews Cancer,2017, 17(4): 209.
Castle J C. Mutation-derived neoantigens forcancer immunotherapy[J]. Frontiers in immunology, 2019, 10: 1856.