个性化CAR-T疗法的商业化困局
上周,CAR-T疗法传来了一条让人欣喜的消息。9月9日,国家药监局药品审评中心(CDE)公示,拟将上海药明巨诺生物科技有限公司的瑞基仑赛注射液(研发代码JWCAR029)上市申请纳入优先审评。目前,中国尚未有产品获批上市,瑞基仑赛的优先审批无疑会让制药人对CAR-T疗法的商业化抱有些许期待。不过,CAR-T疗法商业化并不顺畅,最早2017年上市的两款CAR-T产品的销售额也远未达到预期。
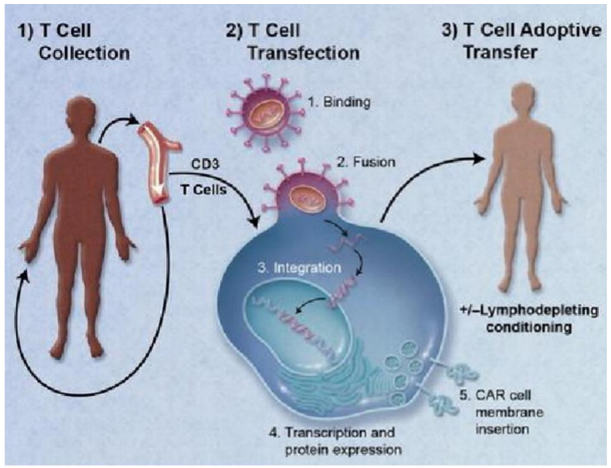
CAR-T(ChimericantigenreceptorTcell,嵌合抗原受体T细胞)是一种极为个性化的治疗,需要分离患者体内的T细胞并在体外进行特定肿瘤抗体的修饰,经过扩增后再回输至患者体内。这种个性化让CAR-T疗法的优势突出,如显著疗效、无耐药性等,但也正是因为该疗法的“个性化”,CAR-T疗法在从实验室到商业化的路上寸步难行。
△图1.CAR-T疗法原理
价格高昂
除了以上情况, “因人而异”带来的另一个问题是不可避免的成本飙升,而飙升的成本最终还是要落到患者身上。为了避免移植免疫排斥,每个新患者都需要重新制备一次T细胞,从而导致该方法成本昂贵。比如诺华的Kymriah售价为475000美元,Gilead的Yescarta售价为373000美元),这样的费用对于普通患者来说确实是难以承担。
为了解决CAR-T疗法价格较高的问题,有些企业尝试着开发通用型CAR-T疗法,即从健康人体内提取分离T细胞,进行基因改造,使其既能规避移植后的免疫排斥反应,又能发挥既定的抗癌作用。使用该技术可以一次性制备、储存大量的CAR-T细胞,当有患者需要CAR-T细胞的时候,可以“随取随用”。但这样的尝试似乎不算顺利,Juno的JCAR015、Kite Pharma的KTE-C19,以及Cellectis的UCART123都分别出现过患者在治疗过程中死亡的事件。
标准化之困
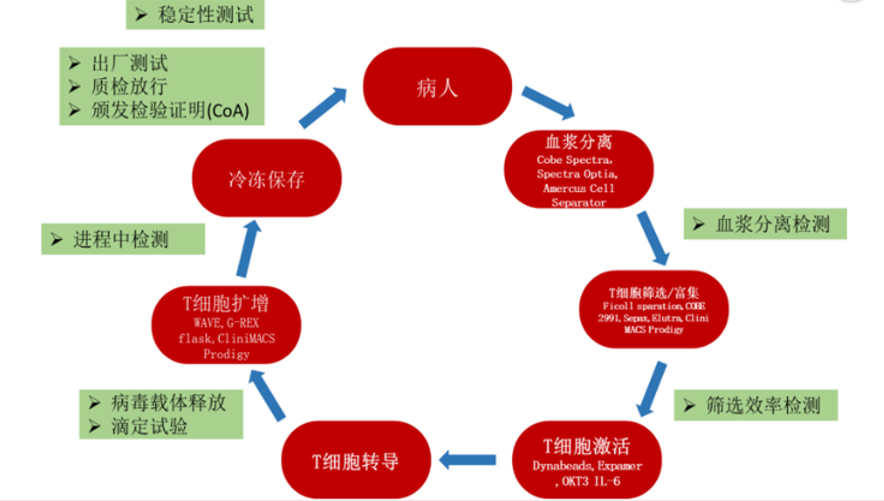
难以控制的高成本背后其实是难以形成的标准化工作流程。个体化差异导致 T 细胞的备置周期不同,这种情况下,极难形成标准化的工作流程,而标准化工作流程是医疗产品商业化中控制成本极其重要的一环。目前,工业界仍没有开发出一个成熟的,完全可被接受的Car-T生产工艺过程,许多Car-T产品都在使用人工操作,非常耗时耗力,且难以扩大,失败率较高(成功率最高的吉利德在ZUMA-1中也有近10%)。
△图2.Car-T制备流程
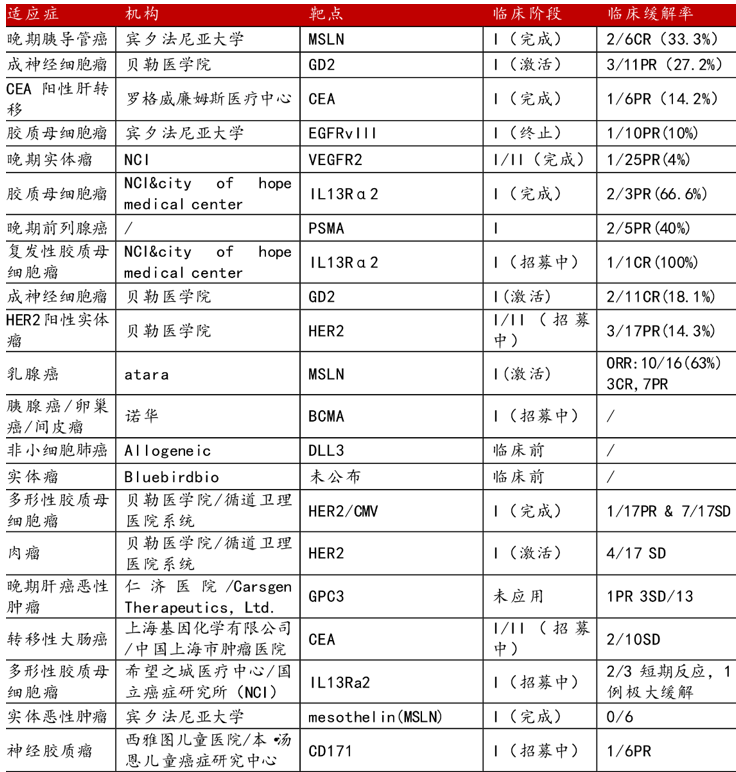
当然,即使CAR-T疗法上市困难重重,也并非做不到,但上市后如何挣到让人满意的销售额又是另一个问题。尽管Car-T已经获批了以B细胞上CD19为靶点的DLBCL、PMBCL以及ALL在内三个适应症,但市场上对Car-T主要的担忧在于其靶点较少(多集中于CD19、BCMA)、适应症较少,市场受限。尤其是在约占了所有人恶性肿瘤90%的实体瘤领域,CAR-T疗法深受靶点选择之困。
△表3. Car-T部分实体瘤进展情况,数据来源:clinicaltrials,财通证券研究所
结语
即使困难重重,也不可否认CAR-T疗法的潜在价值。作为抗肿瘤治疗的前沿技术应用,CAR-T产品仍然有不断升级并扩大适应症的预期。此外,技术的进步也在推动着CAR-T产品安全性和耐受性提高,提升临床应用的前景。在目前,国内开展的CAR-T临床试验数量已经多达23项,仅次于美国,这也是中国首次在新药研发领域走到国际前列。对于新药研发刚刚起步的中国而言,或许有弯道超车的可能。