Nature子刊:基于微流控芯片的MagRC技术,实现循环肿瘤细胞分类
从病人血液中进行循环肿瘤细胞(Circulating tumor cells, CTCs)的分离与分析,可以实现非侵入性的“液体活检”(Liquid biopsy),这对于癌症的早期诊断和预后评估具有非常重要的临床诊断价值。CTCs是从实体瘤脱落,发生上皮—间质转化进入到血液循环的恶性肿瘤细胞。由于外周血中CTCs数量稀少(十亿个血细胞中仅含有1~10个CTCs),且具有高度异质性和易聚集成团等特点,因而CTCs研究的关键在于从含有大量血细胞的复杂血液样本中准确地将其分离出来,且要满足高纯度、高捕获率和高通量三个要求。
外周血中的CTCs。图片来源:Penn State University
作为目前唯一通过FDA认证的CTCs分离与计数系统,CellSearch,是采用外面包被了特异性抗体抗EpCAM(上皮细胞粘附因子)的免疫磁珠,通过抗原抗体作用,与血液中表达EpCAM的CTCs结合,并进一步通过荧光反应识别。虽然该技术有较高的灵敏度,但其仍存在着一些缺点,如未实现全自动分选、假阳性比率高、预处理环节损失大量目标细胞,以及富集后的CTCs没有生物活性等。

Edward Sargent教授(左)与Shana Kelley教授(右)。图片来源:University of Toronto
日前,来自于多伦多大学的Edward Sargent教授与Shana Kelley教授共同合作,发明了一种基于微流控芯片的被称为MagRC(Magnetic ranking cytometry)的技术,能够区分出全血细胞中的CTCs,并对异质性的CTCs进行分类。该技术的灵敏度能达到单个细胞的检测,且能追踪肿瘤生长程度不同的小鼠内CTCs表面的动态显型。这种方法与市场上的黄金标准结果相一致,但需要的细胞数量更少,且不受大量血细胞的影响。相关研究成果已发表于Nature Nanotechnology杂志上。
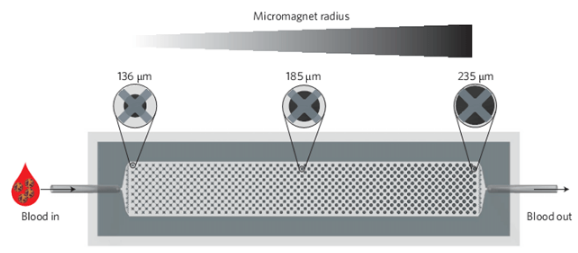
MagRC技术示意图。图片来源:Nat. Nanotech.
研究人员所发明的MagRC技术是利用免疫磁性分离法,依据CTCs表面标记物的表达量来进行分类。他们首先将血液样品与抗体修饰的磁性纳米粒子相孵育,使CTCs表面特异性地结合上磁性纳米粒子。CTCs表面标志物表达量越多,结合的纳米粒子也就越多。接着,将样品注入到微流控装置中,该装置内从左到右有不同半径的微型磁体,以此产生一个磁场梯度。结合有较多纳米粒子的CTCs在低磁场强度的区域内即可被捕获,而结合较少纳米粒子的CTCs会在高磁场强度的区域内被捕获,再通过免疫荧光使捕获的CTCs可视化,最终实现对CTCs的分类。
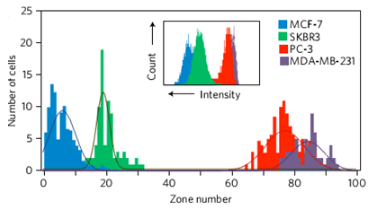
四种不同标志物表达的细胞在芯片上的分布。图片来源:Nat. Nanotech.
首先,研究人员利用MagRC技术对四种已知的标记物表达量不同的细胞进行了检测,证实该技术能准确且灵敏地将四种细胞进行分类。
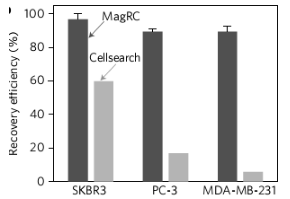
MagRC技术与商业化的CellRearch技术相对比。图片来源:Nat. Nanotech.
研究人员接着利用此技术对未经处理的全血中的癌细胞进行检测,并与商业化的CellRearch技术相比较。结果发现,MagRC技术在全血样品中依然保持有较高灵敏度,相比而言,CellRearch的效率在检测低表达量标志物的癌细胞时会受到极大的影响。
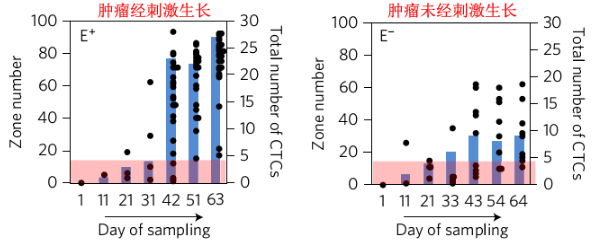
MagRC技术用于追踪CTCs的动态显型。图片来源:Nat. Nanotech.
为了将MagRC技术应用到追踪CTCs动态显型中,研究人员采用两种荷瘤小鼠模型,即肿瘤经刺激生长与未经刺激生长。通过采血分析,研究人员发现两种模型小鼠血液内的CTCs数量随时间增加而增加,且经刺激的小鼠血液内CTCs比未经刺激的更多。此外,经刺激的小鼠血液内CTCs的显型会持续变化,而未经刺激的则趋于稳定。
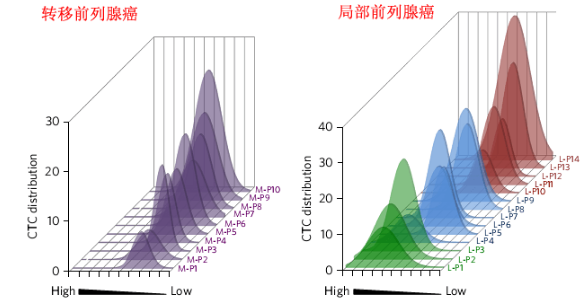
MagRC技术对临床样品CTCs的检测与分类。图片来源:Nat. Nanotech.
最后,研究人员采用MagRC技术对患有转移前列腺癌与局部前列腺癌病人血液内的CTCs进行检测与分类。研究结果表明,相比于患有转移前列腺癌的病人,患有局部前列腺癌病人血液内CTCs的显型呈现出更大的多样性。
http://www.nature.com/nnano/journal/vaop/ncurrent/full/nnano.2016.239.html