陈填烽课题组在纳米硒载药序控系统的靶向设计及肿瘤诊疗应用上取得重要进展
硒是人体必需的重要微量元素,因此,基于硒开发高效低毒的抗肿瘤药物具有重要的科学意义和应用前景。暨南大学化学与材料学院陈填烽教授团队一直致力于靶向纳米硒载药体系在肿瘤诊疗中的应用及机制研究,并取得了一系列研究成果,相继在ACS Nano (2012, 6, 6578),Biomaterials (2011, 32, 9068; 2013, 34, 7106),ACS Applied Materials & Interfaces (2014, 6, 13738),Nanomedicine: NBM (2015, 11, 947)及Journal of Materials Chemistry B (2015, 3, 4345;2016,4, 2351)等本领域重要期刊上发表系列论文,最近关于肿瘤微环境响应的序控纳米药物体系设计及应用的工作在Advanced Functional Materials (2016, 26, 7775)杂志上以封面文章发表。
基于顺铂在肿瘤治疗中引起的严重的肾毒性,陈教授团队利用11-巯基十一醇和水溶性维生素E修饰的纳米硒逆转顺铂所引起的肾毒性,其潜在作用机制是修饰的纳米硒能有效清除顺铂引起的肾小管内皮细胞中累积的过量活性氧,实现对肾小管内皮细胞的保护作用。这些结果分别于2011年发表于本领域重要杂志Biomaterials (2011, 32, 9068)及Journal of Materials Chemistry B (2013, 1, 6365,封面文章)。为了进一步提高纳米硒的稳定性,陈教授团队利用不同多糖(蘑菇多糖、茯苓多糖、壳聚糖、ATP以及龙须菜多糖)修饰纳米硒,发现可以显著增加肿瘤细胞对纳米硒的吸收,从而提高纳米硒的抗肿瘤活性(Journal of Materials Chemistry (2012, 22, 9602);Inorganic Chemistry (2012, 51, 8956);Nanomedicine: NBM (2013, 9, 74);ACS Applied Materials & Interfaces (2014, 6, 13738))。为了解决药物的毒性和对正常细胞副作用的难题,陈教授团队设计合成了靶向修饰的负载临床抗肿瘤药物(5-氟尿嘧啶和阿霉素)的纳米硒药物传递系统,作为靶向肿瘤的药物传递系统来增强细胞吸收和选择性从而提高抗肿瘤效果。这些研究成果于2012和2013年发表在ACS Nano (2012, 6, 6578)和Biomaterials (2013, 34, 7106)上。

基于靶向纳米硒体系所展现出的高效低毒的抗肿瘤活性,陈填烽教授团队在接下来的研究中将靶向修饰负载药物的纳米硒用于逆转肿瘤多药耐药的研究,通过抑制耐药蛋白的表达从而逆转肿瘤多药耐药。这些研究结果于2015年发表在Nanomedicine: NBM (2015, 11, 947)及Journal of Materials Chemistry B (2015, 3, 4345,封面文章)。
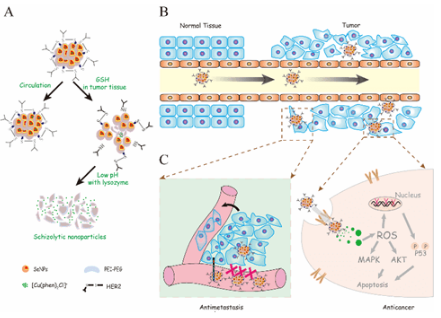
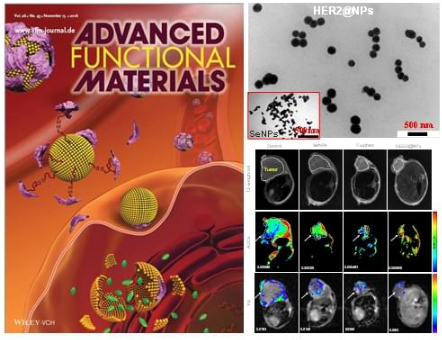
为了解决靶向纳米硒体系在肿瘤治疗中所面临的释药不精确性的难题,陈教授团队设计并且合成了HER2抗体修饰的纳米硒,负载金属配合物,获得了具有肿瘤微环境响应的纳米硒载药体系。该纳米体系在肿瘤微环境的高浓度GSH以及溶酶体的弱酸性条件下,实现药物的精确、逐步、可控的释放。该纳米体系同时可以在无毒浓度下抑制肿瘤细胞的迁移和侵袭。而且体内抗肿瘤活性实验也表明该纳米体系能精准地传递药物到肿瘤区域并控制其释放,从而有效提高金属配合物在体内的抗肿瘤效果,并明显降低其对机体带来的副作用。其潜在的作用机制是,释放的金属配合物通过上调胞内活性氧水平,激活下游p53凋亡信号转导通路,级联扩大凋亡信号,最终诱导细胞凋亡。基于以上实验结果,该研究成果于2016年在本领域重要杂志Advanced Functional Materials (2016, 26, 7775)上被当做封面文章发表。基于该团队在靶向纳米硒体系抗肿瘤研究中所获得的一系列研究成果发现,纳米硒材料可以作为一种理想的化学药物载体,实现其在肿瘤诊疗中的应用。这一系列的研究工作将为进一步开发靶点清楚、作用机制明确的新型靶向纳米药物或先导物在肿瘤诊疗中的应用提供科学依据。
HER2@NPs作用的示意图
上述工作的开展,为开发基于纳米硒的靶向药物打下了重要的基础。上述研究工作得到了中组部万人计划青年拔尖人才项目、国家高技术研究发展计划(863计划)项目、国家自然科学基金及广东省自然科学杰出青年基金等项目的资助。
http://onlinelibrary.wiley.com/doi/10.1002/adfm.201604206/full