揭秘抗癌新药临床试验内幕:为何要用活人当小白鼠
“人体小白鼠们”试验出来的抗癌药
美国最著名的白血病女孩Emily Whitehead,今年13岁了,笑语盈盈地过着幸福而健康的生活。2012年4月,她作为全球第一个吃螃蟹的急性淋巴细胞白血病患儿,接受了一种彼时尚属探索阶段的全新抗癌技术——嵌合抗原受体T细胞(CAR-T)治疗,历经磨难,终于痊愈。和她一起成熟、成名的CAR-T技术,已于2017年正式在欧美国家上市,开始造福于更多的血癌患者。

照片拍摄于2017年,Emily Whitehead痊愈满5年
来自河南扶沟的大学生魏泽西,留下一篇震惊国人的“人性最大的恶是什么”,含恨离世已经2年多了。这位不幸的滑膜肉瘤患者,在无良的商业机构和无德的冒牌庸医蛊惑下,接受了一种彼时流行于中华大地但疗效并不确切的免疫细胞治疗——DC-CIK技术,散尽家财却于事无补,眼看自己时日无多,魏泽西在网上详细记录了自己的遭遇和血泪控诉。和他一起凋亡、埋葬的DC-CIK技术,已于2016年5月被国家相关部门正式叫停,涉事的医疗机构和商业机构均已受到严厉处分。
同为癌症患者,接受的其实同属免疫细胞治疗,一个是柳暗花明的喜剧,一个是痛彻心扉的悲剧,这到底是为什么?
全新的抗癌药物、抗癌技术,我们到底应该如何对待:不惜一切代价、汲汲以求,还是盲目排斥、避之唯恐不及?
尝试一个尚未上市的抗癌新药、新技术,到底要经过怎样的流程:想法设法拿到新药,自行使用;还是选择去一个大型机构经历“繁文缛节”、“层层筛选”?
这一系列问题,都与新药临床试验有关。
为什么要拿人体做药物试验?
要评价一款新药、新技术是否靠谱,事实上是一个颇有难度的技术活。疗效几何,副作用多大,可不能轻信研发者的“自卖自夸”、厂家提供的“典型案例“、少数获益者的”现身说法“——这些古老的套路,早就过时了。“自卖自夸“,容易虚假宣传;”典型案例“,容易以偏概全;”现身说法“,容易情胜于理。此外,现代医学发展到今日之程度,治疗绝大多数肿瘤,都已有标准方案。一个新药、新技术,想要脱颖而出,必须要证明它至少不差于,当然最好是明显优于老药,否则毫无意义。
为了研究和论证新药、新方案比现有的老药、老方案更有优势,最科学的做法,就是临床试验——找两拨年龄、性别、疾病严重程度等诸多可能影响药物疗效的因素均类似的病友,一拨接受新药,一拨接受老药,由独立第三方科学评价疗效和副作用,成绩单宣布的时候,谁优谁劣,一目了然。上文提及的Emily Whitehead在2012年接受CAR-T治疗,就是参加了一个I期临床试验,治疗全程免费,而且处于顶尖专家团队密切观察之下。于此相反,虽然DC-CIK技术的疗效并不确切,魏泽西却花费了二三十万的代价,在一个已被商业机构承包的“黑诊所“做了一回无意义的小白鼠。
最早的临床试验,可以追溯到公元前600多年,圣经旧约里就记载了这样的故事:尼布甲尼撒王二世命令皇室血统的儿童在三年内只吃肉和酒,而丹尼尔和另外三个孩子却只能吃面包和水。三年后,人们发现:只吃面包和水的4个孩子,比那些整天肉食、酗酒的孩子,更健康、更活泼。现代意义上的临床试验,发端于19世纪末、20世纪初,安慰剂的引入、随机分组、多中心参与、赫尔辛基宣言、政府药监部门监管等一系列新的理念和操作规范,不断涌现,最终推动了药物临床试验不断壮大、规范且成熟。目前,全世界范围内所有大型临床试验,都会在“国际临床试验”官方网站上备案、登记和发布最新资讯,有需要的朋友请记住下面这个网址:http://clinicaltrials.gov/ct2/home。当然,这个网站上的信息,使用的语言,都是英文。在这个网站里输入“肺癌”对应的英文单词,lung cancer,结果显示:目前共有6538项临床试验正在招募符合条件的志愿者。
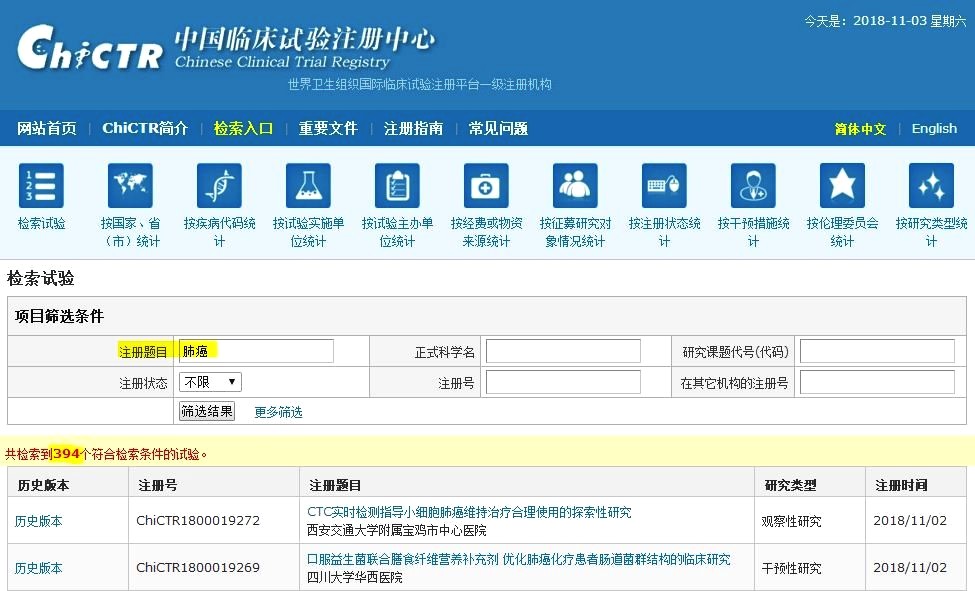
此外,中国政府设立了一个在中国境内开展的临床试验的登记和发布网站——中国临床试验注册中心(网址:http://www.chictr.org.cn/index.aspx)。在这个网站里输入“肺癌”,目前共有394个临床试验正在招募符合条件的志愿者。

每年上千种临床试验,能获批上市的只有一两款
新药临床试验有不同的类型,肿瘤药的临床试验绝大多数时候只招募肿瘤患者来参加。一个新药的雏形,在经过大量的临床前研究,如在体外的癌细胞上、在动物身上进行各种各样的测试,经过药监部门严苛的审核之后,才能有资格开始招募肿瘤患者来进行I期临床试验。I期临床试验,一般招募10-30个其他标准治疗均失败的、“死马当活马医“的晚期肿瘤患者,分成不同的剂量组,观察药物的副作用,同时初步探索最佳的给药剂量和服药间隔。之所以I期临床试验要招募其他治疗均失败的肿瘤患者,这是因为I期临床试验中测试的药物其成功率极低、副作用不可预测。
每年都会有几百上千个全新的抗癌药候选物出现,但最终经过一轮又一轮的反复测试,能成功上市的凤毛麟角。笔者于2018年11月2号登陆上文已提及的国际临床试验登记网站,检索目前正在招募志愿者的肿瘤药物I期临床试验,共发现有3461个;而美国FDA每年批准上市的抗癌新药、新适应症,大约只有几十个甚至更少。每年在开展的几千个新药试验,成功率大约只有1%——言外之意,参与I期药物临床试验的志愿者,大概率是无法获益的。因此,对于常规传统治疗尚未穷尽的肿瘤患者,一般而言,是不推荐去参加I期临床试验的;放弃一个尽管有效率并不高但久经考验的成熟方案,去追逐那1%的虚无缥缈的“新大陆“,或许未必明智,同时也是违背医学伦理的。
此外,I期临床试验中测试的抗癌新药,其副作用有时候是不可预测且十分复杂的,尤其是抗癌原理全新的药物。上文提及的Emily Whitehead作为第一个接受CAR-T治疗的白血病儿童,给药第二天就出现高热、血压骤降、休克昏迷,送到重症监护室抢救,主管医生们一开始判断她几乎要为医学献身了。不过,后来经过对小姑娘血液中各项指标的测试,专家团队发现一种导致炎症、干扰循环的分子,白介素6,升高了几百上千倍;幸运的是,研发了CAR-T技术的首席专家Carl June教授的女儿,由于患有风湿免疫病,规律使用一种能阻断白介素6的药物,托珠单抗;抱着试一试的态度,专家团队最终决定给濒死状态的Emily Whitehead用一用托珠单抗。很快,奇迹就发生了。小姑娘开始慢慢清醒,各项指标都开始好转,外周血中白介素6的浓度不断下降;当她从重症监护室走出来的时候,她迎来了自己7周岁的生日。几周后,全面而深度的化验检查提示:小姑娘身体里的癌细胞完全消失了,经历九死一生的Emily Whitehead,从此痊愈了。经过后续大量的研究,目前医学界已经明白,CAR-T治疗将导致一种全新的、严重的副作用,“细胞因子释放综合征“,或者也有人形象地简称为”细胞因子风暴“,一旦风暴来袭,必须使用托珠单抗等药物进行干预,否则患者将献出宝贵的生命。

Carl June教授、Emily Whitehead一起参与Facebook前总裁肖恩·帕克夫妇召集的抗癌公益活动
Emily Whitehead是幸运的,传统治疗失败的她参加的I期临床试验,接受的抗癌新技术后来证实的确是有效的(百里挑一的概率);更难能可贵的是,当她接受治疗后出现严重的、对其发生机理和处理手段全然未知的副作用时,一个顶尖的医疗团队迅速找到了解决方案,让她转危为安。然而,并不是每一个参与I期临床试验的志愿者,都是如此幸运的。每年,欧美国家参与肿瘤新药I期临床试验,死于各类药物不良反应的志愿者成百上千。在Emily Whitehead之前,美国国家癌症中心的科学家就尝试利用类似的技术治疗晚期实体瘤患者,结果入组的前2名患者,同一个上午接受的治疗,两天之内先后去世,震惊全球,给整个领域的科研进程泼了一大盆凉水。这些因为新药未知的不良反应而去世的志愿者们,为医学的进步,做出了巨大的牺牲。如果没有这些心怀希望、伟大而坚强的勇士,医学将永远停滞不前——美国公共电视台(PBS)曾经制作了一个3集的纪录片《Cancer: The Emperor of All Maladies》(翻译过来就是,《癌症:众病之王》),在该纪录片中,记者采访了不少参加临床试验的肿瘤病友,也采访了不少研发新药的科学家,当然还有不少兢兢业业的医护人员。欧美国民面对医学的不完美、新药疗效和副作用的不确定性所表现出来的理性、包容和冒险精神,令人动容。
当一个候选的抗癌新药,艰辛地通过了I期临床试验的检验,发现其副作用处于可控范围,同时有一定的抗癌活性。那么,药厂很可能会发起一个几十到一两百人参与的II期临床试验,II期临床试验的目的是最终确定最佳的给药剂量、服药间隔,同时初步评价药物的疗效。一般而言,参加II期临床试验,药物的安全性是有一定程度的保证的,但其疗效依然是未知的。每年全世界范围内开展的数千个肿瘤新药II期临床试验,绝大多数依然会以失败而告知。当然,偶尔也有喜剧,极少数疗效异常突出的抗癌新药,II期临床试验数据就惊艳全场,那么各个国家都有各自的“破格提拔“的政策,允许这极少数新药不经过III期临床试验的检验,火线上市,赶紧去造福更多的癌症患者;在上市之后,再补做III期临床试验,并通过评估III临床试验的结果,最终决定这个新药长久上市抑或剥夺其上市销售的权力。今年获得诺贝尔医学奖的肿瘤免疫治疗新药PD-1抗体,就多次以II期临床试验惊艳的疗效数据,火线上市——晚期非小细胞肺癌的传统药物治疗,有效率徘徊在10%-20%左右;而在精选人群中,PD-1抗体的有效率可以达到40%-50%;因此,多次破格提前上市。

2018年诺贝尔医学奖授予了肿瘤免疫治疗领域的两位先驱
当一个候选的抗癌新药经过I期、II期临床试验的考验,表现出令人眼前一亮的抗癌活性以及可控的副作用,药厂经过深思熟虑之后,会启动决定这个药物能否上市的最最重要的III期临床试验。一项III期临床试验,一般招募的志愿者为几百人到上千人,平均的成本为十几亿乃至数十亿人民币,试验成功,新药上市,收益颇丰;试验失败,十几年乃至几十年的心血,数十亿的投入全部灰飞烟灭。
因此,启动一项III期临床试验,是十分慎重且艰难的。III期临床试验,一般都会设置对照组,都会要求随机分组,同时多数时候会要求双盲——言外之意,入组III期临床试验的患者,一组是接受新药治疗,一组是接受传统治疗,分组是随机的,甚至多数时候,患者到底被分入了哪一组,患者本人、患者的家属、患者的主管医生均不知情,而且均无权干预。药物的疗效评价、副作用记录一般都由独立的第三方来负责,同时政府的药监部门会对整个过程进行严格的审查和监管——药物涉及的是患者的生命健康,兹事体大;新药研发,周围环绕的是巨大的商业利益,极容易受到方方面面的干扰;三期临床试验,涉及众多肿瘤患者、医生护士、药企相关人员、政府有关部门、新药科学家等方方面面的人与事;因此,唯有最严谨的试验设计、最严格的外部监管、最科学的结果解读,才能经得起时间和历史的检验。