肿瘤免疫及其组合疗法,治愈癌症的希望?
各位小伙伴,新年好。正式阅读前咱们做个小测验:请闭上你的眼睛,提到免疫治疗,你的头脑里面会想到哪些靶点?请一口气流利地说出来。
如果只会说PD1、CATL4,那估计就是圈外人;如果能说出LAG3、TIM3、OX40、CD70,那么应该是看了一些项目,但是都跑不出Checkpoint这个圈圈。
作为投资人,如果没有对肿瘤免疫治疗的全视野,怎么可能主动找到优质项目?不要急,我们愿意分享给大家,共同进步,就看你爱不爱学咯。以下是超级长文,给有耐心的好学的爱思考的小伙伴阅读。
癌症是危害人类健康的重大疾病之一,癌症古而有之公元前1500 年,埃及人写的草纸文中就有关于体表肿瘤的记载。
远在两千多年前,我国《黄帝内经》中记载的肿、疡、赘瘤、岩等便是肿瘤,我国出土的殷墟甲骨文中就有“瘤”字。古希腊医学家Galen对恶性肿瘤的特征及其形成进行过描述;我国现存的中医文献里,最早出现“癌”字的是宋代的《卫济宝书》。公元1264年的《仁斋直指附遗方论》一书则对癌症有比较具体的描述:“癌者上高下深,岩穴之状,颗颗累垂……毒根深藏,穿孔透里”,从这些古代论著的记载中我们深切的感受到古人也曾经饱受癌症的困扰(图1)。

图1甲骨文及古籍中关于肿瘤的论述
历史的车轮进入了21世纪,癌症的发病率却有增无减,目前癌症已经成为人类的一个常见病,据最新统计显示2018年全球新增癌症病例1810万人,死亡960万人。现代主流医学认为人体正常细胞基因突变后使其获得不受约束的生长和浸润转移能力而变成癌细胞,癌细胞在体内不断扩增转移并破坏机体的正常生理功能,不断消耗机体的营养物质,最终导致宿主死亡。正常情况下,机体免疫系统可以识别并清除体内的癌细胞,但癌细胞为了生存和生长,采用不同策略和方法使人体的免疫系统受到抑制而不能正常的杀伤癌细胞,从而使得癌细胞在抗癌免疫应答的各阶段得以幸存
回溯人类与癌症搏斗的历史,公元前500年波斯皇后阿托莎就因患乳腺癌被切除乳房,东汉华佗(公元127年-公元208年)首创麻醉下手术治疗体内“结积”(包括肿瘤疾病),并在《中藏经·论痈疽疮肿》中指出:“夫痈疽疮肿之所作也,皆五脏六腑蓄毒不流则生矣,非独因荣卫壅塞而发者也。”这应该是最早应用麻醉方法行手术治疗内脏肿瘤的例子。我国古代人民在长期的实践中总结出来的一些经验,对于癌症防治有着非常好的启示。
1902年居里夫妇发现镭后,外科医生就开始使用X线辐射治疗肿瘤。
1957年李敏求成功用甲氨蝶呤治愈绒毛膜癌患者,他作为第一位成功用化疗方法治愈恶性实体肿瘤者获得1972年的拉斯克临床医学奖。
1891年纽约骨外科医生William Coley在做手术切除肿瘤的时候发现,术后感染的病人比没有感染的病人恢复的要更好。由此,他产生了一个大胆的设想—给患者肿瘤内注射链球菌,作为肿瘤治疗方法,这类似于现在的溶瘤细菌疗法,可以认为是癌症免疫疗法的雏形。
上世纪70年代随着DNA重组技术的建立和突破,掀起了从分子层面研究肿瘤的热潮,建立了肿瘤分子生物学并希望揭示相关基因及其表达产物在肿瘤发生发展中的作用,为肿瘤的预防、诊断和治疗提供新措施,从根本上提示肿瘤的发生发展机制。
上世纪80年代,人类发现了免疫细胞的很多有效成分,白细胞介素2被开发成一种治疗癌症的药物,通过输注白细胞介素2激活病人的免疫系统来对抗肿瘤。
到了上世纪80年代中期出现了过继性细胞疗法,1985年Rosenberg首次使用了免疫细胞过继回输第一代LAK细胞疗法,用LAK细胞合并IL-2治疗25例不同类型的化学药物和放射线治疗无效的晚期肿瘤病人,并取得了肯定疗效。
LAK细胞疗法建立以后,在全世界引起了轰动,但是问题相伴出现:其他的研究人员运用LAK细胞疗法进行治疗癌症的实验,发现效果并没有Rosenberg使用的那么好。因此研究人员对LAK疗法的热情降低,坚持进行实验的人越来越少,后来细胞疗法不断升级,先后出现了CIK疗法、DC-CIK疗法、CTL疗法、DC-CTL疗法、NKT疗法以及目前很火热的CART、CARNK和TCRT疗法,最近10多年是癌症免疫治疗飞速发展的时期,随着分子免疫学、生物化学、生物信息学、细胞生物学、系统生物学等各学科的突飞猛进的发展和各学科的交叉融合,人们对肿瘤及其免疫的理解更加深入,癌症的免疫治疗得到长足发展。
肿瘤免疫治疗就是通过重新启动并维持肿瘤-免疫循环,恢复机体正常的抗肿瘤免疫反应,从而控制与清除肿瘤的一种治疗方法。
根据作用机制不同,肿瘤免疫治疗方法主要包括非特异性免疫调节剂治疗、肿瘤疫苗相关免疫治疗、过继免疫治疗、免疫检查点抑制剂相关免疫治疗、针对肿瘤微环境相关的免疫治疗、针对代谢通路靶标的免疫治疗、针对外泌体的免疫治疗和针对细胞离子通道的免疫治疗。
————肿瘤免疫治疗方法————
1、非特异性免疫调节剂治疗
免疫调节剂是一类能增强、促进和调节免疫功能的非特异性生物制品,它对治疗免疫功能低下、某些继发性免疫缺陷症和某些恶性肿瘤等疾病具有一定的作用,但对免疫功能正常的动物及人却不起什么作用。
其主要机制是通过非特异性方式增强T、B淋巴细胞的反应性,或是促进巨噬细胞的活性,也可以激活补体或诱导干扰素的产生。免疫调节剂可以分为几大类:
1、来源于一些药用植物的天然免疫调节剂,如人参、枸杞、松花粉等;
2、在生物体内天然存在的一类免疫调节剂,如胸腺素、转移因子等;
3、免疫细胞经刺激后分泌的细胞因子,如白细胞介素-2、干扰素等;
4、细菌来源的免疫调节剂,如卡介苗、小棒杆菌,目前研究很热的肠道菌群也有很多参与了生物体的免疫调节作用;
5、维生素和微量元素类免疫调节剂,如硒、维生素A等。目前以胸腺肽、卡介苗、脂质A 等为代表的免疫增强剂可调节宿主的免疫功能,并作为辅助手段用于恶性肿瘤的临床治疗,如胸腺肽-α1 用于治疗高龄患者消化道肿瘤,卡介苗用于膀胱灌注治疗膀胱癌,单磷酰脂质A 和SA-41BBL组合使用作为肿瘤相关抗原(TAA)疫苗的新型佐剂。
非特异性免疫调节剂
|
非特异性免疫调节剂的类型 |
代表性品种 |
|
药用植物的天然免疫调节剂 |
人参、枸杞、松花粉等 |
|
生物体内天然存在的一类免疫调节剂 |
胸腺素、转移因子等 |
|
免疫细胞经刺激后分泌的细胞因子 |
白细胞介素-2、干扰素等 |
|
细菌来源的免疫调节剂 |
卡介苗、小棒杆菌等 |
|
维生素和微量元素类免疫调节剂 |
硒、维生素A等 |
2、过继免疫治疗
过继免疫是把致敏淋巴细胞(具有特异免疫力的)或致敏淋巴细胞的产物(例如转移因子和免疫核糖核酸等)输给细胞免疫功能低下者(如肿瘤病人),使其获得抗肿瘤免疫力。
目前研究较多发展较快的是过继性免疫细胞治疗。过继性免疫细胞治疗(adoptive cellular immunotherapy,ACI)是指通过输注自体或异体免疫细胞来治疗肿瘤的生物治疗方法。其主要的免疫效应细胞有树突状细胞(dendritic cells,DC)、自然杀伤细胞(NK)、细胞因子诱导的杀伤细胞(cytokine-induced killer cells,CIK)、肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)、淋巴因子激活的杀伤细胞(LAK)、巨噬细胞激活杀伤细胞(MAK)、细胞毒性T淋巴细胞(CTL细胞)、γδT 细胞、NKT细胞、嵌合抗原受体(chimeric antigen receptor,CAR)修饰T细胞、TCR-T细胞等。
这些免疫效应细胞经过在体外培养扩增,可绕过体内肿瘤免疫抑制等障碍,增强机体抗肿瘤免疫功能,从而选择性地发挥抗肿瘤免疫效应。
3、肿瘤疫苗相关免疫治疗
肿瘤疫苗是通过激发人体特异性的肿瘤抗原产生特异性免疫应答,从而克服肿瘤对机体造成的免疫抑制状态并达到清除肿瘤细胞的目的。肿瘤疫苗是以肿瘤细胞或肿瘤抗原,包括肿瘤特异性抗原(TSA)和肿瘤相关抗原(TAA)为基础,我们可以根据负载肿瘤抗原成分及方法的不同将肿瘤疫苗分为核酸疫苗、多肽疫苗、重组病毒疫苗、细菌疫苗、树突状细胞(Dendritic Cell, DC)疫苗、抗独特性抗体疫苗、基因修饰的肿瘤细胞疫苗等。
肿瘤疫苗解决的核心问题是保证肿瘤抗原有效递呈给T淋巴细胞,从而激活特异性的抗肿瘤免疫反应。肿瘤疫苗中如何精准的发现并预测肿瘤特异性新抗原和研发不同类型的新抗原的递送系统是肿瘤疫苗开发的重点和难点,对于肿瘤疫苗疗效的发挥具有重要的意义。
4、免疫检查点抑制剂相关免疫治疗(图2)
研究发现肿瘤细胞或免疫细胞中高度表达的共抑制因子(免疫检查点) 是介导肿瘤免疫逃逸的一项重要因素。因此临床上出现了作用机制显著区别传统抗体药物的新一代抗肿瘤抗体--靶向免疫检查点蛋白的共抑制因子拮抗剂。
关于免疫检查点抑制剂的研究和药物开发是最近几年的热点,研究人员开发出多种免疫检查点抑制剂(我们熟知的PD1抗体就是其中的一类),以阻断免疫抑制信号的传递,逆转肿瘤免疫微环境,恢复T细胞抗肿瘤活性,增强内源性抗肿瘤免疫效应,包括cTLA4单克隆抗体、抗PD-1单克隆抗体等。
目前PD-1/PDL-1抗体的整体临床客观缓解率在20%左右,在不同肿瘤中的应答率差异较大,PD-1和PDL-1免疫检查点抑制剂的治疗效果和PDL1的表达水平,肿瘤突变负荷(TMB),dMMR(错配修复缺陷)/MSI-H(微卫星不稳定性)、肿瘤浸润淋巴细胞数量、肠道菌群类型(图3)等密切相关。
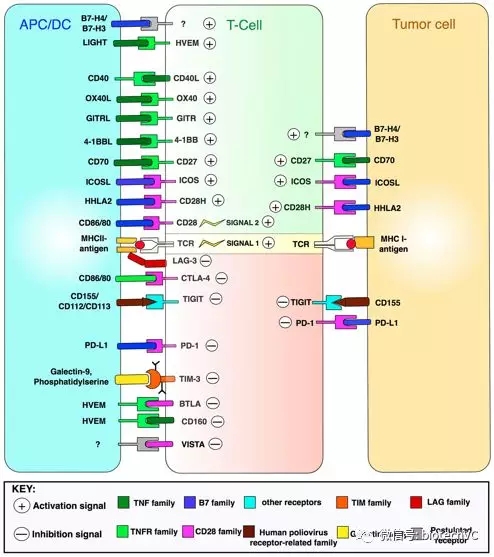
图2 T细胞激活和细胞表面的治疗靶标(frontiers in Oncology 2018)
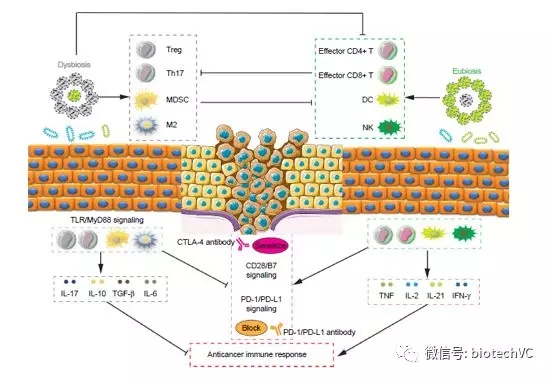
图3 肠道微生物调节肿瘤免疫的重要作用(OncoTargets and therapy)
5、针对肿瘤微环境相关的免疫治疗
肿瘤微环境是由肿瘤细胞、肿瘤浸润免疫细胞、新生血管及内皮细胞、肿瘤相关成纤维细胞和细胞外基质共同构成。
肿瘤微环境对于促进肿瘤恶化、侵袭力,抵抗机体免疫作用和增强治疗抗性密切相关。肿瘤微环境是动态变化的,受到肿瘤细胞、肿瘤微环境相关细胞及肿瘤血管及细胞基质的影响。
针对肿瘤微环境的免疫治疗药物是目前的研究热点,目前肿瘤微环境中多种炎性细胞、炎性介质以及炎症信号通路中的重要蛋白已经作为药物靶点,在临床治疗肿瘤的试验及应用中取得了备受瞩目的效果(图4)。针对肿瘤微环境的免疫治疗常与免疫检查点抑制剂或别的治疗手段配合以达到更好的抗肿瘤效果。
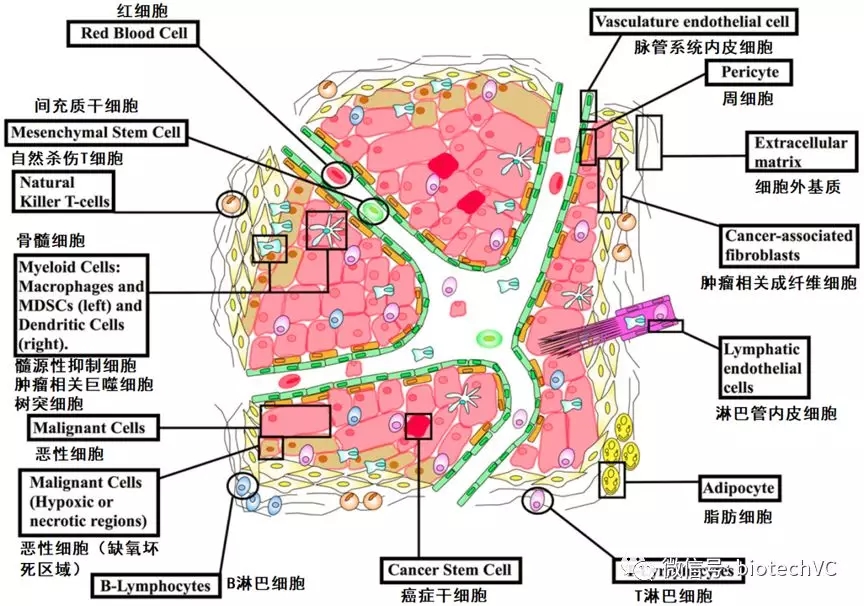
图4 肿瘤微环境的细胞组成(图片来源于frontiers in Oncology 2018原图修改)
6、针对代谢通路靶标的免疫治疗
研究显示许多代谢机制对于肿瘤的免疫逃避是必需的,并且可以作为免疫疗法中的共同靶标。肿瘤需要广泛的,适应性强的代谢模式才能在特定的生态位中茁壮成长,目前已知的所有癌症标志在某种程度上都需要代谢参与,最新的证据表明肿瘤可能通过重新编程宿主代谢来延续其存活。
在患有厌食症肿瘤患者中,增加的代谢应激导致全身性糖皮质激素的升高,进而显著降低抗肿瘤T细胞的免疫应答,引起肿瘤生长并使疾病进展。目前研究较多的代谢靶标包括色氨酸分解代谢酶-吲哚胺2,3-双加氧酶(IDO),Notch同系物1(NOTCH1)和环氧合酶-2(COX2)。
此外和肿瘤细胞线粒体能量代谢相关靶标和通路对于肿瘤的发生发展转移也具有至关重要的作用。针对代谢途径进行免疫治疗的最终目标是使肿瘤非正常的代谢应激状态恢复正常,从而发挥抗肿瘤的免疫作用,目前的代谢组学有望识别新的肿瘤治疗靶点并阐释相关机制,并可能提供反映遗传,微生物群,生活方式和环境因素在肿瘤发生、发展中相互作用的重要联系。
7、针对外泌体的肿瘤免疫治疗
外泌体是特殊的纳米级脂质双层囊泡,外泌体能够在细胞之间传递生物活性DNA,mRNA,miRNA和致癌蛋白而实现细胞间通信,最终实现细胞网络的遗传重编程。癌症过程的各个阶段都涉及外泌体的相互作用(图5)。
外泌体将来自肿瘤细胞的信息传递给基质细胞和免疫细胞,促进肿瘤免疫逃避并建立肿瘤微生态。基于外泌体的肿瘤免疫治疗主要通过载有完整抗原或肽片段的“dexosomes”(树突细胞衍生的外泌体)来实现,目前已经证明该方法能够诱导全身性T细胞应答。与其他细胞疗法相比,该疗法具有广阔的前景,刺激抗肿瘤反应的准确性高于非细胞途径,并且具有更高的生物稳定性和生物利用度以及成本效益。
相关证据表明经dexosome处理的肿瘤确实含有更高比例的能分泌IFN-gamma的T细胞。 然而,在结肠癌、直肠癌和非小细胞肺癌的早期临床试验中该疗法仅产生中等的治疗效果,我们可以通过更好的组合物、抗原加载策略和外泌体的运输策略以增强其疗效。
此外在晚期癌症病人的治疗中,我们可以通过消除外泌体的疗法达到控制癌症进展的目的,临床研究发现血压抑制药物阿米洛利可以通过抑制外泌体形成,在结肠直肠癌患者中降低MDSC的免疫抑制作用。
最近研究发现肿瘤微环境中的肿瘤相关成纤维细胞能分泌装载其线粒体DNA的外泌体,该外泌体与癌细胞里的线粒体发生作用,促进了休眠癌细胞的复苏、增殖和转移,因此我们可以尝试阻断这些外泌体的产生来预防癌症复发。
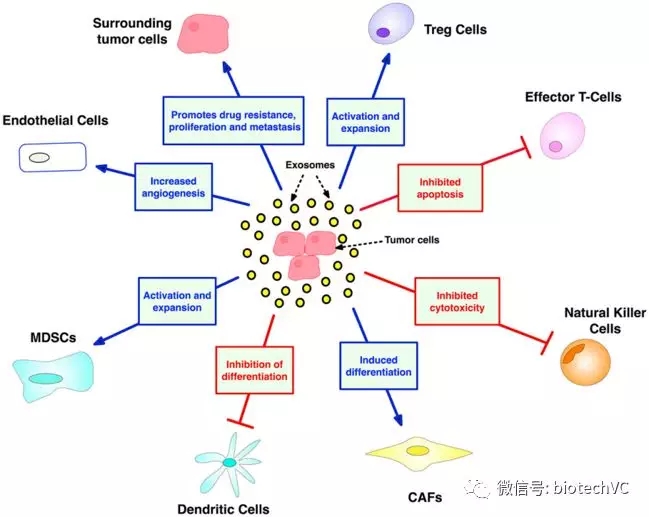
图5 外泌体对癌症发生发展的作用(图片来源于frontiers in Oncology 2018)
8、针对细胞离子通道的免疫治疗
各种离子通道,包括电压和配体门控离子通道,在免疫系统的细胞中表达,并对免疫功能做出了显著的动态贡献(图6)。 目前有证据表明电压门控钠通道(VGSCs / Nav's),电压门控钾通道(VGPCs / Kv's)和钙激活钾通道(KCa's)和肿瘤的发生发展密切相关。由于离子通道参与了整个癌症过程的所有阶段,因此它们的阻断剂可为基于T细胞的免疫疗法提供独特的多方面优势,包括与PD-1阻断的组合。 针对离子通道进行肿瘤免疫治疗的另一个优点是能够使用光遗传学技术远程操作和控制,具有极大的应用前景。
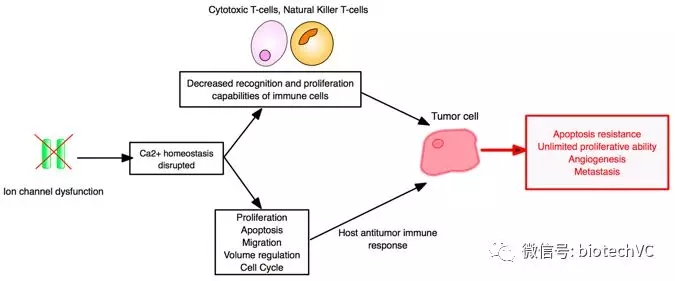
图6 离子通道作为癌症免疫治疗的靶标
————肿瘤免疫及其组合疗法————
近年来,以单克隆抗体、小分子药物、肿瘤疫苗、细胞免疫为代表的肿瘤免疫治疗迅速发展,肿瘤免疫疗法在增强机体的免疫和抗癌能力,抗御肿瘤方面取得了良好的临床疗效,有着巨大的治疗潜力和生命力。
有效的抗肿瘤免疫包含以下几个过程:淋巴组织中抗原特异性T细胞的引发,效应T细胞的分化,T细胞向肿瘤组织的运输,最后通过细胞毒性CD8+ T细胞杀死肿瘤细胞。
肿瘤微环境中的免疫抑制信号可导致肿瘤浸润性淋巴细胞(TIL)耗尽或功能紊乱,导致肿瘤逃逸和治疗抵抗。在多数情况下,使用免疫检查点抑制剂的单一疗法往往无法有效地阻断这些抑制信号获得令人满意的临床效果,因此,需要我们组合不同检查点抑制剂来增强抗肿瘤免疫,此外还应该更大程度上通过不同疗法的组合运用来增强肿瘤治疗效果。
不少临床及相关研究发现联合疗法治疗肿瘤的缓解率比单一疗法要高,目前临床上常将不同免疫治疗方法联合运用,以及免疫治疗与手术、化疗、放疗、靶向治疗、光热疗法等手段联合应用以增强抗癌效果,目前获批的或处于临床研究阶段的组合疗法主要有以下几大类:
1、免疫-免疫治疗药物的联合:FDA已经批准Opdivo与Yervoy联合用于晚期黑色素瘤患者的一线治疗;
2、免疫-化疗药物的联合:FDA已经批准Keytruda与培美曲塞+卡铂联合用于NSCLC的一线治疗方法;
3、免疫-放疗的联合;
4、免疫-靶向药物的联合;
5、免疫-手术的联合;
6、免疫-光热疗法的组合
目前通过组合免疫疗法增强抗肿瘤疗效主要从3个方面入手(图7):
1、通过不同的免疫治疗组合方式诱导T细胞进入免疫冷肿瘤以增强抗肿瘤效果
目前单一的免疫检查点抑制剂对于免疫冷肿瘤的治疗效果并不理想,因此我们需要将免疫冷肿瘤或非炎性肿瘤转变为免疫热肿瘤,这一过程中首先需要保证有充足的抗原充分激活淋巴结里的T淋巴细胞,此后这些T淋巴细胞必须运输并且渗入肿瘤组织才可能发挥抗肿瘤作用。
诱导T细胞克隆产生或扩增T细胞库的一种策略是使用肿瘤疫苗:例如采用能分泌粒细胞巨噬细胞集落刺激因子(GM-CSF)的同种异体疫苗GVAX,此种疫苗在类似于胰腺癌这样新生抗原表达较低的肿瘤中能发挥较好的作用。
研究发现,单独给与GVAX可增加胰腺肿瘤中的淋巴聚集体,而GVAX与ipilimumab联合使用可增强抗肿瘤免疫力。目前采用靶向个体化新生抗原的疫苗来诱导针对新生表位的特异性T细胞具有巨大的潜力,这些个性化的新生抗原大都只在肿瘤细胞中表达,靶向这些蛋白片段可以让患者的免疫系统发现并攻击癌细胞,而不攻击正常细胞。
目前相关研究发现,单独使用癌症疫苗诱导肿瘤特异性T淋巴细胞时会引起IFN-γ表达增多,进而上调免疫抑制途径相关靶点蛋白的表达(如PD-L1),这意味着癌症疫苗在与免疫检查点抑制剂相结合时才可能达到最佳的治疗效果。
另一种方法是使用溶瘤病毒激活T细胞,目前已经在黑素瘤患者中体现出较好的功效,在治疗过程中溶瘤病毒株能优先攻击肿瘤细胞,引起肿瘤抗原的释放,从而增强新生抗原的表达。Talimogene laherparepvec(T-VEC),一种单纯疱疹-1衍生病毒,能在肿瘤细胞内复制并分泌GM-CSF以增强抗肿瘤免疫,在一项针对转移性不可切除的黑素瘤患者的随机开放的临床III期试验中,该溶瘤病毒疫苗在总生存期(OS)上具有显著优势。
第三种组合策略是使用免疫检查点抑制剂与化疗和放射疗法联合运用。放射疗法能增加肿瘤新抗原的表达和释放,其结果是导致更强的抗原表达和增强的抗肿瘤免疫力。有证据表明在转移性黑素瘤患者中,采用放射治疗与CTLA-4或PD-1抑制剂联合使用时,能够产生抗肿瘤协同作用和增加T细胞库中T细胞的数量。
化学疗法同样可以导致细胞死亡并释放肿瘤抗原以增强抗原呈递,广泛使用的化疗药培美曲塞和卡铂最近被批准与pembrolizumab联合用于NSCLC的一线治疗。组合用药组(培美曲塞,卡铂和pembrolizumab)的ORR显著增加55%,而单纯化疗组的这一比例为29%。
化学疗法诱导的肿瘤免疫增强的另一种机制是肿瘤微环境中免疫细胞亚群的改变。例如,低剂量的环磷酰胺已被用于消耗Tregs,而紫杉醇,氟尿嘧啶(5FU)和紫杉烷则可以用于减少MDSC。
2、优化T细胞的功能
为了防止肿瘤抗原引发并经历慢性抗原暴露的T细胞的耗竭,我们可以通过检查点调节剂来消除这一效应。研究发现与单用ipilimumab治疗转移性黑色素瘤患者相比,联合ipilimumab(Y药,CTLA-4抑制剂)和nivolumab(O药,PD1抑制剂)可获得显着的OS益处。而另一类型的检查点激活剂,例如OX40,GITR和CD40,可能在进一步增强效应T细胞功能方面发挥作用。
大多数免疫共刺激检查点,尤其是OX40和GITR靶点,于初始T细胞激发以后表达,因此作为单一疗法可能无效,然而OX40和GITR的调节作用可能更有助于放大预先存在的T细胞应答和产生记忆应答。同样,检查点抑制剂LAG-3和TIM-3,可能仅适用于已有肿瘤特异性T细胞的肿瘤,因为免疫检查点抑制剂LAG-3和TIM-3对于逆转T细胞耗竭和恢复T细胞功能可能发挥重要作用。然而在某些情况下即使将不同免疫检查点抑制剂联合使用可能也不足以将非免疫原性肿瘤转变为免疫原性热肿瘤,这就需要更多的治疗方法和策略的组合运用。
3、肿瘤微环境再编程
存在于肿瘤内的是高度复杂的微环境,肿瘤微环境的特征在于存在多种免疫抑制细胞亚群,包括调节性T细胞(Tregs),肿瘤相关的巨噬细胞(TAM),癌相关成纤维细胞(CAF),髓源性抑制细胞(MDSC),免疫调节细胞因子如TGF-β,趋化因子及其受体如CXCL12和CXCR4,代谢酶如IDO等。
在一些肿瘤类型中,这种高度免疫抑制的肿瘤微环境需要进行充分的重编程才可能引发强烈的免疫应答(图7)。为了实现这一目标,目前正在探索与检查点调节剂相结合的几种具体策略,值得注意的是,检查点调节剂本身也可以调节Tregs,NK细胞和单细胞以及其他免疫细胞的增殖,功能和存活。
下边我们来看几个针对肿瘤微环境再编程的例子:目前使用特异性巨噬细胞调节剂来优化肿瘤相关的巨噬细胞(TAM),通常TAM会介导免疫逃逸和治疗抗性。M2极化的TAM(与M1极化的TAM作用相反)通过抑制T细胞功能和分泌免疫抑制细胞因子和趋化因子来促进肿瘤发生。
CSF-1是巨噬细胞衍生的细胞因子,该细胞因子与其受体CSF1R作用以维持M2极化并诱导TAM增殖。有研究显示抗CSF1R抗体重编程TAM极化并能与胰腺癌中的检查点阻断和吉西他滨协同作用。两种趋化因子CXCL12和CCL2促进巨噬细胞进入肿瘤,这两种趋化因子分别与它们的受体CXCR4和CCR2相互作用,抗CXCR4和抗CCR2抗体能抑制TAM募集到肿瘤中,但是在一项二期临床试验中没有为舒尼替尼添加抗CXCR4抗体作为转移性肾细胞癌的一线治疗提供OS优势的证据。
MDSCs促进肿瘤细胞侵袭和转移的主要机制是通过抑制抗原特异性T细胞增殖和诱导肿瘤微环境中的Treg。有研究报道黑色素瘤患者的MDSC数量越多,ipilimumab反应越差,表明MDSCs抑制了免疫检查点阻滞的效果。解决MDSCs抑制策略的重点是削弱MDSC的功能或消耗和重新编程MDSC以增强免疫检查点抑制剂的功效。Etinostat是一种组蛋白去乙酰化酶(HDAC)抑制剂,该抑制剂在肺癌和肾细胞癌模型中与抗PD-1抗体联合使用时会破坏MDSC功能,增强抗肿瘤免疫力,减少肿瘤生长和提高生存率。目前正在进行的II期ENCORE 601试验中,使用PD-1/HDAC抑制剂组合的初步结果显示13名(31%)在检查点抑制剂单药治疗后进展的黑素瘤患者中有4例引起了良好反应(NCT02437136)。
此外局部免疫细胞或肿瘤细胞释放的分子有助于产生免疫抑制并影响肿瘤微环境重编程。TAM和肿瘤细胞产生的TGF-β是一种促进Treg活化和肿瘤血管生成的细胞因子。TGF-β水平升高与预后不良有关,已显示TGF-β抑制剂与黑色素瘤模型中的抗CTLA-4抗体协同作用能增强抗肿瘤免疫力。此外组合GVAX疫苗和TGF-β阻断剂可以导致Tregs的消耗,在富含Treg的胰腺癌模型中体现出了生存优势。另一种免疫抑制分子IDO1是由肿瘤细胞、TAM和MDSC产生的色氨酸代谢酶。IDO1对Teff功能产生负面影响并增强Treg活性。与IFN-γ诱导的PD-L1和CEACAM-1的上调相似,IFN-γ也诱导IDO1产生及上调,从而抵抗检查点阻断剂的治疗,目前临床上评估了几种IDO抑制剂。但是IDO抑制剂epacadostat与pembrolizumab联合用于患有不可切除或转移性黑色素瘤的患者的三期临床实验并没有体现出相关的优势,这其中的原因还有待深入研究。
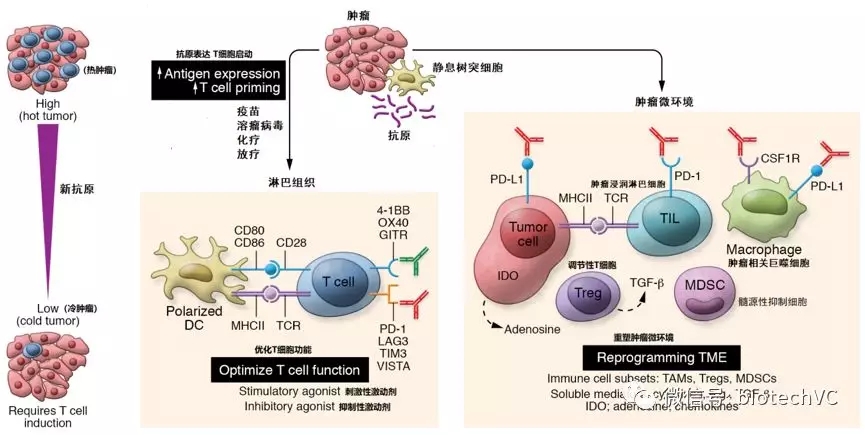
图7:组合免疫疗法增强抗肿瘤疗效的3个方面 (图片来源于JCR 2018原图修改)
——免疫疗法的组合策略和考量因素——
对于免疫热肿瘤,我们可以采用不同的免疫检查点调节剂进行治疗以提高热肿瘤的反应率,并且使肿瘤对免疫治疗敏感。然而,通过严格的临床前试验和对单一免疫检查点调节剂疗法和组合方法机理的深入理解并合理设计临床试验是一项未满足的需求。
例如激动剂OX40抗体,可能仅在早期T细胞活化后才能发挥作用,因此免疫调节剂在治疗中的使用顺序在此种组合试验中可能是一项关键的因素。
临床试验设计的优化还需要充分了解药物的药代动力学以便于降低毒性。此外,在早期临床试验中,动态监测免疫环境随治疗时间的变化十分重要,因此需要在不同时间点获得活检组织样本。
虽然活检样本在提供信息方面非常有价值,但活检存在侵入性因此并不总是可行,并且活检可能无法体现和代表整个肿瘤景观;目前发展的液体活检具有更少侵入性和方便性,然而液体活检只是肿瘤微环境中发生事件的非最优替代方案,因为肿瘤微环境中包含的重要的信息和预后特征在液体活检中无法很好体现;目前用于表征肿瘤微环境免疫景观的方法主要依赖于大量基因表达谱,例如Bindea等人首次证明了从复杂的细胞混合物的基因表达谱中推断免疫细胞浸润的可能性,揭示了人类肿瘤中的免疫蓝图。
目前应用的有多种工具如CIBERSORT(推断总白细胞群中免疫亚群的相对比例),xCell(预测整个肿瘤微环境中免疫细胞的丰度),TIMER(根据免疫和基质细胞类型的比例产生富集评分),但是这些技术的局限性是样品变异性,RNA提取步骤的不一致性,将转录物明确分配给特定细胞类型的不可能性,以及来源于血液和肿瘤微环境中的免疫表型之间的差异。
目前的免疫荧光发射断层扫描(PET)成像检测肿瘤内CD8+T细胞的非侵入性诊断程序非常具有前景。研发能实时动态准确地检测肿瘤内以及体内不同免疫细胞亚型及丰度的非侵入性诊断设备及相关方法,将具有巨大的临床应用价值,并将极大的推动肿瘤免疫治疗的发展。
不同免疫疗法或免疫疗法与其它疗法组合运用时必须仔细考虑免疫及其组合疗法的重叠毒性,这一点尤其重要需要我们重点关注和深入研究。
最佳免疫及其组合疗法需要进一步开发和鉴定出一些敏感的生物标志物,以指导那些从免疫检查点调节剂中获益最多的个体,并尽量减少那些不太可能产生反应的个体的不必要的毒性,通过不同生物标志物的开发来预测相关组合疗法的毒副作用。
不同的生物标志物及其不同的组合可能在肿瘤免疫治疗的不同阶段和不同时间发挥预测作用,对于疗效、毒副作用等具有重要的指导意义。例如目前大家比较关注的是肿瘤PD-L1表达和肿瘤突变负荷(TMB),两者均已显示可预测抗PD-1反应。最近研究表明接受了抗PD-1和抗CTLA-4联合阻断治疗的非小细胞肺癌(NSCLC)患者,肿瘤突变负荷(TMB)已被证明是客观反应,持久益处和无进展生存期(PFS)的强预测因子。同样能增强TMB和新抗原负荷的MMR缺陷也是抗PD-1抑制剂疗效的显著预测因子。 该生物标志物最初用于预测结肠癌子集中的反应,现在已经应用于所有肿瘤类型。
最新研究数据表明,预存的高质量的T细胞可以预测慢性淋巴细胞白血病患者对嵌合抗原受体(CAR)T细胞治疗的反应,例如那些富含早期记忆CD8+T细胞(CD27 + CD45RO-)的病人显示出对CAR T细胞疗法的完全或部分反应,而不含这些细胞的患者就不反应。
相关研究发现应答者与无应答者的转录组分析表明,存在于应答者中的CAR T细胞富含调节早期记忆和效应T细胞的相关基因转录,并具有IL-6 / STAT3基因特征的基因,而无反应者表达的基因主要参与晚期T细胞分化,糖酵解,衰竭和凋亡。
以上研究充分说明我们有必要进一步研究评估免疫疗法之前和之后T细胞的质量,因为越来越多的证据证明影响整体抗肿瘤免疫应答的不仅仅是浸润肿瘤的T细胞数量,而且还和T细胞的质量密切相关。
总之,生物标志物开发的范围正在多样化和扩大,并且多种生物标志物可能累积地预测对单一和组合免疫疗法的反应。
——肿瘤免疫及其组合疗法面临的困难及癌症治疗的可行策略——
虽然目前某些免疫及其组合疗法在恶性肿瘤治疗中体现了令人鼓舞的临床效果,但恶性肿瘤的治疗中采用免疫治疗的临床适应证还较为局限,多用于术后防止肿瘤复发、晚期肿瘤姑息性治疗、手术治疗不彻底及无法耐受手术的患者,而且很多是在采用常规治疗或药物失败以后疾病进展的患者,因此同传统放化疗及靶向治疗相比,免疫治疗仍处于相对辅助地位,目前虽然有免疫及其组合疗法用于一线治疗,但是其适应范围和适应症还较为局限。
此外目前在临床阶段开展的组合疗法有不少还具有盲目性、尝试性以及经验性,由于没有很好的组合思路、策略和方法其科学性和合理性也因此受到了质疑,此外,采用何种临床疗效评价标准对此类组合治疗方案进行评估仍存在争议,而且联合疗法通常会带来更多的不良反应,如何通过相关手段来评价相关组合疗法的效果和副作用还具有一定的难度。
从前面我们的分析可以看到,癌症的发生、发展及转移是一个动态和复杂的过程,在这一过程中参与和影响因素很多,机体整体机能变化与局部变化都会影响癌症的进展,这些都决定了恶性肿瘤治疗的复杂性和难度,因此要想依靠单一药物、治疗方法或手段达到恶性肿瘤的彻底治愈还很困难。
未来免疫治疗及其不同疗法的组合将在恶性肿瘤的治疗中发挥及其重要的作用。因此关于恶性肿瘤的治疗,需要通盘考虑,整体设计,因为每一种治疗方式都有其自身的优势和不足。
例如癌症治疗中的手术疗法在某些肿瘤和早期癌症中发挥了重要的作用,但是手术创伤造成的炎性微环境同样是促进癌症转移的一个重要的因素,因此手术后应用免疫疗法进行干预,对于癌症的转移和复发具有重要的意义。
化学疗法在癌症治疗中发挥了重要的作用,但是目前常规的化学疗法不仅杀伤癌细胞,也对正常免疫细胞也有杀伤,而肿瘤干细胞可能会抵抗化学药物的作用,如何在化疗过程中快速重建我们的免疫系统来对抗肿瘤干细胞,防止癌症复发是癌症治疗过程中需要考虑的一个重要的问题,过继性细胞疗法也许会在这一过程中发挥重要的作用。
此外目前最新开发的仅靶向癌症细胞的化疗药物对于减少副作用,降低药物对人体正常免疫细胞的损伤具有重要的临床价值。
现有的肿瘤靶向治疗药物具有精准、副作用较常规化疗方法低的特点,在某些特定位点突变的癌症中具有较好的效果,发挥了重要的作用,但是单一的靶向药物治疗一段时间以后会出现耐药的问题,靶向药物耐药的原因是多方面的,同靶基因在不同环境和刺激下,表达水平和方式的改变有关,也可能和靶基因的再次突变,导致靶点构像改变有关。
靶向药物耐药以后开发新的靶向药物是目前的一个方向,但是新药物开发的周期长、风险大,对目前已有老药的鉴定筛选应该是一种可行的办法。
单一靶点的靶向药物耐药后开发新的靶向药物如果还采用同样的策略难免还会出现同样的耐药问题,靶向药物和不同免疫治疗药物及方法配合使用能否发挥一定的作用也是需要我们关注和研究的一个问题。此外利用系统生物学的药理学分析方法开发针对多靶点和信号通路的靶向药物具有较大的潜力。
人体是一个有机联系的整体,癌症的治疗是一个长期、动态、综合的过程,仅仅针对某一基因、蛋白或特定细胞的治疗可能引起体内复杂的生物学效应,使得癌症治疗的效果降低甚至产生负面作用。
因此,我们在深化局部和微观研究的同时也需要重视局部与机体其他部分间的相关性研究,重视遗传,微生物群,生活方式和环境因素对于恶性肿瘤发生、发展的影响,将机体作为一个普遍联系的整体加以研究,有利于把握肿瘤的本质和其发生发展的规律。
不同的癌症治疗药物、治疗方法和治疗手段也有其适用时机、范围和组合规律,随着人们对不同药物、治疗方式和治疗手段的深入理解,随着癌症研究大数据的积累和相关分析手段的建立和开发,通过不同免疫治疗药物、方法和手段的有机结合和搭配,形成联合、序贯的癌症整体治疗方案,将有望进一步降低药物治疗的副作用,增强疗效进而提高恶性肿瘤患者的生活质量和总生存率。