《2019 CSCO乳腺癌诊疗指南》重磅发布:新增NGS、液态活检、人工智能等内容
2019版《指南》在术前新辅助治疗、术后辅助治疗、晚期乳腺癌的解救治疗等方面进行了更新。同时,乳腺癌专家委员会也计划制作指南的科普版,让患者及家属能够了解目前乳腺癌的诊疗现状。
中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2019指南制定组
组长:江泽飞教授
副组长:宋尔卫教授、吴炅教授、王翔教授、张清媛教授、殷咏梅教授
数据统计显示,每年全世界约有140万人被诊断为乳腺癌,而大约有50万人死于该病。我国仅2015年新发乳腺癌病例就已高达27.2万,死亡病例数约7.1万。其中,在新发乳腺癌病例中有3%~10%的女性在确诊时,就有远处转移。即便是在早期乳腺癌患者中,也有30%~40%可发展为晚期乳腺癌,且5年生存率仅为20%。
2019版《指南》在乳腺癌术前新辅助治疗方面,强调仅以HER2阳性或三阴性作为乳腺癌术前新辅助药物治疗选择的标准时,肿瘤应大于2cm;或参加严格设计的临床研究。对于经足疗程新辅助治疗后仍未达到pCR的患者,术后可考虑强化治疗。
在乳腺癌的术后辅助治疗方面,新增了基因检测对辅助治疗决策的重要作用。HER2阳性乳腺癌患者中,强调了AC-TH+P的双靶向可作为高危患者推荐治疗;激素受体阳性乳腺癌的辅助内分泌治疗中,绝经前患者辅助内分泌治疗,对于已完成OFS+AI治疗且耐受性良好的患者,若此时已绝经,可考虑使用AI延长治疗。
在晚期乳腺癌的解救治疗方面,2019版《指南》重申了曲妥珠单抗和紫杉类再使用的获益人群;指出了帕妥珠单抗在晚期HER2阳性乳腺癌患者中的重要作用;增加了吡咯替尼联合卡培他滨作为抗HER2二线治疗的推荐方案,突出了国产新药在乳腺癌治疗领域的地位和作用;同时还提高了氟维司群在激素受体阳性患者中的治疗地位,强调了CDK4/6抑制剂联合内分泌治疗的作用。

从2017年首次发布至今,CSCO乳腺癌专家委员会制定的指南紧跟国际最新的科学进展,把吡咯替尼、CDK4/6等纳入指南,还增加了循环肿瘤标记物、人工智能等章节,涵盖了液态活检、二代测序、智能影像、智能病理和智能决策等领域。
主要更新内容如下:
一、乳腺癌的诊断及检查



更新要点:
替换“建议对初次检测为三阴性乳腺癌重新复核免疫组化指标”为“对初次检测为三阴性乳腺癌,应采取标准诊断方法对ER、PR、HER-2进行复核。”
二、乳腺癌的术前新辅助治疗



更新要点:
删除“HER-2阳性患者无论是否达到pCR,推荐术后应继续使用曲妥珠单抗,总疗程达一年”,将相应内容调整至HER-2阳性术前治疗章节内。
将“根据术前分期、病理细胞学分级、经充分考虑后,可予术后辅助卡培他滨治疗”,更改为“根据CREAT-X研究结果,术后可基于6-8周期的卡培他滨治疗”。

更新要点:
II级推荐:删除“部分具有高危因素的患者,可考虑进入双靶向临床研究”。
TCbH由I级推荐调整为II级推荐。

更新要点:
替换“无须手术的激素受体阳性患者”为“无须即刻手术的激素依赖型患者”。
增加“部分不适合芳香化酶抑制剂的患者(如骨密度T
三、乳腺癌的术后辅助治疗

更新要点:
肿瘤相关评估增加“70基因MammaPrint”。

更新要点:
II级推荐替换“双靶向治疗如帕妥珠单抗联合曲妥珠单抗”为“AC-TH+P”。
增加“TH+P双靶向治疗的安全性在新辅助、辅助及一线治疗阶段都得到了验证,但TCbH+P的安全性数据不足,因此不做推荐”。



更新要点:
初始治疗以OFS+TAM作为I级推荐适应症删除“或有辅助化疗指征,但不愿接受化疗患者”。

更新要点:
延长治疗完成OFS+AI治疗,耐受性良好者,“绝经者适应AI治疗”由II级推荐调整为I级推荐。

更新要点:
保乳术后增加导管原位癌术后放疗。
腋窝淋巴结阴性调整为“I级推荐”。

四、晚期乳腺癌的解救治疗

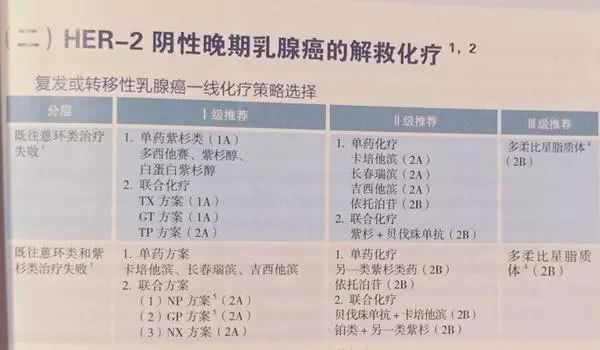

更新要点:
抗HER-2一线治疗I级推荐中,NH证据由1A调整为2A,由I级推荐调整为II级推荐。
抗HER-2二线治疗II级推荐H+更换化疗药调整为III级推荐,T-DM1证据由1B调整为1A,增加吡咯替尼联合卡培他滨。
更新要点:
未经内分泌治疗I级推荐中农氟维司群与AI顺序对调;II级推荐中联合CDK4/6抑制剂证据级别由1B调整为1A。
TAM治疗失败I级推荐中农氟维司群与AI顺序对调;II级推荐中联合CDK4/6抑制剂证据级别由1B调整为1A。
AI治疗失败II级推荐中甾体类AI+依维莫司(限非甾体AI治疗失败患者)调整为III级推荐;II级推荐中联合CDK4/6抑制剂证据级别由1B调整为1A。
五、乳腺癌骨转移(无要点更新)
六、乳腺癌脑转移(无要点更新)
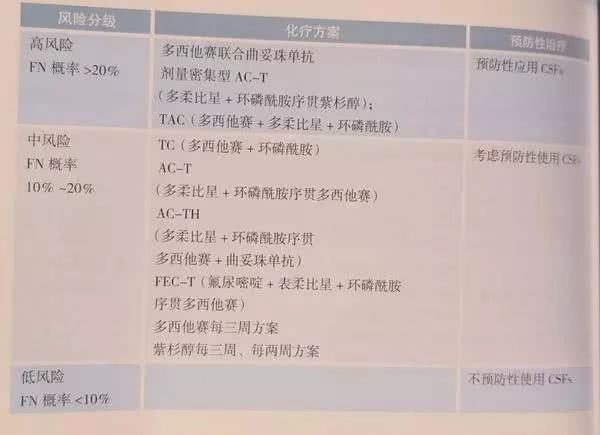
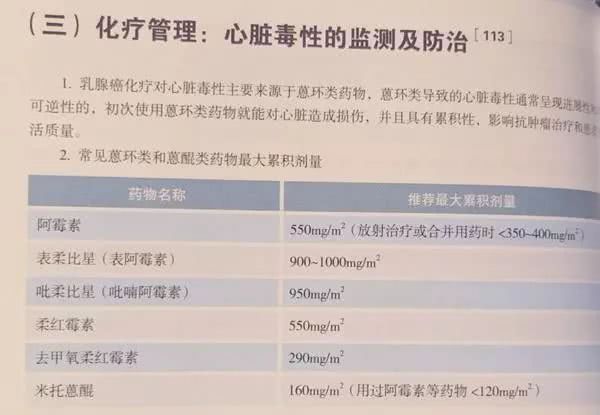
七、乳腺癌的治疗管理


更新要点:
化疗急性或延迟性呕吐预防增加“针剂/口服/透明贴片(格拉司琼)”,删除甲氧氯普胺(胃复安)。

八、循环肿瘤标记物和二代测序(新增)
1. 循环肿瘤细胞(CTC)
CTC是指从恶性肿瘤原发部位脱落。通过血管或淋巴系统进人血液循环的细胞,它能够反映肿瘤组织的情况,也可以用无创方式替代组织样本进行病理诊断、疾病监测、分子测序等。不仅可以动态监测,还可以用于判断预后。随着对(随着对CTC认识的拓展,其应用已经从数目走向了分子分型和细胞测序时代。
AJCC第8版乳腺癌分期系统明确早期乳腺癌患者CTC≥1个/7.5ml提示预后不良。此外,已有研究验证了CTC HER-2状态可以预测患者靶向治疗的疗效,而随着单细胞测序技术的进步,可以让研究者利用CTC从基因组或转录组水平探究肿瘤内部机制。了解发病原因及耐药机制, 甚至有机会预测耐药的发生。
2. 循环肿瘤DNA (ctDNA)
ctDNA是由肿瘤细胞、循环肿瘤细胞等调亡、坏死后释放到血管中的游离的DNA片段组成的。这些DNA片段通常与蛋白质结合形成核小体游离于循环中。ctDNA 的降解可能与肝脏和肾脏代谢相关,根据不同DNA片段大小,结构及半衰期差异较大,范围从10min至2h不等。
ctDNA能够反映短时间体内瘤负,实时动态监测药物疗效,同时在保证较高敏感性和特异性的同时能够提早预测病情变化,在早期诊断、肿瘤负荷监测、药物疗效预测、复发转移风险评估和预后分析等发挥重要作用。但由于ctDNA在血液中约只有千分之几,从大量游离DNA、血细胞中筛选出肿瘤相关DNA仍存在一定难度。与此同时,ctDNA 检测技术对实验室和操作人员要求较高,检测设备昂贵,检测标准不一,目前临床应用受限。
3. 二代测序(NGS)技术
NGS是为克服第一代测序技术存在的相对弊端,经过不断的技术开发和改进,从而开发的一种可以大规模并行的高效测序方法,为我们解释肿瘤的发生与发展中发挥了重要作用,NGS与一代测序检测结果高度一致,但在检测时间和检测通量上却更有优势,能够以较少的成本进行大量的DNA/RNA测序,可以同时筛选多个样本中的多个基园,也可以快速检测肿瘤异质性和基因改变。该技术不需要通过对患者组织的侵入性活检,就可以达到帮助早期诊断、疗效监测、耐药提示以及治疗方案的选择。
但对于晚朝患者,获取组织的成本较高,而肿瘤异质性的存在,也难以动态检测患者的基因突变。与此同时,NGS在数据获得过程中会产生不同类型的错误,例如替代、 插入/缺失、AT偏差、GC缺失等都影响了其临床应用。在未来,结合CTC、 ctDNA及NGS甚至三代测序技术,将会为肿信患者提供更好的服务。
九、人工智能(新增)
人工智能是精准医学时代重要的发展方向,大数据的发展,医疗资源的紧缺、诊疗模式的转变为人工智能发展提供了很大的机遇,目前,人工智能已在医学影像、病理、辅助决策系统得了一定的进展。
1. 智能影像助力肿瘤诊断与治疗评价
在乳腺癌领域中,智能影像已经在病变诊断、疗效评价甚至预测分子分型中取得了一定的研究成果。有研究显示,智能在诊断良恶性病变方面。仅次于具有20年丰富经验的乳腺放射科医生对平扫及增强图像的综合判断结果。此外,也有研究显示临床信息结合动态增强的3D影像信息可以作为生物标志物来鉴列乳腺癌的分子亚型,特别是对于三阴性乳腺癌的预测。应用AI辅助诊断能够帮助医生更加快捷和准确地对疾病做出诊断,提高诊断效率及准确度。
2. 智能病理加速肿瘤的定性和定量判断
目前,智能病理已用于乳腺癌等多种肿瘤中,应用范围集中于细胞学初筛、良恶性鉴别、形态定量分析、组织学分类等方面。如有研究对乳腺癌切除标本进行了自动HER-2评分,结果显示与病理医师诊断结果有很高的符合率。在分子病理方面,在海量的基因组学信息中,应用人工智能分析技术,已成为精准医学不可或缺的发展要素。智能病理的发展应用不但能减轻病理医师负担。在一定程度上也可以弥补病理科医生主观分析的不足,提升病理的定性和定量判断,提高病理诊断的准确度,还能为思者提供个性化的治疗意见和疾病预后判断,推动精准病理的发展。
3. 智能决策丰富临床实践的决策模式
智能决策系统的研发就是能够结合人工智能的学习分析能力及专家的经验,从而得到更加准确的决策方案。CSCO BC协作组完成了一项2000份病例的人工智能决策和专业医生决策的对比研究。研究结果显示WFO ( Watson for oncology )智能决策在乳腺癌治疗中展示出较好的可行性和规范性。帮助临床医生省时省力,辅助应用可进一步提高医生决策的规范性。同时,具有我国自主产权的智能决策系统也取得初步成果,基于CSCO BC大数据和CSCO BC指南的乳腺癌智能决策已完成II期试验,提示基于CSCO乳腺癌诊疗指南的智能决策系统在不同类别、不同阶段的乳腺癌病例中显示出良好的决策规范性。
人工智能是重要的发展方向,智能系统不仅可以帮助临床医生节省时间和精力。还有希望进一步提高肿瘤的精准诊断与治疗,因此专家组鼓励开展人工智能相关的临床研究,发展我国自主产权的人工智能系统。
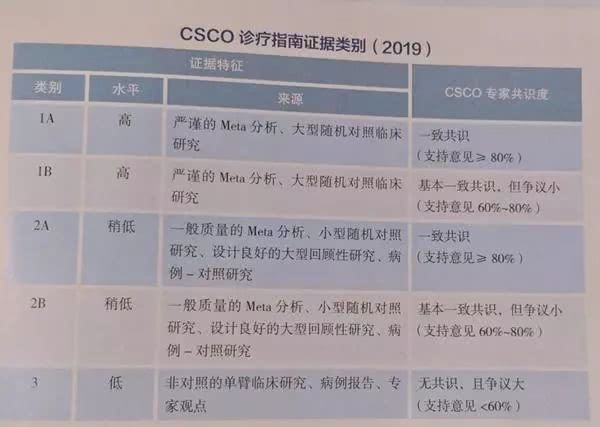
指南证据类别及推荐等级划分如下: