Cancer Cell:改变力学环境提高 VEGF 抑制剂抗癌效果,开辟癌症治疗新领域
作为生命科学最前沿的交叉领域,生物力学自诞生以来就无时无刻不在告诉着我们世界上那些最基础的物理学特性是如何塑造我们的人体以及造成我们疾病的发生。而血液,这种每分每秒在我们体内流动的物质,使得血管细胞成为对机械力最敏感的一种细胞之一。 近年来,关于机械力对血管细胞影响的研究也频频登上顶级期刊。
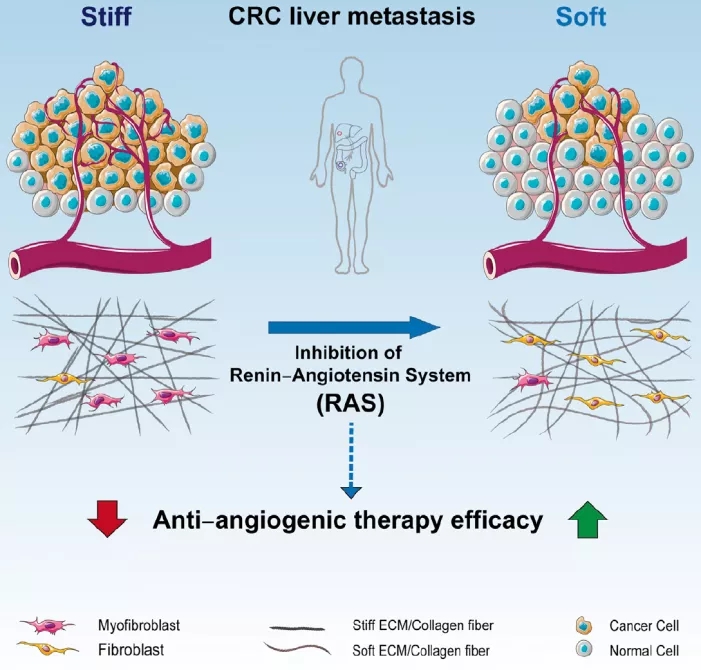
2020 年 6 月 8 号,来自德国海德堡大学的 Thomas Schmidt 教授 带领团队在癌症领域顶级期刊 Cancer Cell Reduction of Liver Metastasis Stiffness Improves Response to Bevacizumab in Metastatic Colorectal Cancer 的研究 [1] ,首次揭示了转移相关成纤维细胞 (Metastases-associated fibroblasts, MAFs) 通过改变肿瘤的力学环境作用于血管细胞,并导致血管生成和转移瘤生长的全新机制 ,并提示了通过抑制肾素 - 血管紧张素系统 (RAS)来改变肿瘤的力学环境并以此改善抗 VEGF 药物癌症治疗效果的可能 。
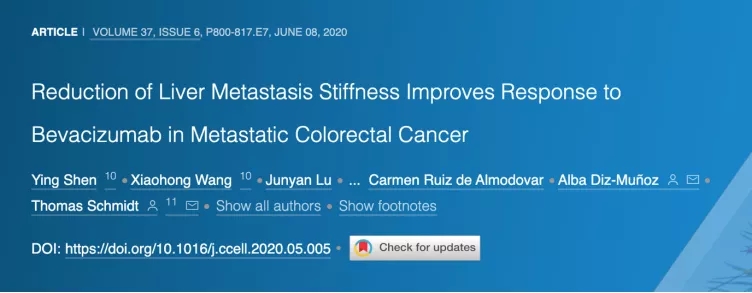
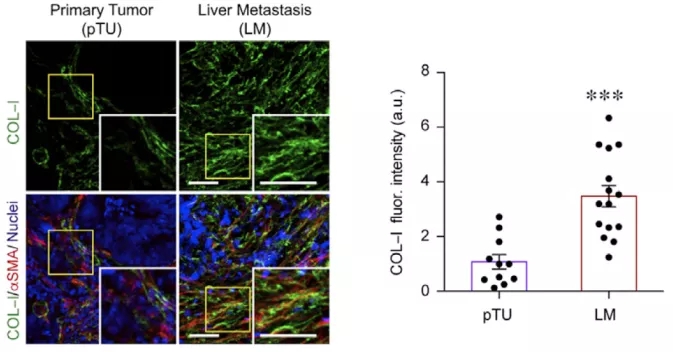
成纤维细胞能够大量分泌细胞外基质(ECM)以改变其硬度,并以此改变组织的力学特性 。研究人员从结 直肠癌 患者的原位瘤和肝转移瘤入手,在肝转移瘤中发现一种以高表达 aSMA,p-MLC2 和 COL-1 为细胞印记的成纤维细胞,研究人员称这些细胞为转移相关成纤维细胞 (Metastases-associated fibroblasts, MAFs)。进一步研究发现,MAFs 能够合成更多的细胞外基质,造成了更多黏着斑(Focal Adhesions)的形成。这些证据证明这种 MAFs 在转移瘤中被高度激活。 研究人员随后使用 RNA-seq 对比了结 直肠癌 患者的原位瘤和转移瘤基因表达印记,并发现后者的整联蛋白(Integrin)信号通路被高度激活,而整联蛋白恰好是传导机械信号的重要的细胞质受体,其激活会导致肿瘤恶性的增加。此前有报道证明,整联蛋白通路的激活能够通过影响成纤维细胞来重塑肿瘤内的细胞外基质(ECM)组成。因此,作者随后对比了原位瘤内肿瘤相关成纤维细胞 CAFs 和转移瘤内 MAFs 的基因表达印记 。多个生物信息学分析工具表明 MAFs 中的肌成纤维细胞分化、ECM 重塑、肌动蛋白调节的细胞收缩、黏着斑以及血管生成等多种特征与 CAFs 呈现出明显的不同。
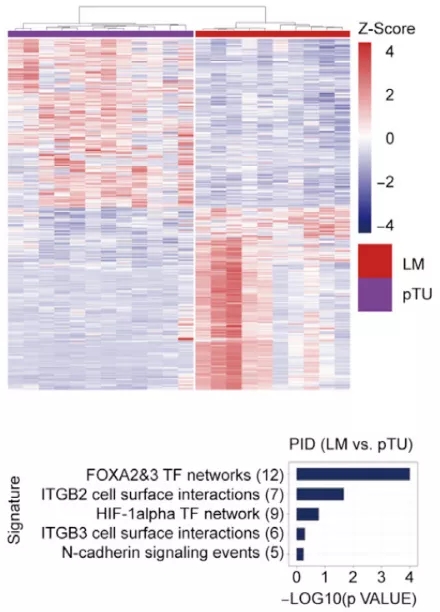
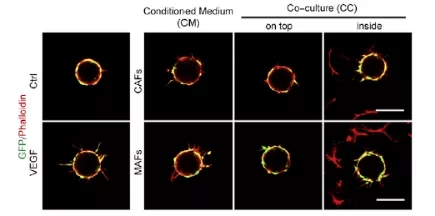
在确认了 MAFs 在肿瘤中被激活之后,研究人员使用分离出的 MAFs 进行了一系列细胞实验,并证明 MAFs 具有更密集和复杂的肌动蛋白结构以及更高的收缩性。与此同时,原子力显微镜结果显示转移瘤的的 α-actin 表达和组织硬度较原位瘤更高,且一系列与成纤维细胞激活相关的基因与组织硬度呈现线性相关,证明成纤维细胞的激活可能是组织硬度升高的原因。于此同时,肿瘤内血管的产生也会基质硬度呈现出显著的相关性,这与此前被报道的基质硬度促进血管生成吻合。进一步研究发现,ΜΑFs 和血管内皮细胞(ECs)共同培养能显著促进血管生成,且这种促进需要通过 ECM 重塑来实现。
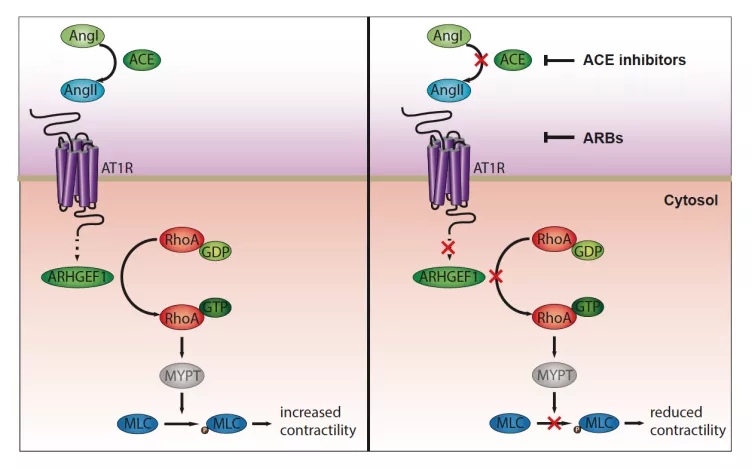
进一步分析 MAFs 的基因表达发现这些细胞内肾素 - 血管紧张素系统(Renin-Angiotensin System,RAS)相关的多个基因出现了明显的上调,而 RAS 此前被报道与肝纤维化有关。抑制 RAS 能够显著降低 MAFs 所提高的细胞收缩性。这证明 RAS 与 MAFs 的激活有关 。
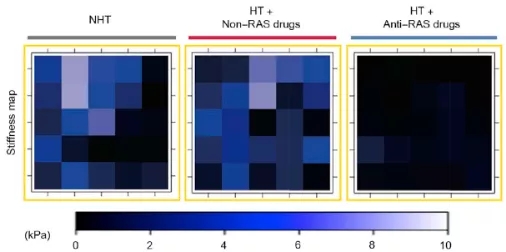
由于抗 RAS 药物是高血压的常用药,作者将此前的结 直肠癌 患者队列在细分为 3 个组:1)无高血压组,2)高血压未服用抗 RAS 药物组,3) 高血压服用抗 RAS 药物组 。原子力显微镜结果显示因高血压接受抗 RAS 药物治疗的结 直肠癌 肝转移瘤内的细胞外基质硬度显著低于其他两个组,而多种 MAFs 激活标记物以及 ECM 堆积都也在接受抗 RAS 治疗后出现了显著的降低。
通过在细胞实验使用 RAS 抑制剂,研究人员发现在 RAS 是通过 RAS/AT1R/ARHGEF1/RhoA/MLC2 这一条完整的通路来调节 MAFs 的收缩性和 ECM 的合成 。
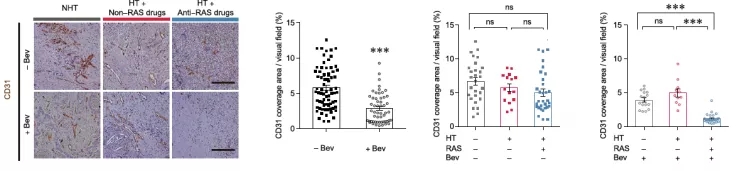
由于之前作者验证过 MAFs 所增加的肿瘤硬度能够促进血管生成以帮助转移瘤生长,所以他们进一步探究了通过抑制 RAS 能否改善抑制血管生成的抗 VEGF 药物贝伐单抗 在结 直肠癌 的治疗作用。对于因为高血压同时接受抗 RAS 和贝伐单抗 治疗的结 直肠癌 患者,尽管他们体内转移瘤的硬度较仅接受抗 RAS 治疗的患者没有显著差别,抗 RAS 治疗能够显著强化贝伐单抗 抑制血管生成的效果 。
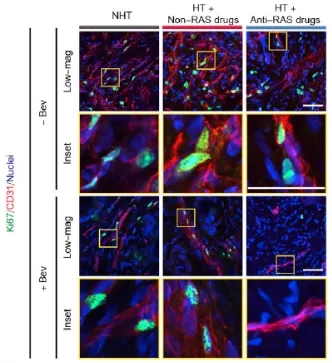
随后,研究团队用一系列体外和体内实验证明了 RAS 抑制剂与贝伐单抗 联用可以通过抑制血管内皮细胞增殖来实现抑制血管新生的作用。
另一方面,作者也发现在同时接受抗 RAS 和贝伐单抗 治疗的患者的转移瘤内,血管的完整性较之仅接受单一治疗的患者更好 ,细胞之间紧密连接蛋白 ZO-1 表达也更高。与此同时,联合疗法也能显著提高血管内皮细胞中剪切力相关的转录因子 KLF2 的表达,作者认为这与肿瘤内力学属性的变化有关。
由于 YAP/TAZ 通路此前被报道与 VEGF 介导的血管新生以及基质硬度有关,研究人员也检验了 YAP/TAZ 在他们的发现中是否起作用。结果显示,抗 RAS 和贝伐单抗 联合治疗能显著降低 YAP/TAZ 的入核,并以此降低血管生成 。证明肿瘤硬度导致的血管生成的变化与 YAP/TAZ 有关。
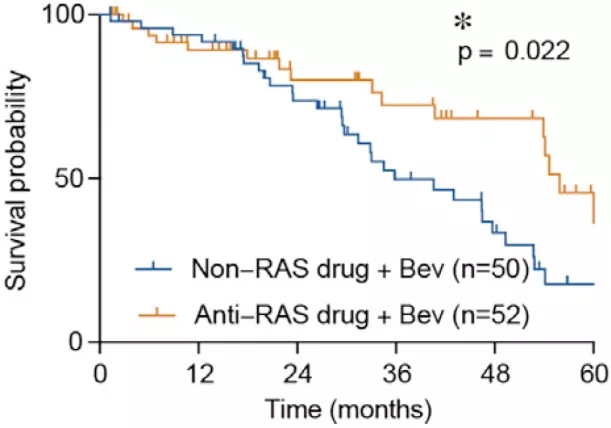
最后,研究人员在临床层面评估了抗 RAS 和贝伐单抗 联合疗法在结 直肠癌 治疗的作用,并发现较之仅接受贝伐单抗 治疗的患者,联合疗法能够显著改善患者的存活。该结果也为这个研究提供了直接的临床价值 。
这是首个发现转移瘤中的成纤维细胞通过改变细胞外基质的硬度来影响肿瘤内血管新生的研究,并提出了如何利用抗 RAS 疗法来降低肿瘤硬度并以此提高抗 VEGF 治疗疗效的可能 。与此同时,作者还通过大量数据在细胞与分子层面揭示了 RAS 抑制剂如何影响 MAFs 以及联合疗法如何通过 YAP/TAZ 影响血管内皮细胞的增殖和细胞间的紧密连接。对于接受贝伐单抗 治疗的结 直肠癌 和肺癌 患者,贝伐单抗 治疗本身就能诱发高血压。在该研究中并未对与贝伐单抗 无关的高血压及贝伐单抗 导致的高血压进行区分。有可能抗 RAS 药物与贝伐单抗 的协同作用与贝伐单抗 治疗导致的高血压有关。为了回答这个问题,需要研究其他降压药物 能否与贝伐单抗 产生协同作用。另一方面,由于很多其他癌症的转移瘤都伴随着大量 ECM 产生,它们所导致的肿瘤硬度的增加在其他肿瘤的作用也值得进一步研究。
血管内皮细胞由于血流的影响,是最容易受机械力影响的细胞类型。十多年来,关于血管内皮细胞机械传感器 研究在心血管领域一直是大热门。
今年 2 月,来自牛津大学的 John S. Reader,E. Yvonne Jones 和 Ellie Tzima 联合带领的团队就发现了内皮细胞中名为 Plexin D1 蛋白是一种机械感受器 ,该研究以《The guidance receptor plexin D1 is a mechanosensor in endothelial cells 》发表在 Nature 上 [2] 。
而另外两个经典的机械感受器 Piezo 1 和 Piezo 2 在 2010 年首次被来自细胞感知领域的泰山北斗 Ardem Patapoutian 教授在 Science Piezo1 and Piezo2 Are Essential Components of Distinct Mechanically Activated Cation Channels 》为题报道后 [3] ,更是迅速成为了 CNS 的常客,每年都能看到不少关于 Piezo1 和 Piezo2 的研究发表三大顶刊之上。
而本次 Cancer Cell Role of YAP/TAZ in mechanotransduction 》为题发表在 Nature [4] ,该论文引用已经接近 2000。
之前关于细胞机械传感器的医学相关研究主要集中在心血管疾病领域,本次 Cancer Cell
1. Shen, Y., et al., Reduction of Liver Metastasis Stiffness Improves Response to Bevacizumab in Metastatic Colorectal Cancer. Cancer Cell, 2020. 37(6): p. 800-817.e7.
2. Mehta, V., et al., The guidance receptor plexin D1 is a mechanosensor in endothelial cells. Nature, 2020. 578(7794): p. 290-295.
3. Coste, B., et al., Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels. Science, 2010. 330(6000): p. 55-60.
4. Dupont, S., et al., Role of YAP/TAZ in mechanotransduction. Nature, 2011. 474(7350): p. 179-83.
相关标签:
靶点药讯| 纵览全球药物靶点动态 科研 | Immunity:肿瘤浸润性NK细胞的单细胞RNA测序揭示了转录因子HIF-1α的抑制释放了NK细胞活性