另类免疫疗法的悄然崛起!细胞免疫、肺癌疫苗、新免疫检查点三大新星!
前言
PD1/DPL1免疫治疗盘踞了我们目前我们肿瘤治疗各个角度,让我们看到了传统毒性杀伤之外,利用自身免疫本能来诱导增强的天然愈癌方式,PD1/PDL1也被患者朋友们简称为免疫治疗。但大家不清楚的是,人体的免疫机制非常地复杂,相应的免疫治疗的概念也非常地宏大,远不是目前我们熟知的PD1/PDL1而已,而以免疫检查点为起点,我们逐渐挖掘出更大的免疫治疗空间,更研发出更多的免疫治疗产品和药物。今天几位大家盘点一下,近期大会和国外传来的免疫浩瀚海洋的一些好消息。免疫时代在崛起,期待生命奇迹。
细胞免疫疗法
依赖于人体的细胞免疫机制,我们提取参与人体内免疫监控系统的免疫细胞细胞T细胞、体外编辑加工,导入能够特异结合肿瘤细胞某一特征抗原的基因组段,进行体外修饰整合,扩增后回输体内发挥定向细胞免疫杀伤能力,经典治疗产品CART、TCT,被广泛应用于血液肿瘤的治疗中并获得奇效,而实体瘤由于缺乏极其典型的特征抗原而研发迟缓,但是近几年包括今年ASCO大会依然有新产品数据现世,给了我们无限遐想。而除了“编辑”T细胞外,我们还可以提取“精英”T细胞,即所谓的TIL治疗法,将手术切除的肿瘤组织中的淋巴细胞分离纯化,挑选出其中能特异性抗癌的淋巴细胞,扩增活化后回输。这类疗法拥有30多年的历史,最早用于恶性黑色素瘤,近年来在宫颈癌、肺癌等多种实体瘤中都给出了不俗的数据。一起围观一下细胞免疫产品带来呃“amazing”疗愈世界。
一、2019ASCO:TIL产品LN415治疗晚期经治宫颈癌,有效率44%,多个实体瘤现疗效患者。
2019ASCO(摘要号2583研究)公布的II期C-145-04研究,是一项正在进行的,开放标签,多中心的临床试验,评估LN-145 TIL治疗晚期宫颈癌患者的安全性和有效性。截至2019年2月4日,该研究纳入了27例宫颈癌患者,这些患者至少接受过一次化疗治疗,平均之前接受过2.6种治疗。这些患者接受了第2代的LN-145输注,输注的平均TIL细胞为28x109。患者在输注前接受一周的环磷酰胺,氟达拉滨进行预处理,清除淋巴细胞,然后接种最多6剂IL-2(600,000 IU / kg)。主要终点是客观反应率ORR; 次要终点包括反应持续时间(DOR),疾病控制率(DCR)和LN-145安全性。经过3.5个月的中位随访,发现ORR为44%,疾病控制率DCR为89%。1例患者达到完全缓解,9例达到部分缓解,2例达到未确认的部分缓解((1 CR,9 PR,2uPR))。不良事件可耐受,主要就是淋巴细胞清除和IL-2方案带来的副作用一致。
这个疗效有多猛,要知道,传统二线治疗宫颈癌的有效率仅有10%左右!
此外,2019ASCO(摘要号2518)还报道了TIL疗法LN-144治疗55例IIIC / IV期无法切除的黑素瘤患者的C-144-01研究结果,这些患者既往接受过PD-1,CTLA-4以及BRAF抑制剂治疗。发现ORR为38%(2 CR,18 PR,1 uPR),整体疾病控制率DCR为76%。
数据不够刺激?来点真实案例。
1.晚期胆管癌肝转移的患者,术后出现双肺多发转移,经过TIL细胞疗法治疗后已经被临床治愈了!
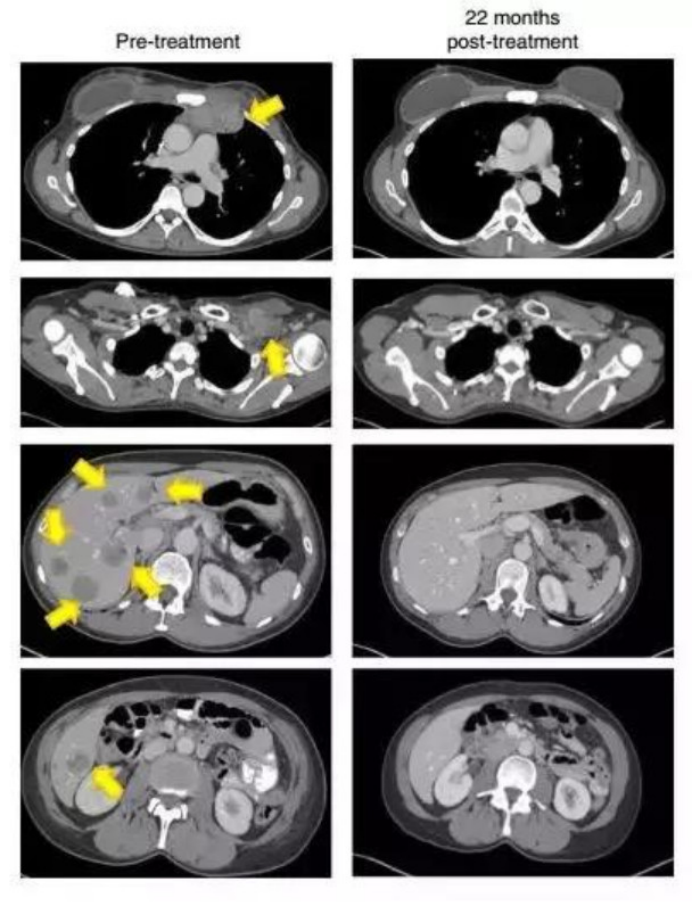
2.晚乳腺癌接受治疗22个月后,这名患者的肿瘤(黄色箭头)消失得无影无踪
(图片来源:《Nature Medicine》)
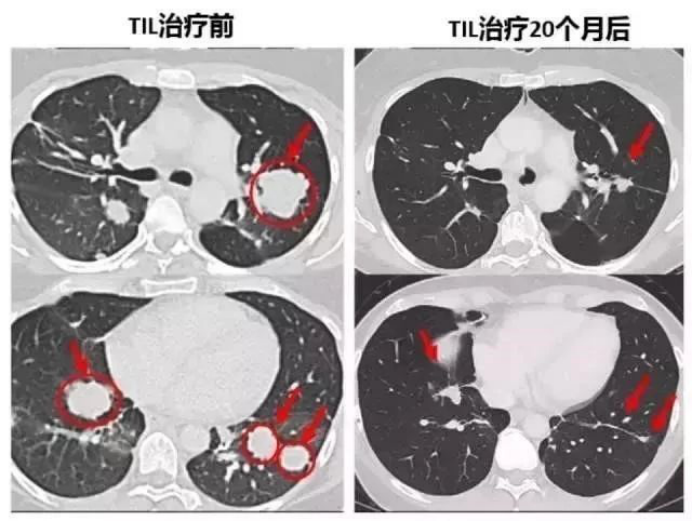
3.转移性结直肠癌患者肿瘤患者经过TIL细胞疗法治疗后,7个肺部的转移灶在几周后都变小乃至消失!
二.2020ASCO:多款CART/TCR-T产品展露实体瘤疗效
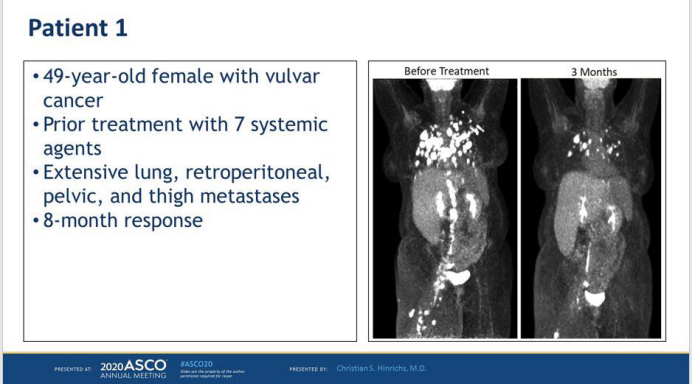
1.(摘要号:101):靶向HPV病毒的TCR-T技术用于治疗HPV感染相关的宫颈癌、头颈部鳞癌,一半患者缩小。数据显示,12例晚期HPV感染相关的实体瘤患者接受治疗,6例患者肿瘤明显缩小,有的巨大肿块出现完全缓解,其中包括4名对PD-1抗体治疗无效的患者,接受治疗后出现客观缓解。
患者为一名49岁的老年女性,外阴癌。之前用过7次全身性化疗治疗。广泛的肺部,腹膜后,,骨盆和大腿转移。经细胞产品治疗8个月后,大部分肿瘤缩小。
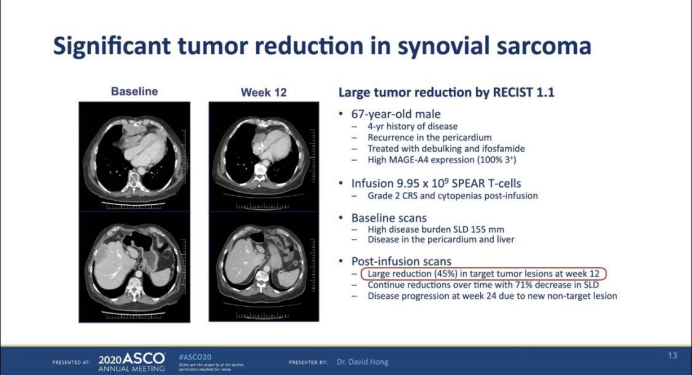
2. (摘要号:102):靶向MAGE-A4的TCR-T技术治疗该蛋白高表达的晚期实体瘤的I期临床试验数据,跨癌种入组了25名患者,接受治疗后7名患者肿瘤明显缩小、11名患者肿瘤稳定,出现疾病客观缓解的病人主要是滑膜肉瘤患者。下图为一名67岁的老年男性,有4年的疾病史,心包复发,减瘤术和异环磷酰胺治疗,MAGE-A4高表达。输了9.95*109的TCT细胞产品。基线扫描显示很高的疾病负担155mm,疾病在心包和肝脏。输液后扫描,在第12周时,靶向的肿瘤病灶大程度减少了45%。骨髓异常综合征方面在一段时间后继续减少了71%,由于新的不明靶向的病灶的出现,在第24周时发生了疾病进展。
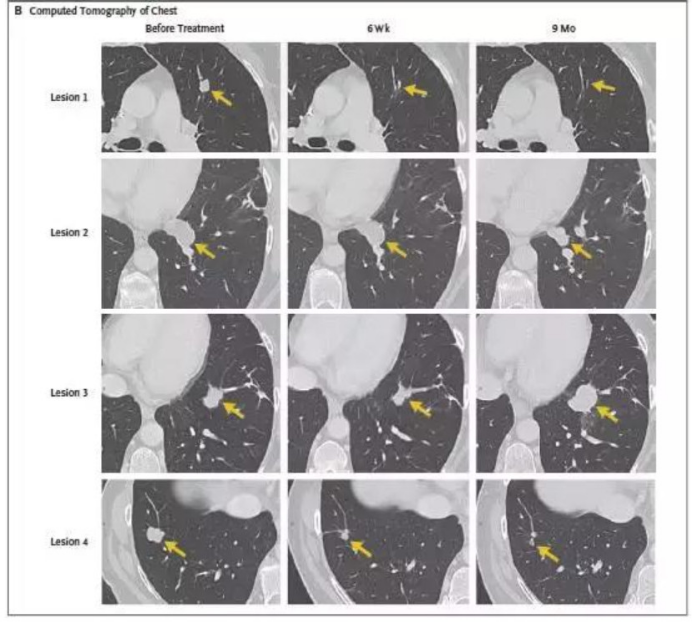
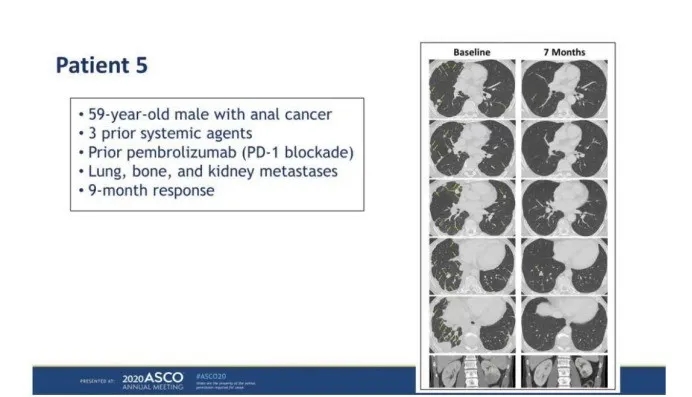
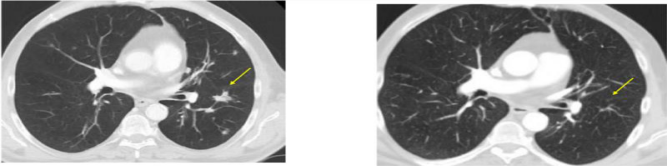
3. 靶向NY-ESO-1的TCR-T疗效也不错。下面是一例接受HPV致癌蛋白TCR-T技术后肿瘤大面积缩小、消失的肛管癌患者治疗前后的影像学片子对比图:
肺癌首个疫苗获得III期阳性结果
肿瘤疫苗是属于肿瘤免疫疗法中最新的一种治疗方式,它可以识别特定肿瘤细胞上存在的蛋白质,可以阻止肿瘤细胞生长,防止肿瘤复发,清除治疗后残留的肿瘤细胞。肿瘤疫苗通过表达特异性的、具有免疫原性的肿瘤抗原(如:多肽、DNA和RNA等),在细胞因子、趋化因子等佐剂的辅助下,激活或加强机体自身抗肿瘤免疫,进而杀伤和清除肿瘤细胞。抗癌几百年历史以来,全球对于“肿瘤疫苗”的执念一直未曾消退。终于!在今年4月1日,肿瘤疫苗Tedopi在NSCLC(非小细胞肺癌)的III期临床试验中取得了阳性结果,后线治疗的1年生存率达到46%!超过了预设的25%。而纳入的人群都是既往接受过PD1/PDL1治疗失败的患者!
Tedopi治疗真实案例分享
在已发表的案例中,一位晚期肺癌患者在经过5次的疫苗注射后,肿瘤迅速缩小(从39毫米降至23毫米),无进展生存期为4.2个月,截止文献发表时,生存期已经超过20.6个月,仍在随访中。
TIGIT/TIM3/LAG-3新免疫检查点抑制剂
免疫检查点中,PD1/PDL1只是经典的一环。但在众多的负性调控分子中,TIGIT/TIM3/LAG-3三个靶点也被认为是经典的免疫检查点抑制剂,被认为是PD1/PDL1免疫治疗的经典搭档。
一.TIGIT单抗
TIGIT 作为免疫检查点抑制剂,主要在T细胞和NK细胞表面表达,在它们的激活和成熟过程中起重要作用。TIGIT 在肿瘤免疫抑制中的作用和 PD-1/PD-L1 类似。多项临床前试验结果表明 anti-TIGIT 抗体和 anti-PD-1/PD-L1 抗体可发挥协同抗肿瘤作用。如下图,TIGIT可以在癌症免疫周期的多个步骤中抑制免疫细胞,目前国内,信达和罗氏的TIGIT抗体都接连获批临床。此次ASCO会议上,TIGIT/PD-L1也带了令人鼓舞的结果。
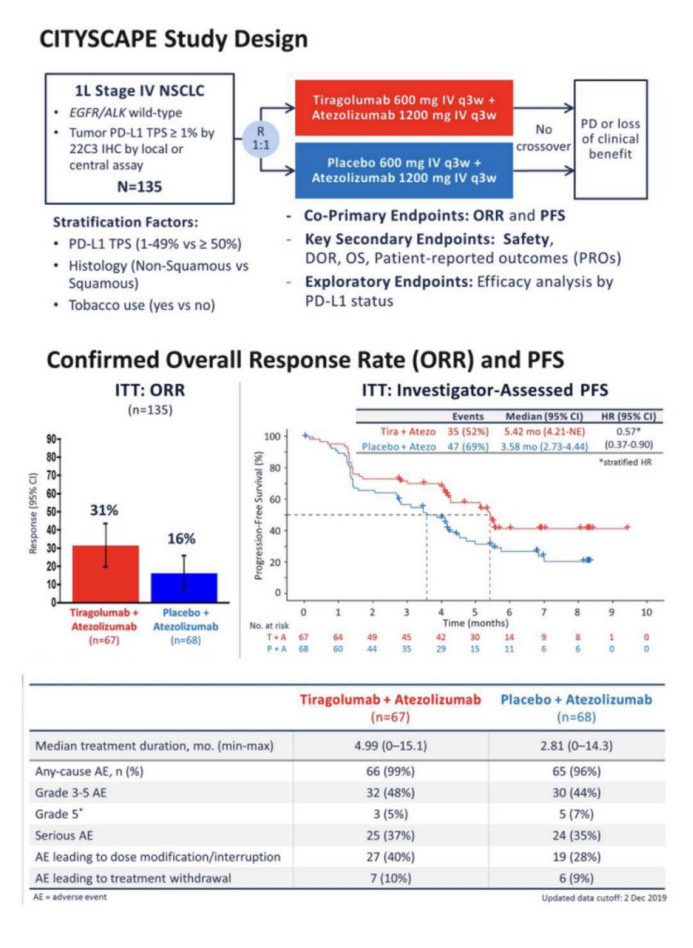
2020年ASCO值得关注的进展之一:TIGIT单抗罗氏tiragolumab的2期临床数据公布
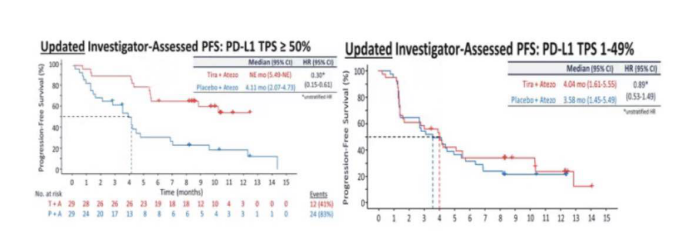
此次2020ASCO,罗氏就公布了TIGIT和阿替利珠单抗的一线联合数据。截止2019年12月,135例患者被随机分组,分别接受联合治疗或阿替利珠单抗的单纯治疗。结果显示,联合组的ORR明显优于单药组(31.3% vs 16.2%),中位PFS也获得明显延长,为5.64vs 3.9个月。更为有意义的是,联合组的毒性并未明显增加,两组3级及以上TRAE(治疗相关不良反应)发生率为48% vs 44%。
但是令人惋惜的是,该免免联合的疗效受PDL1的表达影响。在PDL1≥50%的患者群中,PFS下调了70%的进展风险。而在PDL11%-49%的患者群,PFS无统计学差异。
信达IBI939获批临床,成为首个在国内获批临床的TIGIT抑制剂
根据中国国家药监局药品审评中心(CDE)网站近日公示,信达生物研发的TIGIT抗体IBI939在中国获得临床试验默示许可,适应症为:晚期肿瘤(血液肿瘤和实体瘤)。这是首个在中国国内获批临床的TIGIT抑制剂。值得一提的是,TIGIT是继CTLA-4、PD-1之后新兴的免疫检查点抑制剂之一,全球范围内尚无针对该靶点的药物获批上市。
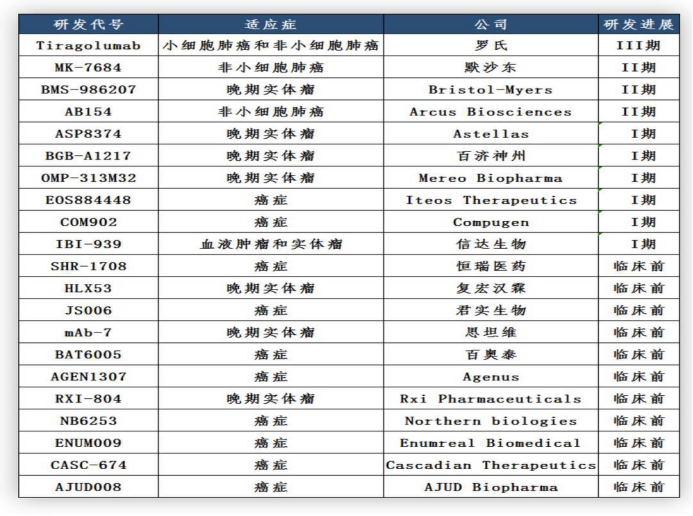
在TIGIT抗体药物小汇总
二、TIM3抗体
TIM-3(T cell immunoglobulin domain and mucin domain-3)是一类T细胞表面抑制性分子,能够引起癌症与慢性病毒感染过程中T细胞衰竭,在肿瘤细胞杀伤过程中起到重要作用,是继CTLA-4和PD-1之后免疫疗法研究领域的新兴靶点。此外,研究还表明,抗TIM-3单抗还有望与PD-1/PD-L1等抗体起到协同作用,用于治疗PD-1/PD-L1耐药的患者。
诺华TIM-3抗体在中国提交临床试验申请并获得CDE受理
2020年04月26日,中国国家药监局药品审评中心(CDE)最新公示,诺华(Novartis)在中国提交了一项MBG453的临床试验申请,并获受理。MBG453是诺华开发的一款在研靶向TIM-3受体的单克隆抗体,本次是该药首次在中国提交临床试验申请。TIM-3是免疫疗法研究领域的新兴靶点,全球范围内尚无TIM-3单抗获批,诺华的MBG453是同类药物中研究进展最快的产品之一。
但据不完全统计,全球已有约20款在研TIM3抗体研究项目,诺华的MBG453是研究进展最快的同类候选药之一。除了诺华的MBG453外,还有许多公司开发的TIM3抗体也迈入了临床阶段,包括葛兰素史克(GSK)的TSR-022、礼来(Eli Lilly )的LY3321367、罗氏(Roche)研发的RO7121661(TIM-3/PD-1双特异性抗体)等等。
三.LAG-3抗体
LAG-3:肿瘤的另一个“免疫刹车”
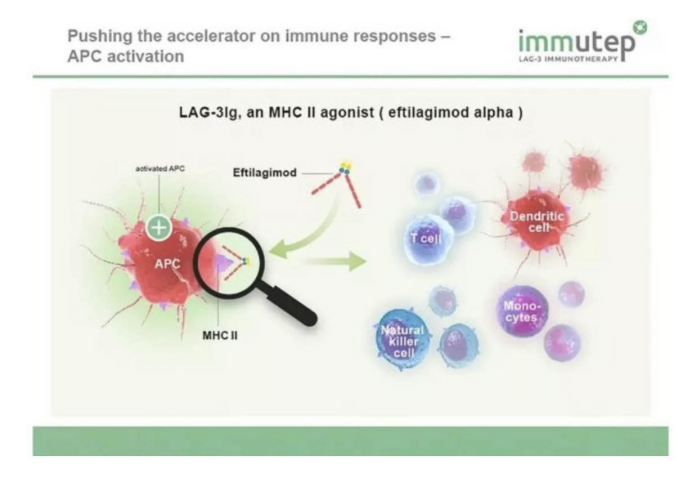
LAG3(lymphocyte activation gene 3)是一种免疫检查点受体蛋白,主要表达在活化的T细胞、NK细胞、B细胞和浆细胞树突细胞。LAG3主要通过与配体MHC II分子的结合,下调T细胞的活性。同时,LAG3也可增强调节性T细胞(Treg)的抑制活性。利用治疗性抗体抑制LAG3,可解除对T细胞的抑制,增强机体免疫应答。于是,LAG-3调节剂被研发,而immutep在研的IMP321是可溶性LAG-3融合蛋白,属于LAG-3调节剂的一种。
在多种癌症类型中,如黑色素瘤、结肠癌、乳腺癌等,肿瘤浸润淋巴细胞(TILs)表达LAG-3,这与癌细胞侵略性的临床特征相关联。而阻断LAG-3则可以逆转以上的抑制作用,恢复CD8+T细胞增殖和活性,并减少调节性T细胞数量;而且还提高了T细胞免疫应答的敏感度。同时再阻断PD-1,免疫反应会协同性增强,抑制肿瘤。
LAG-3疗法联手PD1,一线治疗肺癌疗效翻倍
2月19日,Immutep公司宣布,其在研的可溶性LAG-3融合蛋白eftilagimod alpha(efti,又名IMP321)与PD1单抗联用,在2期试验中取得积极的研究结果。·一线治疗晚期NSCLC(非小细胞肺癌)患者,ORR(客观缓解率)达到47%。·二线治疗头颈鳞癌患者,ORR达到33%。·无论患者的PDL1表达如何,该方案都可见效。
参考文献:
1.中国国家药监局药品审评中心. Retrieved Jan. 8,2020. from http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=25
2.Clinicaltrials.gov.https://clinicaltrials.gov/ct2/results?cond=&term=TIGIT&cntry=&state=&city=&dist=
3.Gao J, Zheng Q, Xin N, Wang W, et al. CD155, an onco‐immunologic molecule in human tumors. Cancer Science. 2017;108(10):1934-1938. doi:10.1111/cas.13324.
4.Manieri NA, Chiang EY, Grogan JL. TIGIT: A Key Inhibitor of the Cancer Immunity Cycle. Trends Immunol. 2017 Jan;38(1):20-28. doi: 10.1016/j.it.2016.10.002.
5.https://www.roche.com/media/releases/med-cor-2020-05-14.htm
6.https://www.roche.com/research_and_development/who_we_are_how_we_work/pipeline.htm
7.何文涛,陈茜,余学峰.共抑制分子TIGIT的研究进展[J].现代免疫学,2014,34(5):436-438.
8.Martinet L, Smyth MJ. Balancing natural killer cell activation through paired receptors. Nat Rev Immunol. 2015 Apr;15(4):243-54
9. 佰傲谷BioValley:免疫检查点新秀---TIGIT抗体的研发格局
10.2020ASCO