抗体取代TCR:再生元创新PiG技术平台
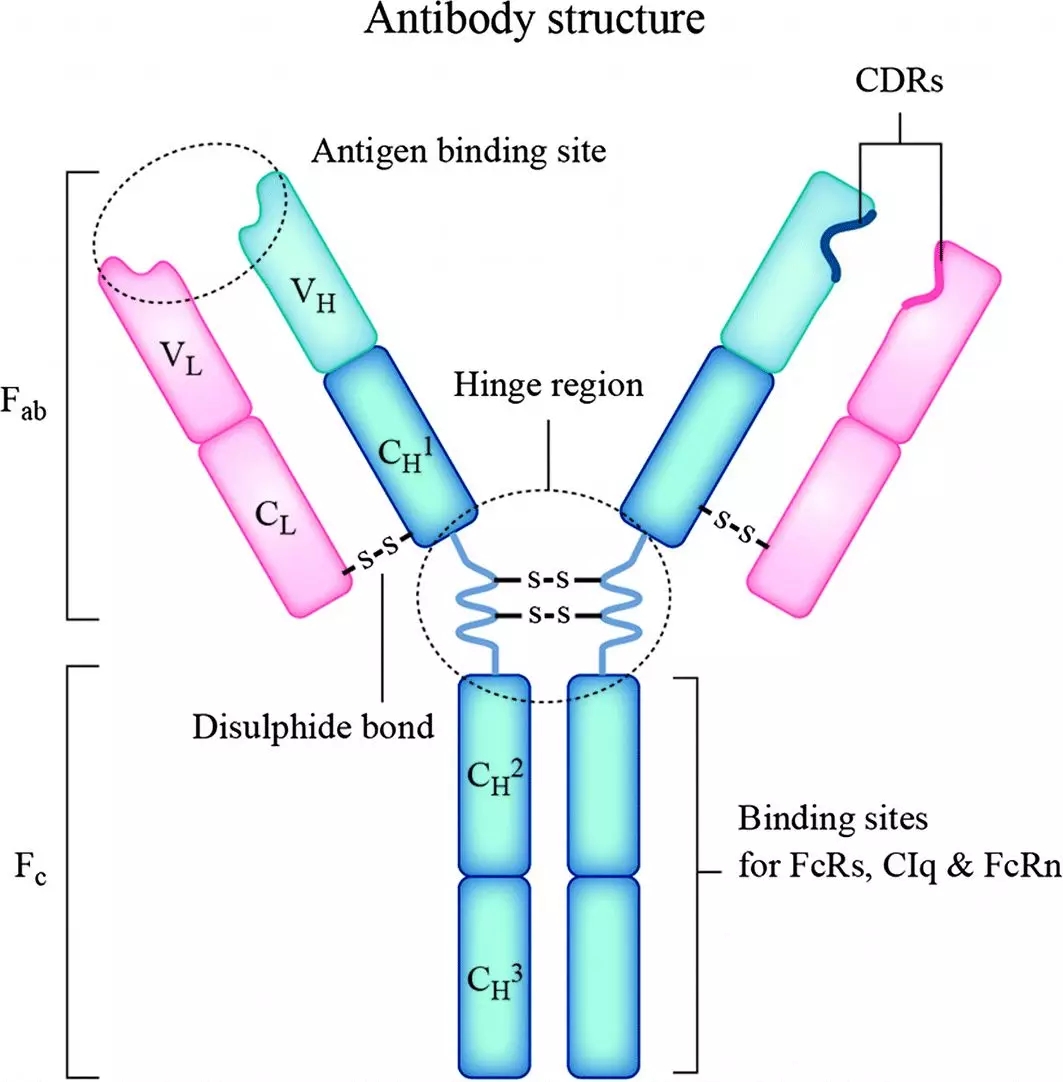
体液免疫(B细胞)和细胞免疫(T细胞)是人体获得性免疫系统的核心,分别通过BCR、TCR受体来解决特异性问题。B细胞分化为成熟的浆细胞即可分泌抗体,游离抗体通过Fab结合抗原,通过Fc effector效应(ADCC、ADCP、CDC)攻击靶细胞。
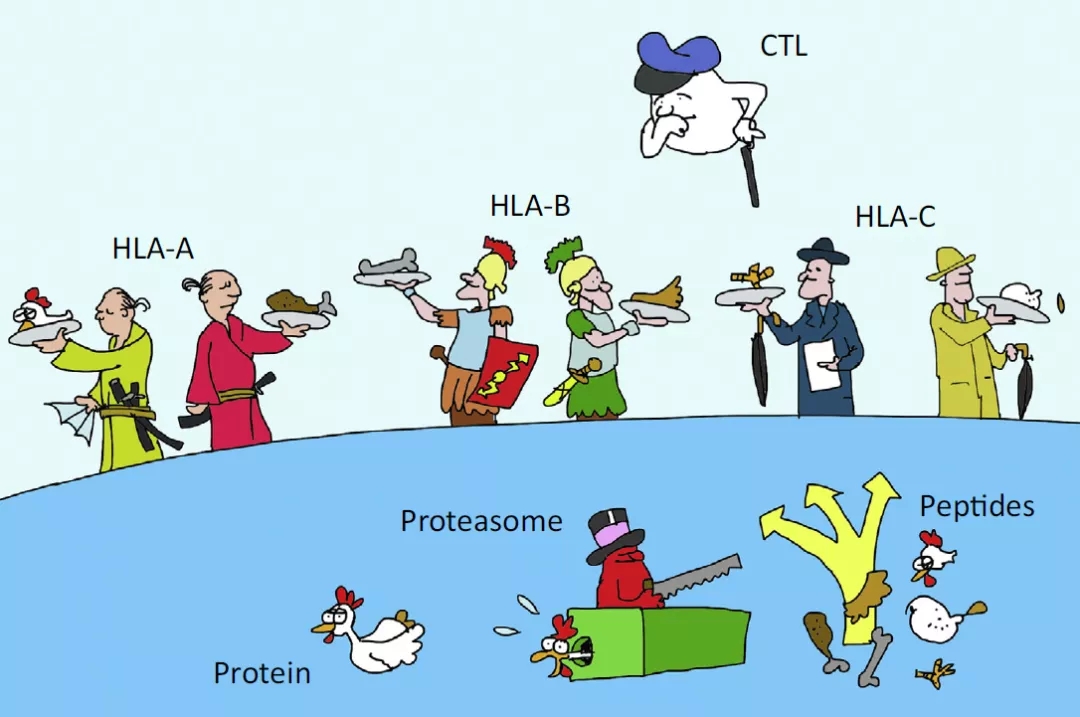
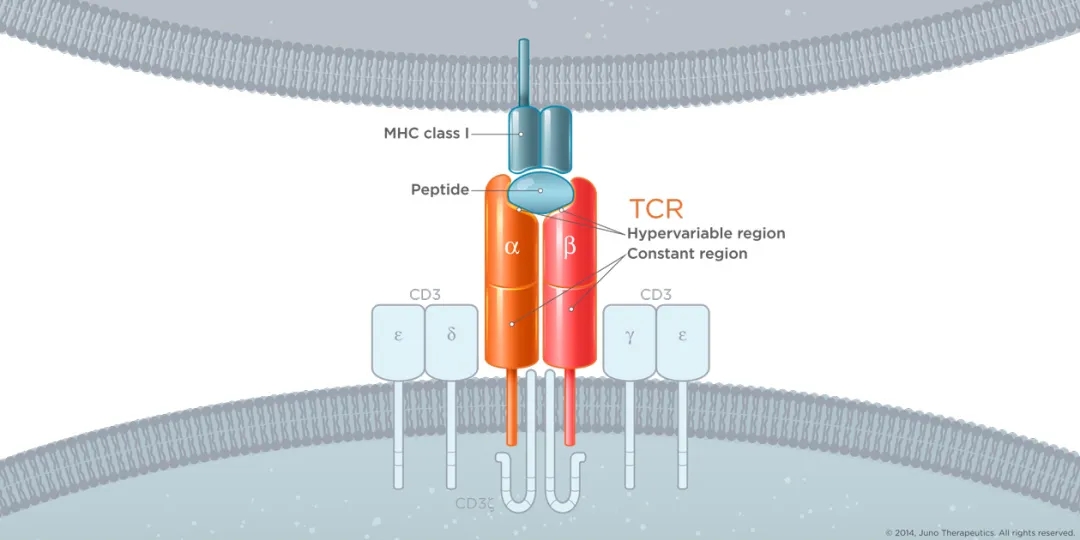
T细胞则通过TCR识别呈递细胞经MHC递呈的多肽,T细胞本身则在结合后发动攻击,CD8 T细胞发挥直接杀伤效应,CD4 T细胞(Th1、Th2、Th17、Treg、Tfh)则通过不同的细胞因子发挥相应的免疫调控效应,Treg发挥负向调控,Tfh则介导T/B细胞的相互作用(这也是T细胞表位影响蛋白药物免疫原性的理论基础)。下图是示意图,完整蛋白(鸡)被呈递细胞酶切分解成多肽,多肽(鸡头、鸡腿、鸡翅等)被不同的MHC(或称HLA,下图中的服务员)呈递,最后呈递给特异性的TCR(不同口味的客人,要指定的服务员)。
由于TCR为膜蛋白,不像IgG为游离蛋白。长久以来,主要应用IgG作为针对靶抗原的治疗药物。近年来T细胞疗法的发展,TCR-T也成为一个重要方向,如Adaptimmune已经在实体瘤取得初步突破。TCR识别的是呈递后的多肽-MHC复合物,可以对胞内靶点发挥作用,因而理论上TCR疗法有区别于抗体IgG的巨大潜在应用范围。但也由于TCR的靶点限制于MHC基因型,现阶段TCR-T疗法主要研究不依赖于MHC基因型的靶点,实际上只是TCR疗法一个很小的范围。更深层的机制来看,肿瘤新生抗原可以作为TCR疗法切入精准治疗的重要切入点,但该领域距离实现还相对遥远(尽管华大吉诺因已经申报了靶向新生抗原自体免疫T细胞)。
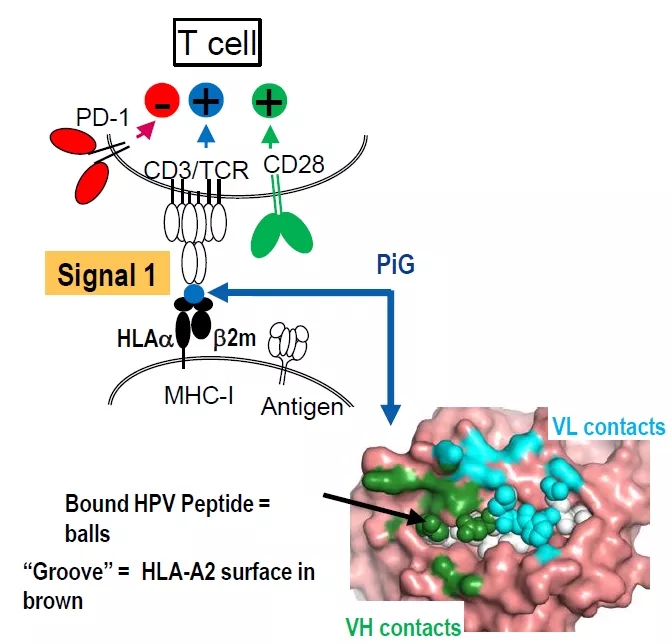
靶向新生抗原自体免疫T细胞疗法,意味着同时要解决鉴定个性化新生抗原、筛选高特异性TCR的自体T细胞,大规模扩增而后回输,相对CAR-T疗法难度提高了几个量级。无论是技术难度还是成本都很难接受,可行性需要进一步验证。再生元通过全新的技术平台,以抗体IgG替代TCR,从新的角度实现了TCR疗法。简单说就是筛选特异性的IgG,可以高亲和力的结合MHC-多肽复合物。如下图中,所筛选抗体特异性识别HLA-A2递呈的HPV peptide复合物。
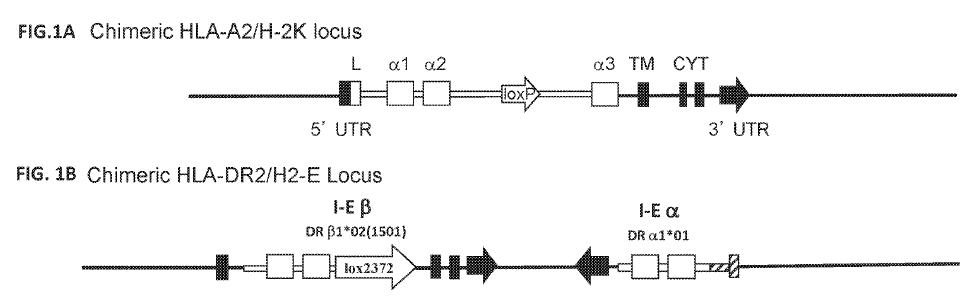
PiG技术平台的实现说起来相对简单,基于非人动物的HLA人源化。具体来说,在再生元全人源抗体转基因小鼠(也就是免疫球蛋白可变区的人源化)基础上,人源化特定的HLA位点,如HLA-A2等。由于小鼠有了人源化的HLA-A2,因而会产生免疫耐受,不产生识别HLA-A2的抗体。然后免疫HLA-A2/peptide,小鼠就会对“non-self”的HLA-A2/peptide产生特异性的抗体。随后筛选出特异性识别HLA-A2/HPV peptide、但不结合空的HLA-A2(没有呈递多肽)的全人源抗体。
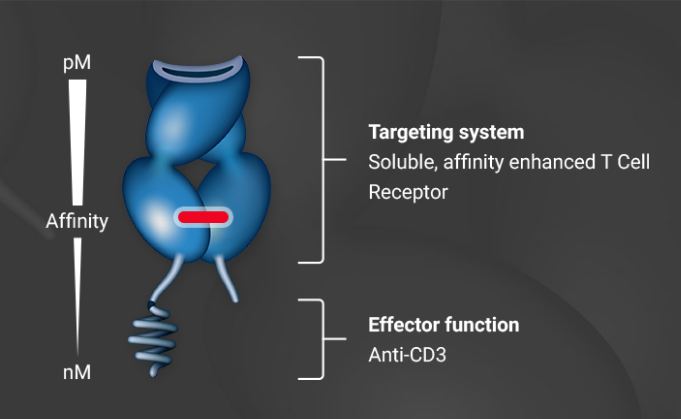
其实之前也有类似的技术,ImmTAC技术平台由ImmunoCore开发,抗CD3 scFv与TCR融合而成。TCR负责特异识别,抗CD3 scFv负责募集并激活T细胞。TCR经过改造,极大提高与MHC-多肽复合物的亲和力,且呈可溶状态。TCR的另一层优势是识别胞内抗原。ImmunoCore进展最快的tebentafusp(IMCgp100),靶向黑色素瘤相关抗原gp100。
小编总结
参考文献
-
Present Yourself! By MHC Class I and MHC Class II Molecules(2016); -
Regeneron, Presentation on ASCO; -
US20190292263A1, Genetically modified non-human animals for generating therapeutic antibodies against peptide-mhc complexes, methods of making and uses thereof.