重磅:韩为东教授团队研发的双靶点CAR-T疗法,再度展现优异数据
非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)是常见的血液系统B细胞系列恶性肿瘤,以化疗、放疗、造血干细胞移植、分子靶向药物及治疗性抗体为主的传统治疗手段,使得80%的患者达到完全缓解(CR),但对于治疗复发难治性患者,目前治疗手段疗效有限,能够达到1年生存率的患者不足30%。
自2013年,采用基因工程技术特异靶向CD19的CAR-T细胞疗法(嵌合抗原受体修饰T细胞)在该类疾病的治疗中获得突破后,2015年此类疗法被《Science》列为全球十大科技进展之首(与免疫检查点PD1/CTLA4治疗并列)。之后,CD19-CART作为活细胞药物也在美国上市,同时也引发了国内在该领域的蓬勃发展。
近日,由解放军总医院生物治疗科韩为东教授团队自主设计研发的Tandem CD19/CD20 CAR-T细胞疗法,用于治疗复发难治性非霍奇金淋巴瘤临床研究项目的最新研究成果,在血液领域专业学术期刊Blood上在线发表。实验数据表明,与目前国际上该类型的最佳报道数据比较(完全缓解率54%,中位PFS 5.9个月),该研究具有更高的完全缓解率,更长的缓解持续时间,具有强大而持久的抗肿瘤反应。
相对优异的临床数据
CD19/20 TanCAR7-T细胞是一款CD19和CD20串联表达于T细胞表面的CAR-T细胞疗法(自体),目前正在进行一项开放性单臂I/II a期试验(NCT03097770)。研究主要目的是评估TanCAR7-T细胞的安全性和耐受性。次要研究目的是对疗效、无进展生存期和总生存期进行评估。
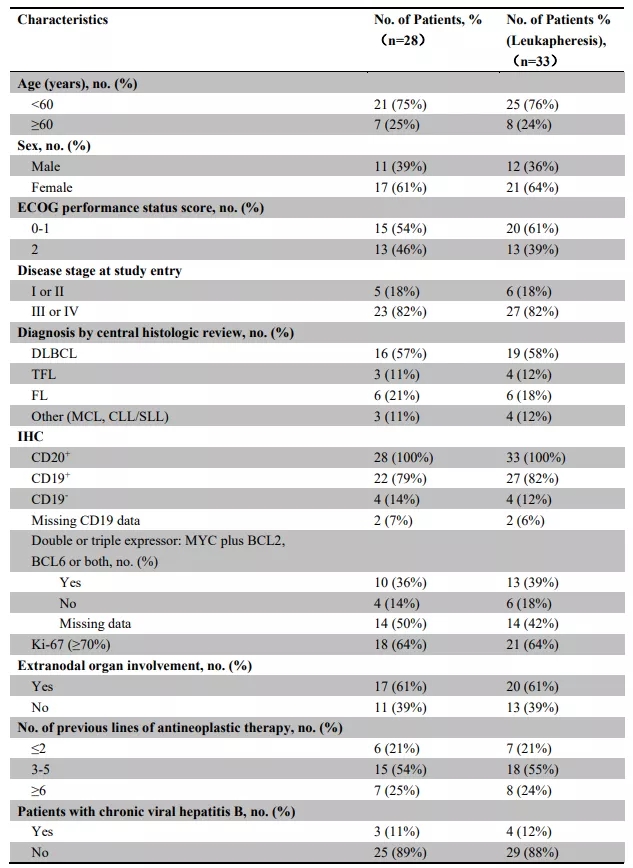
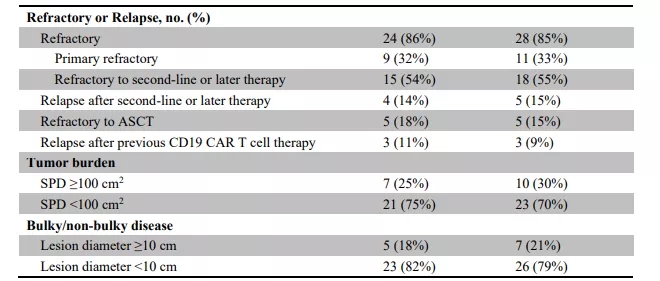
该研究截止2018年9月,入组33例患者,因预培养不成功、单采失败、疾病进展、不良反应等原因,最终28例患者接受TanCAR7-T细胞治疗并进行疗效评估。其中,患者年龄>60岁(7/28,25%),≤60岁(21/28,75%),病理学诊断为弥漫性大B细胞淋巴瘤(57%)、滤泡性淋巴瘤(21%)、转化滤泡性淋巴瘤(11%)、其他(11%);82%(23/28)的患者为III或IV期疾病;79%(22/28)的患者接受过3线及以上抗肿瘤治疗。
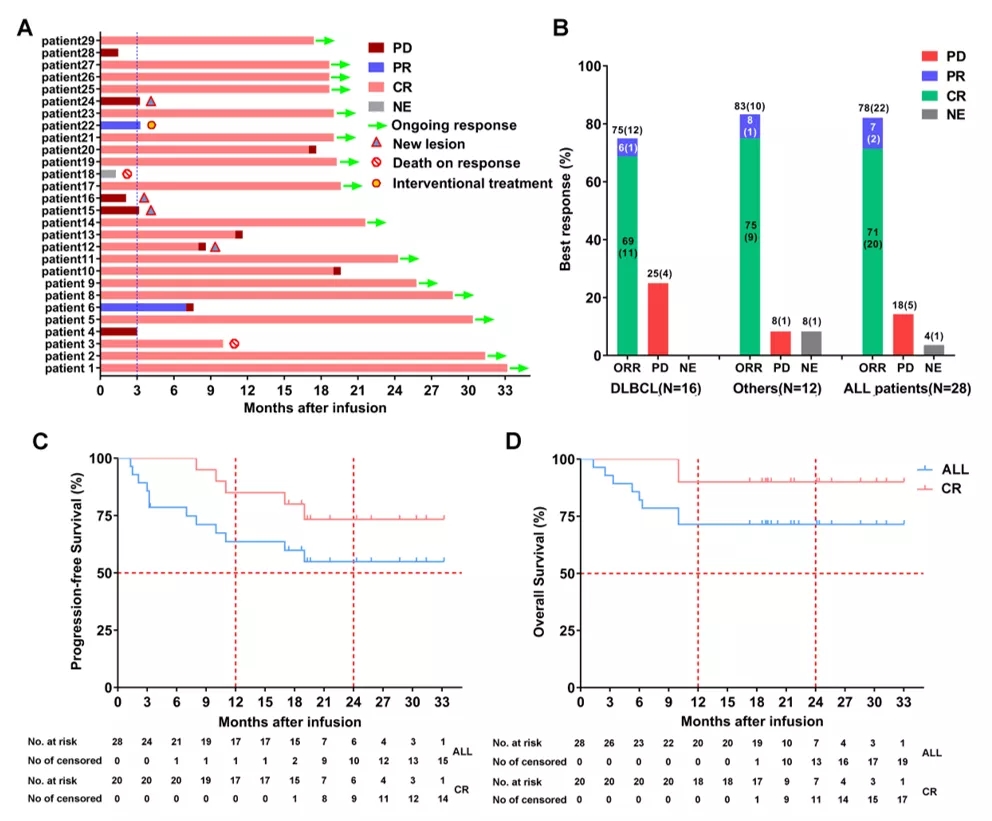
在这项研究中,中位随访时间为19.1个月,客观缓解率(ORR)为79%,其中完全缓解(CR)率为71%。15/28例(54%)患者处于持续完全缓解状态。未达中位PFS和OS。治疗后6个月无进展生存率为79%,12个月为64%。另外,14例患者(50%)发生细胞因子释放综合征(CRS),其中36%(5/14)的患者为1%或2级,14%(2/14)的为3级;未发现3级或更高水平的CAR-T细胞相关性脑病综合征(CRES)的病例。一名患者死于与治疗相关的严重肺部感染。
此外,在前不久的ASCO 2020会议上,韩为东团队还报道了该疗法的另一项临床研究,对74例可评估的患者进行了随访。数据显示:中位时间为13.5个月,62例 (84% ) 患者获得了客观缓解,55例 (74%)患者获得了完全缓解;中位PFS和OS未达到。
双靶点CAR-T疗法的优势
研究表明,CD19并不是CAR-T细胞针对B细胞恶性肿瘤的唯一有效靶标,除它之外,还存在CD20、CD22、CD123等众多靶点。因而,一些原本表达CD19的癌细胞,会在CAR-T疗法的压力下,转而表达其他类型的B细胞恶性肿瘤靶标蛋白。
而双靶点的CAR-T细胞疗法能够双管齐下,在靶向CD19的同时,选择性地靶向另外一个B细胞恶性肿瘤靶标,这样即便癌细胞产生了逃避机制,这款疗法也能及时调转目标,对癌细胞进行持续攻击。
目前,针对CAR-T细胞的脱靶现象,国内外已有许多机构和公司开发了双靶点和鸡尾酒/序贯的CAR-T疗法。
早在2017年,由河北森朗生物科技有限公司研发成功的CD19+CD22双靶点CAR-T技术,在河北医科大学第二医院成功救治了一名22岁的白血病青年,这是全国首次采用CD19+CD22双靶点CAR-T技术进行临床研究的成功案例,它的成功证明了具有百变特性的CAR-T治疗技术必将成为众多恶性肿瘤患者的福音。
目前,韩为东教授团队除了CD19/20 CAR-T细胞疗法外,该团队还在研究CD19/22 CAR-T细胞疗法,目前读取的临床数据显示CD19/22 CAR-T拥有良好的持久性。