肿瘤的治疗已经进入精准医疗时代。近年来,虽然各种组学技术在精准医疗中得到了广泛的应用,但是,其临床应用潜力和效果一直受到一定的限制:很大比例的癌症患者没有可用药的突变基因;即使是有目标基因组改变的患者,由于比例范围较大、组成复杂等原因,而缺乏有效指导临床方案的实用模型。因此,肿瘤精准医学的研究热点以及行业痛点就在于发展一个能及时、直接、准确地反映患者药物敏感性的体外药效检测技术。过去的60年里,先后有上百种的肿瘤药敏检测模型或方法被报道,其中,比较流行的有类器官(Patient-Derived Organoids,PDO)、患者来源的肿瘤异种移植模型(Patient-Derived tumor Xenograft,PDX)等。但这些技术在检测周期、准确率、检测药物通量、检测成本等方面均有局限性,因此指导临床用药的前景并不清晰。
近日,北京大学工学院席建忠教授课题组与北京大学肿瘤医院、北京大学人民医院、北京基石生命科技有限公司等团队深度合作,共同开发了一种全新的基于患者来源的原代肿瘤细胞体外培养方法(Patient-Derived Tumor-like Cell Clusters,PTC),建立了肿瘤体外药敏检测模型(简称微肿瘤模型),并在胃肠肿瘤及乳腺癌中进行了临床验证。北京时间6月25日,相关研究成果在线发表于国际顶级学术期刊Science Translational Medicine,文章题为“Patient-derived tumor-like cell clusters for drug testing in cancer therapy”。
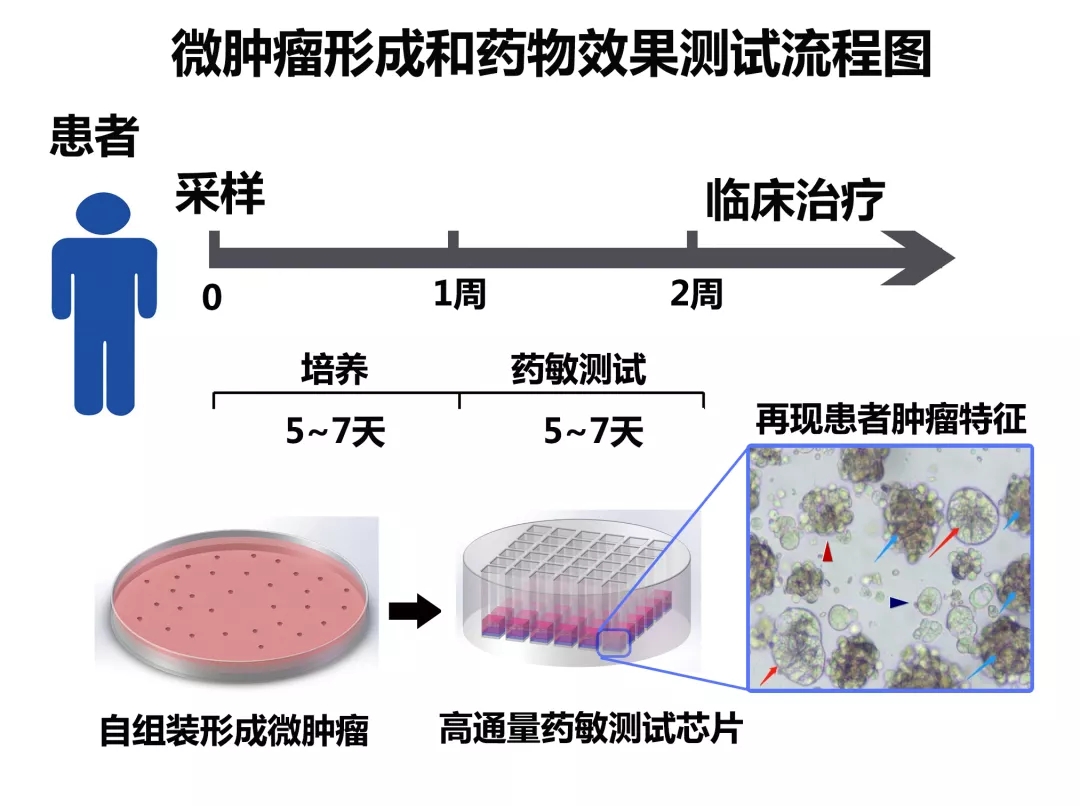
图:微肿瘤形成和药物效果测试流程图
不同于传统的类器官等三维(3D)培养技术,微肿瘤模型在检测周期、准确性以及临床转化应用等方面,已取得重要的原理和技术上的突破进展,有望在2~3年内得到大规模推广应用。
首先,研究团队发展了原代细胞自组装形成微肿瘤的新机制,并通过改良培养基和培养微环境,优化了微肿瘤培养条件。一方面,利用转录组测序、GO以及KEGG等技术,分析体外3D培养微球与体内肿瘤组织间的信号通路差异,检测各种信号通路筛选细胞因子以及小分子抑制剂,增加微球培养的成功率;另一方面,筛选了一系列培养器件的基底亲憎水等性质,开发了微型高通量培养和筛选芯片。在此基础上,研究团队对209例胃癌和结直肠癌患者的新鲜肿瘤样本进行了消化解离培养,获得的微肿瘤模型PTC的整体培养成功率达89.9%(188/209,不包含感染和坏死样本)。此外,对于PDOs不能或较难培养的瘤种或样本,如中低分化腺癌、神经内分泌瘤、粘液腺癌以及转移灶,微肿瘤模型PTC同样可以培养成功。
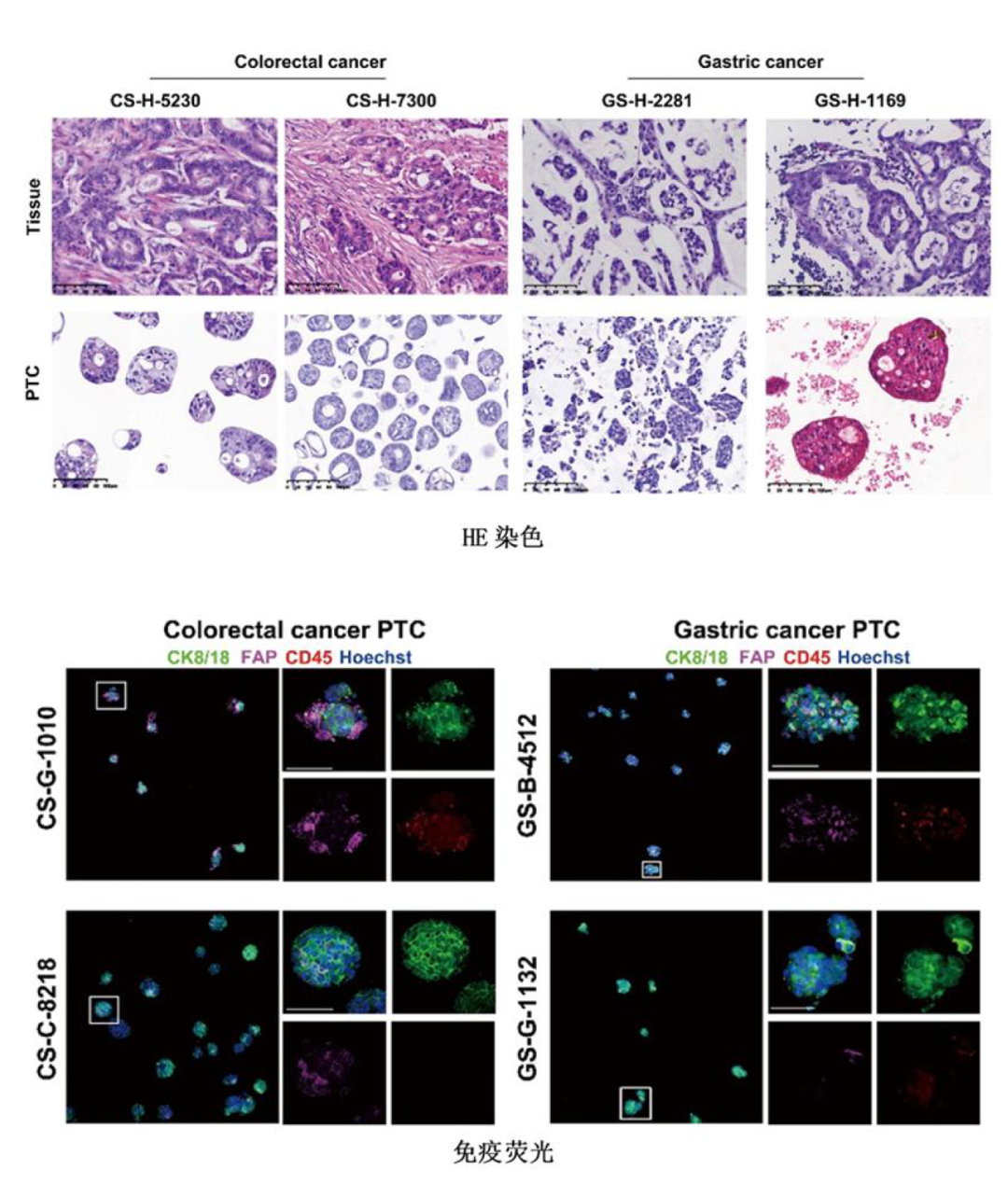
图:再现患者肿瘤的细胞特征
其次,微肿瘤PTC在培养时间、细胞组成等方面,具有明显的优势。无论是手术样本,还是内窥镜获得的样本,2周之内可以检测100~2000种药物。此外,微肿瘤PTC是由肿瘤干细胞、上皮细胞、成纤维细胞、巨噬细胞等多种细胞组成,能够很好地再现肿瘤组织本身的多细胞微环境与肿瘤上皮细胞的相互作用。研究团队通过免疫荧光、流式细胞分析、转录组测序等大量方法分析,表明微肿瘤PTC与肿瘤组织在分子、细胞以及组织结构等方面,具有高度的一致性。
值得关注的是,研究团队采用微肿瘤PTC药敏检测模型进行了临床双盲验证。在入组并获得PTC的24位胃肠肿瘤患者和35位乳腺癌患者中,采用影像学结合Miller&Payne分级系统评估临床疗效,PTC检测结果与临床疗效的一致率达到93.6%。其中,一位56岁男性粘液腺癌(预后差,常规用药方案少)患者,在常规用药(XELOX方案)耐药后,利用微肿瘤PTC药敏检测技术,实现了跨适应症动态治疗:服用乳腺癌药物三个周期后,患者腹膜转移灶消失,腹水减少,肿瘤标志物下降,网膜结节减小,药效显著。以上结果表明,PTC模型可以准确预测肿瘤患者对药物的敏感情况,对于复杂难治、恶性程度高的肿瘤,PTC同样可以充分发挥高通量等优势,帮助患者筛选跨适应症治疗方案,寻找更多可能的治疗机会。
图:一例粘液性肠癌动态监测案例
总之,PTC药敏检测技术是近年来肿瘤诊治方法的重要技术创新,其克服了其他药敏检测技术的局限性,并已成功应用于胃癌、肠癌、乳腺癌等患者的药物疗效预测中。该技术可在临床决策中准确、前瞻性地指导肿瘤患者的个体化治疗,不仅使患者获益,延长生命周期,而且可以节省国家宝贵的医疗资源。此外,作为一种较有前景的肿瘤研究模型,PTC平台可有力地推动肿瘤临床医学在机制探索、新药开发、临床辅助诊断等领域的研究。
1. Shenyi Yin, Ruibin Xi, Aiwen Wu, et al. Patient-derived tumor-like cell clusters for drug testing in cancer therapy[J].Science Translational Medicine, 2020, 12(549): eaaz1723.
2. David Tuveson and Hans Clevers. Cancer modeling meets human organoid technology[J]. Science, 2019, 364: 952–955.