饮食调整可增强癌症治疗
研究背景
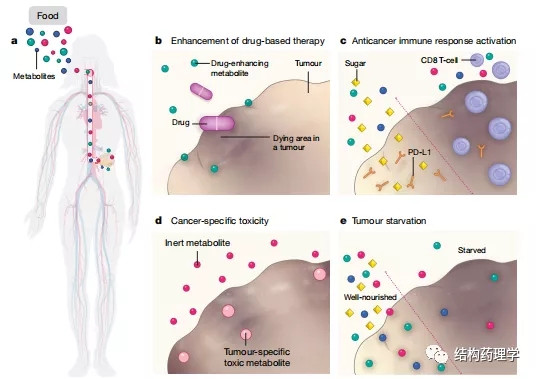
肿瘤依靠宿主提供的营养来维持生长和生存。改变宿主的饮食可以改变肿瘤微环境中的营养供应,这可能是抑制肿瘤生长的潜在策略。目前,饮食调整以补充常规癌症治疗作为一种非常实用的方法,受到越来越多的关注。饮食组成决定血浆中营养物质的利用率,因此也决定人体细胞(包括癌细胞)的微环境中的养分利用率。操纵癌细胞的代谢环境会显着改变其代谢活性,从而导致药物敏感性、增殖速率和代谢需求发生变化。饮食还通过与致癌信号密切相关的营养传感途径进行信号转导。随着研究体内肿瘤代谢依赖性的研究工具在过去几年中得到改善,有大量报告证明了调整特定代谢物的利用能力对癌症进展和治疗反应的影响。从理论上讲,饮食的调整可以通过多种机制来增强癌症的治疗(图1)。最近研究表明,饮食中几种营养素的改变可以改变癌症疗法的功效,在此,本文对这一快速发展领域的一些最新进展进行了综述,结果表明在癌症研究和治疗期间必须考虑患者的饮食习惯和营养状况。
Fig.1 | Mechanisms of tumour inhibition by dietary modifications
1 饮食限制营养
临床前研究表明,一些营养素是饮食限制的良好靶点,以提高癌症治疗的效果。下面将讨论如何减少饮食,例如限制葡萄糖、果糖或某些氨基酸的饮食对癌症的发展或对治疗的反应,并为适当的癌症病例引入更可行的饮食。
1.1 葡萄糖限制 葡萄糖是一种主要营养物质,可用于多种代谢途径,并被肿瘤高水平消耗以支持其生长。葡萄糖具有许多促肿瘤作用(下图),例如,葡萄糖是产生能量和合成维持癌细胞高增殖率的生物分子的来源。此外,饮食中的葡萄糖消耗会导致胰岛素分泌,胰岛素是一种公认的致癌信号转导因子。葡萄糖有助于癌症的进展,对治疗产生抵抗以及可能的癌症发作。与其他营养素(例如必需氨基酸)不同,葡萄糖的全身水平可通过相对简单的饮食改变而降低,因此,葡萄糖消耗是通过饮食调整来增强癌症治疗功效的理想靶标。下面描述葡萄糖代谢和信号的特征,以及它们如何被治疗利用。
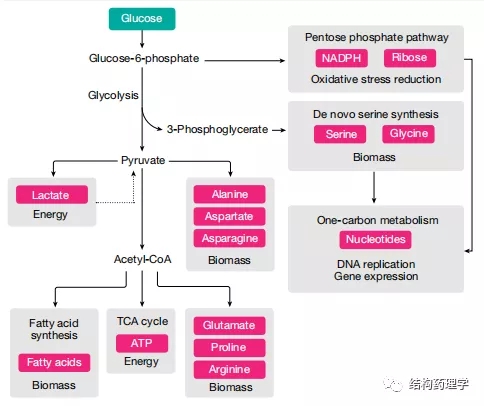
1.1.1 葡萄糖是能源和生物量生产的来源 葡萄糖提供了几种合成代谢过程,这些过程在癌细胞中得到增强,并且对于它们的高增殖率至关重要(图2)。进入癌细胞的大部分葡萄糖被引导至糖酵解和丙酮酸合成。一小部分丙酮酸通过乙酰辅酶A到三羧酸(TCA)循环用于肿瘤中ATP的产生,但是,无论多么小,葡萄糖代谢的这一方面对于体内的肿瘤是必不可少的。癌细胞偏爱使用葡萄糖来增加生物量而不是产生能量被称为沃伯格效应。虽然这种作用在不同类型的体内肿瘤中可能会有所不同,但这是肿瘤细胞如何重新排列其代谢程序以激发其独特代谢需求的一个很好的例子。
Fig. 2 | Glucosemetabolism in cancer cells
1.1.2 葡萄糖诱导促癌信号 在体内,胰岛素可以有效地缓冲血糖水平。饮食中糖摄入会增加血糖水平,胰岛β细胞可感觉到这种情况,其会通过分泌胰岛素立即做出反应。胰岛素主要通过增加骨骼肌和肝脏对葡萄糖的吸收来降低血液中的葡萄糖水平。然而,胰岛素也被肿瘤细胞感知,肿瘤细胞表达胰岛素受体,激活下游磷酸肌醇3-激酶(PI3K)信号通路。PI3K异常激活是大多数癌细胞中发现的癌症标志,其可通过积极调节细胞周期、存活、合成代谢等促进癌症的发展。PI3K途径是通过激活PIK3CA和AKT激酶基因组中的突变以及抑制肿瘤抑制因子PTEN来驱动的。通过胰岛素或突变激活PI3K信号传导可激活mTORC1,从而降低自噬并增加合成代谢过程、增殖和生物量积累。因此,已经很好地表征了葡萄糖消耗、血液胰岛素和致癌信号之间的分子联系。此外,长期高水平的胰岛素(例如在肥胖和/或糖尿病患者中发现的胰岛素)与罹患癌症的较高风险相关。尽管胰岛素和葡萄糖以外的其他因素可能在肥胖和糖尿病患者中发挥促肿瘤作用,但胰岛素以及通过饮食摄取的葡萄糖有助于癌症的发生,因此也可能成为预防癌症的靶标。
1.1.3 饮食中葡萄糖的限制对癌症治疗有好处 许多实验室已经研究了减少饮食中的葡萄糖是否可以抑制癌症的进展。最常用的减少葡萄糖的饮食限制方案是卡路里限制,有时也称为饮食限制。这些饮食在不同程度上限制了总热量的摄入,并确实降低了血糖,但它也具有更广泛的代谢作用。热量或饮食限制,尽管这可能会剥夺葡萄糖肿瘤,对癌症患者有益,但由于它们难以依从,并可能损害患者的整体身体状况,因此并不是推荐给患者的最佳饮食。也许更好的策略是低血糖但具有正常热量值的饮食(等热量饮食),例如生酮饮食。生酮饮食富含脂肪,但碳水化合物含量低,确实可以抑制癌症进展。生酮饮食降低了血液中的葡萄糖水平(坚持等热量饮食的人的血糖降低了30%,在这种饮食中,碳水化合物仅提供了总热量摄入的8%)并提高了酮体,而酮体并没有被大多数癌细胞消耗且可为大脑和其他组织提供能量。当控制饮食并且饮食摄入量不受限制时,生酮饮食可能是最有效的,以允许患者摄入正常的热量(不超过正常卡路里)。从机理上讲,生酮饮食可减少循环胰岛素,从而减少增殖性PI3K和mTORC1信号通路的活性,还可能增加癌细胞的氧化应激。使用癌症小鼠模型的研究数据表明,葡萄糖作为促生存信号通路的诱导剂,对其促肿瘤作用至关重要。碳水化合物限制在抑制PI3K途径中具有突变的癌细胞生长方面效率较低。即使这些细胞仍需要葡萄糖作为能量来源,但由于PI3K下游的信号传导始终具有活性,因此这些细胞对葡萄糖限制的信号传导作用难以控制。这些发现突出了全身性葡萄糖作为通过胰岛素的PI3K途径的引发剂的重要作用,并暗示对该途径的抑制将绕过葡萄糖的促肿瘤作用并有效地抑制肿瘤的生长。由于肿瘤对胰岛素信号的依赖,这种方法有望为患有PIK3C基因突变的肿瘤患者带来希望。然而,鉴于大多数肿瘤消耗大量葡萄糖,并在胰岛素和PI3K下游快速增殖,这种策略可能对抑制未突变PI3K的肿瘤同样有效。但PI3K的药理学抑制作用无效,因为代偿性胰岛素分泌赋予了对该策略的耐药性。在小鼠中,血液胰岛素水平会在抑制胰岛素-PI3K-AKT-mTOR信号通路的几小时内增加,这可增加葡萄糖 的摄取并通过肿瘤激活致癌PI3K信号,从而规避了药物的抗致瘤作用。饮食和药物抑制胰岛素的结合可能是抑制肿瘤生长的更有效方法。该方法已在小鼠中进行了测试,发现通过生酮饮食限制饮食中的葡萄糖可预防药理学抑制PI3K后的高血糖症和代偿胰岛素分泌。组合的方法通过mTOR减少了促癌信号传导,增强了肿瘤抑制能力,并改善了几种癌症模型中荷瘤小鼠的存活率。这些结果对于接受PI3K抑制剂治疗的患者具有广阔的前景,但是它们的意义远远超出了这一类患者,应该激发对癌症患者的饮食建议的全面考虑。尽管所有肿瘤都以葡萄糖为食,并且绝大多数肿瘤在存在过量葡萄糖的情况下都能以最佳方式增殖,但是当以脂肪作为其能量来源时,一些肿瘤的进展更快。在这少数情况下,患者将受益于以碳水化合物为主要热量来源的饮食。因此,在对患者采取任何建议之前,重要的是研究每种肿瘤的代谢偏好并完成临床前饮食能量来源变化结果的评估。多项临床研究已经测试了生酮饮食对癌症患者的潜在益处。这些研究仅包括了少数参与研究的患者,因此难以断定生酮饮食是否具有明显的益处。另外,由于缺乏这种饮食的标准方案,而且在不同的研究中患者对饮食的依从性差异很大,因此很难比较他们的结果。但是,其中一些研究提供了有希望的迹象,即饮食限制糖的生酮饮食改善了癌症患者的结果,是安全的,并且在患有多种类型的晚期癌症的患者中是可行的。尽管其中有些研究并未显示葡萄糖戒断会引起明显的肿瘤抑制作用,但它们为进一步研究奠定了基础,即应明确生酮饮食的标准、方案,并包括对依从性的仔细监测。在癌症进展的早期阶段测试生酮饮食的益处也可能会产生更好的结果。同时,减少葡萄糖的消耗、监测患者的血糖水平和胰岛素分泌,并协助患者维持低碳水化合物饮食将可能改善许多癌症患者的生存率。法通过mTOR减少了促癌信号传导,增强了肿瘤抑制能力,并改善了几种癌症模型中荷瘤小鼠的存活率。这些结果对于接受PI3K抑制剂治疗的患者具有广阔的前景,但是它们的意义远远超出了这一类患者,应该激发对癌症患者的饮食建议的全面考虑。尽管所有肿瘤都以葡萄糖为食,并且绝大多数肿瘤在存在过量葡萄糖的情况下都能以最佳方式增殖,但是当以脂肪作为其能量来源时,一些肿瘤的进展更快。在这少数情况下,患者将受益于以碳水化合物为主要热量来源的饮食。因此,在对患者采取任何建议之前,重要的是研究每种肿瘤的代谢偏好并完成临床前饮食能量来源变化结果的评估。多项临床研究已经测试了生酮饮食对癌症患者的潜在益处。这些研究仅包括了少数参与研究的患者,因此难以断定生酮饮食是否具有明显的益处。另外,由于缺乏这种饮食的标准方案,而且在不同的研究中患者对饮食的依从性差异很大,因此很难比较他们的结果。但是,其中一些研究提供了有希望的迹象,即饮食限制糖的生酮饮食改善了癌症患者的结果,是安全的,并且在患有多种类型的晚期癌症的患者中是可行的。尽管其中有些研究并未显示葡萄糖戒断会引起明显的肿瘤抑制作用,但它们为进一步研究奠定了基础,即应明确生酮饮食的标准、方案,并包括对依从性的仔细监测。在癌症进展的早期阶段测试生酮饮食的益处也可能会产生更好的结果。同时,减少葡萄糖的消耗、监测患者的血糖水平和胰岛素分泌,并协助患者维持低碳水化合物饮食将可能改善许多癌症患者的生存率。法通过mTOR减少了促癌信号传导,增强了肿瘤抑制能力,并改善了几种癌症模型中荷瘤小鼠的存活率。这些结果对于接受PI3K抑制剂治疗的患者具有广阔的前景,但是它们的意义远远超出了这一类患者,应该激发对癌症患者的饮食建议的全面考虑。尽管所有肿瘤都以葡萄糖为食,并且绝大多数肿瘤在存在过量葡萄糖的情况下都能以最佳方式增殖,但是当以脂肪作为其能量来源时,一些肿瘤的进展更快。在这少数情况下,患者将受益于以碳水化合物为主要热量来源的饮食。因此,在对患者采取任何建议之前,重要的是研究每种肿瘤的代谢偏好并完成临床前饮食能量来源变化结果的评估。多项临床研究已经测试了生酮饮食对癌症患者的潜在益处。这些研究仅包括了少数参与研究的患者,因此难以断定生酮饮食是否具有明显的益处。另外,由于缺乏这种饮食的标准方案,而且在不同的研究中患者对饮食的依从性差异很大,因此很难比较他们的结果。但是,其中一些研究提供了有希望的迹象,即饮食限制糖的生酮饮食改善了癌症患者的结果,是安全的,并且在患有多种类型的晚期癌症的患者中是可行的。尽管其中有些研究并未显示葡萄糖戒断会引起明显的肿瘤抑制作用,但它们为进一步研究奠定了基础,即应明确生酮饮食的标准、方案,并包括对依从性的仔细监测。在癌症进展的早期阶段测试生酮饮食的益处也可能会产生更好的结果。同时,减少葡萄糖的消耗、监测患者的血糖水平和胰岛素分泌,并协助患者维持低碳水化合物饮食将可能改善许多癌症患者的生存率。床前饮食能量来源变化结果的评估。多项临床研究已经测试了生酮饮食对癌症患者的潜在益处。这些研究仅包括了少数参与研究的患者,因此难以断定生酮饮食是否具有明显的益处。另外,由于缺乏这种饮食的标准方案,而且在不同的研究中患者对饮食的依从性差异很大,因此很难比较他们的结果。但是,其中一些研究提供了有希望的迹象,即饮食限制糖的生酮饮食改善了癌症患者的结果,是安全的,并且在患有多种类型的晚期癌症的患者中是可行的。尽管其中有些研究并未显示葡萄糖戒断会引起明显的肿瘤抑制作用,但它们为进一步研究奠定了基础,即应明确生酮饮食的标准、方案,并包括对依从性的仔细监测。在癌症进展的早期阶段测试生酮饮食的益处也可能会产生更好的结果。同时,减少葡萄糖的消耗、监测患者的血糖水平和胰岛素分泌,并协助患者维持低碳水化合物饮食将可能改善许多癌症患者的生存率。床前饮食能量来源变化结果的评估。多项临床研究已经测试了生酮饮食对癌症患者的潜在益处。这些研究仅包括了少数参与研究的患者,因此难以断定生酮饮食是否具有明显的益处。另外,由于缺乏这种饮食的标准方案,而且在不同的研究中患者对饮食的依从性差异很大,因此很难比较他们的结果。但是,其中一些研究提供了有希望的迹象,即饮食限制糖的生酮饮食改善了癌症患者的结果,是安全的,并且在患有多种类型的晚期癌症的患者中是可行的。尽管其中有些研究并未显示葡萄糖戒断会引起明显的肿瘤抑制作用,但它们为进一步研究奠定了基础,即应明确生酮饮食的标准、方案,并包括对依从性的仔细监测。在癌症进展的早期阶段测试生酮饮食的益处也可能会产生更好的结果。同时,减少葡萄糖的消耗、监测患者的血糖水平和胰岛素分泌,并协助患者维持低碳水化合物饮食将可能改善许多癌症患者的生存率。
1.2 限制果糖的潜在好处 西方饮食中的果糖非常丰富,果糖是一种单糖,在许多疾病(包括癌症)中均具有因果作用。直到最近,只有流行病学研究才提供了果糖摄入对人体有害的致瘤作用的证据,但是现在,有了关于通过饮食摄入果糖的去向及其在癌症进展中的作用的新数据,就应仔细考虑癌症患者食用果糖的情况。癌细胞可以使用果糖作为能源,许多类型的癌症通过上调果糖特异性转运蛋白GLUT5来进口大量果糖。GLUT5沉默对体外和动物模型中癌症进展的抑制作用突显了肿瘤对果糖作为能源的依赖性。尽管果糖主要被整肠吸收和代谢,但如果以高剂量食用会饱和肠道吸收果糖的能力,则果糖会溢出肝脏。到达肝脏的果糖诱导新脂质合成,脂肪肝、血液中甘油三酸酯分泌增加,以及二型糖尿病和肥胖症。在Apc -/-小鼠模型中,若长期服用果糖,即使是中等剂量的果糖(相当于每天一罐苏打水),也能增加大肠癌的发生率。适量的剂量足以激活肠道肿瘤中的糖酵解并诱导脂肪酸合成和肿瘤生长,这一事实挑战了一个普遍的假设,即至少在肠道中,仅果糖的大量过量才可能导致癌症。
1.3 氨基酸限制 尽管传统上将氨基酸归类为“必需”或“非必需”氨基酸,以反映其对饮食对机体适应性和生长的相对要求,但这些类别与癌细胞的相关性较小。癌细胞对各种合成代谢过程都需要大量“非必需”氨基酸,而且缺乏特定氨基酸通常会严重损害癌细胞的适应性,无论其合成这些氨基酸的能力如何。在讨论饮食中氨基酸的限制时,重要的是要考虑到肌肉萎缩对血液中氨基酸水平的缓冲作用,肌肉萎缩的发生是为了允许向必需器官供应必需氨基酸。由于肌肉萎缩,饮食中必需氨基酸的缺乏可能会导致血清中所有非缺失氨基酸的水平增加,甚至完全戒断所有饮食蛋白也无法降低血液中大多数氨基酸的水平。因此,耗尽肿瘤环境中的氨基酸水平而不引起可能有毒的这些氨基酸的严重全身还原并非易事。从技术角度来看,可以通过添加蛋白质、水果、蔬菜和一些谷物的蛋白质饮料来实现人体对特定氨基酸的限制。本文没有考虑将所有氨基酸作为蛋白质合成的基本要求的共同要求,而是将重点放在特定氨基酸在癌症代谢中的独特代谢功能以及其饮食消耗的潜在益处。
1.3.1 蛋氨酸 癌细胞的生长需要高水平的蛋氨酸,许多癌细胞系是蛋氨酸营养缺陷型。除了对翻译的关键要求外,蛋氨酸是S-腺苷蛋氨酸(SAM)代谢的底物,因此对于依赖SAM的下游甲基化反应(包括调节基因表达的DNA甲基化)很重要。激活足够多的SAM也是激活mTORC1的必要条件,mTORC1是主要的促增殖致癌信号通路的效应激酶。最后,饮食蛋氨酸可降低细胞氧化还原应激,这对癌细胞尤为重要。限制饮食中蛋氨酸的含量可增强癌症治疗的潜力最初是在1990年代初提出的,并且已在各种小鼠模型和癌症类型中得到证实,包括肉瘤、神经胶质瘤、前列腺癌、结肠直肠癌、乳腺癌和黑色素瘤。由于仅将蛋氨酸限制一个星期就足以在小鼠中产生显着的代谢变化,并且患者更可能在短时间内限制蛋氨酸的摄入,因此未来的研究可能应集中在限制蛋氨酸饮食时间短于几个星期。最近研究表明,人类对蛋氨酸的限制会导致与蛋氨酸缺乏的荷瘤小鼠相似的代谢变化,包括抑制一碳代谢和核苷酸合成。这些结果表明,蛋氨酸限制在癌症患者很可能抑制肿瘤的进展,类似于它在小鼠模型中抗肿瘤作用。但蛋氨酸限制也有缺点,例如,蛋氨酸和半胱氨酸的限制都具有促血管生成作用,当建议对实体瘤患者进行饮食调整时应仔细考虑。特别是,蛋氨酸和半胱氨酸受限后内皮细胞分泌的VEGF可能支持肿瘤的生长,在过表达VEGF并依靠VEGF进行生长的肿瘤中必须考虑到这一点。饮食中蛋氨酸的限制作为一种预防癌症的方法显示出特别的前景:它已被证明可以延长啮齿类动物的寿命,并产生一些新陈代谢的益处,从而也可以改善健康状况。这些研究表明,长期限制甲硫氨酸是一种安全有益的饮食策略,值得健康个体预防癌症。
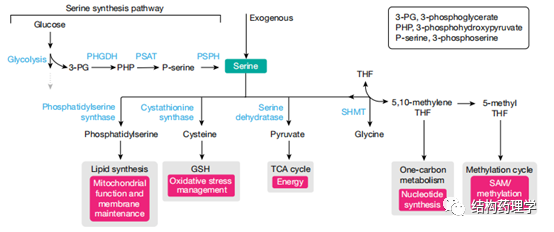
1.3.2 丝氨酸 丝氨酸有助于几种代谢过程,包括核苷酸合成、氧化应激反应和三羧酸循环。丝氨酸被认为是非必需氨基酸,因为细胞可以从葡萄糖或甘氨酸中新合成出丝氨酸(图3)。但是,癌细胞依赖外源丝氨酸来维持其高增殖率。这将丝氨酸定位为癌症特有的必需营养。饮食中丝氨酸的缺乏可能会增强葡萄糖和/或甘氨酸的丝氨酸合成。虽然在某些癌细胞中通过丝氨酸合成途径从葡萄糖中丝氨酸的新合成是必不可少的过程,并且可以促进体内肿瘤的生长,但在这些情况下,它与丝氨酸的可获得性没有关系,其激活主要取决于肿瘤中的基因组变异。丝氨酸合成途径中的第一种酶-磷酸甘油酸脱氢酶(PHGDH)。PHGDH催化丝氨酸合成中的重要步骤(3-磷酸-D-甘油酯+NAD +↔3-膦酰氧丙酮酸+ NADH)。在许多情况下,丝氨酸合成对癌细胞有害,因为它使糖酵解中间体3-磷酸甘油酸酯(3-PG)脱离了糖酵解的完成,因此降低了能量产生。确实,仅当丝氨酸受限时,体内PHGDH的过表达才对肿瘤有益。低水平的细胞丝氨酸诱导甘氨酸合成丝氨酸对癌细胞有害,因为它涉及一碳代谢酶丝氨酸羟甲基转移酶(SHMT)方向的逆转。SHMT将甘氨酸转化为丝氨酸会阻止有效的核苷酸合成并损害丝氨酸剥夺细胞的增殖速率。总之,这些发现表明丝氨酸剥夺作为抗癌策略是有前途的候选者,由于诱导丝氨酸合成而可能减慢肿瘤的进展,这对快速增殖的细胞是有害的。有几篇报道说丝氨酸剥夺在各种遗传背景和肿瘤类型中都具有抗肿瘤作用,例如,在许多肿瘤中突变的Trp53缺失使结肠癌细胞对丝氨酸剥夺敏感,因为它们无法诱导必要的G1阻滞。另外,这些细胞遭受氧化应激,因为它们不能引导残留的丝氨酸产生谷胱甘肽,而是将其用于核苷酸合成。同样,丝氨酸抑制有效地抑制了Apc丢失(肠道肿瘤)或Myc激活(淋巴瘤)驱动的自发性肿瘤的生长。线粒体复合体I抑制剂二甲双胍(或苯乙双胍)还显示丝氨酸剥夺可增强癌症治疗。通常,细胞通过增加葡萄糖消耗和糖酵解来响应二甲双胍介导的氧化磷酸化减少。但是,丝氨酸剥夺的细胞不能诱导糖酵解通量的这种补偿性增加,因此不能产生其存活所需的能量。当在活体内测试时,单独使用苯乙双胍或丝氨酸剥夺都不能抑制小鼠同种异体结肠腺癌的生长,但它们的组合会产生明显的抑制作用。然而苯乙双胍与丝氨酸剥夺结合是有毒的,在低剂量的二甲双胍治疗小鼠肠肿瘤中未观察到苯甲双胍达到的效果。作者得出结论,饮食中剥夺丝氨酸抑制肿瘤进展是有希望的,应结合癌症治疗方法和各种遗传背景进行试验。但是,由于在细胞培养中进行的实验表明,单独使用丝氨酸剥夺比同时消耗丝氨酸和甘氨酸更有效,因此未来的研究应单独使用丝氨酸剥夺,而不是上面引用的研究中使用的组合的丝氨酸-甘氨酸剥夺。
Fig. 3 | Serine metabolism incancer cells
2 补充营养物质
与缺乏必需营养素(例如氨基酸)不同,用重要营养素(例如组氨酸和甘露糖)补充饮食是一种可行的饮食改良方法,可以轻松地用作既定疗法的补充。这里的挑战是确定候选营养素,这些营养素的添加将抑制肿瘤的生长,因为这些营养素必须对转化细胞具有选择性毒性,或者必须与抗癌疗法协同作用。
2.1 组氨酸 通过组氨酸降解途径的通量可以改变癌细胞对常用化疗药物甲氨蝶呤的反应。通过组氨酸降解途径的低通量,无论是通过遗传途径还是通过该途径的限速酶的固有低表达而实现,都使细胞无法接受甲氨蝶呤治疗。相反,通过补充组氨酸可达到该通路的高通量,可使白血病肿瘤对甲氨蝶呤疗法敏感。就机理而言,组氨酸降解途径消耗了四氢叶酸(THF),这是核苷酸合成必不可少的酶促辅因子,它是甲氨蝶呤的靶标,因此是经甲氨蝶呤处理的细胞中的限制性代谢物。组氨酸降解途径与必需的核苷酸合成酶竞争以限制THF的量。因此,饮食介导的通过组氨酸降解途径的通量增加会降低THF的利用率、新核苷酸合成和癌细胞存活率。这是饮食改良可以增强已确立的癌症治疗功效的一个例子(图1)。在这种情况下,饮食调整是高度可行的,因为它涉及补充氨基酸,与剥夺或限制不同,该氨基酸易于患者遵循。此外,改进方案涉及甲氨蝶呤(一种广泛使用的疗法),其功效的改善将使大量患者受益。
2.2 甘露糖 甘露糖是一种单糖,可以通过葡萄糖转运蛋白进入细胞,但其下游代谢产物(6-磷酸甘露糖)在细胞内积累而不是促进能量产生。因为甘露糖是由与葡萄糖代谢相同的酶代谢的,所以它会干扰葡萄糖代谢并抑制癌细胞的生长。在胰腺癌衍生的异种移植物中,饮食中补充甘露糖会破坏葡萄糖代谢,从而使癌细胞对化疗诱导的细胞凋亡更加敏感,如顺铂和阿霉素所示。癌症特异性抑制作用源于葡萄糖转运蛋白在肿瘤细胞上的高表达。因此,甘露糖补充提供了针对增强对癌症治疗反应的一种相对安全且易于施用的策略。
3 营养物质的药理消耗
癌细胞通常是营养素的营养缺陷型,这对正常健康细胞并不重要。这呈现出癌细胞的脆弱性,不仅可以通过饮食干预,而且可以通过药理学方法靶向癌细胞。对于此处讨论的某些营养素,尽管其中某些营养素的饮食损耗可能会更好,但文献仅提供有关药理学的信息,而不是饮食损耗的信息。饮食限制和针对这些选择性必需营养素(例如氨基酸和维生素叶酸)的药理靶向相结合,可能会导致这些营养素的消耗得到改善,并对癌症治疗产生更好的反应。
3.1 天冬酰胺 已显示降低白斑病患者血浆中的天冬酰胺水平可以提高生存率。L-天冬酰胺酶降低天冬酰胺的含量证明了天冬酰胺在肿瘤生长中的关键作用以及其饮食消耗的潜在治疗益处。天冬酰胺对几种合成代谢途径很重要,因为它起氨基酸交换因子的作用(主要用于丝氨酸、精氨酸和组氨酸)和促进转移的代谢产物。然而尽管频繁降低天冬酰胺的药理毒性,但尚未对饮食中天冬酰胺的消耗进行彻底研究。但是可以从已发表的研究中推断出饲喂缺乏天冬酰胺饮食小鼠有可能降低血清中天冬酰胺的水平,并且这种饮食介导的消耗足以减少乳腺癌小鼠模型中的转移。应该做更多的研究来检验饮食介导的天冬酰胺耗竭的抗肿瘤治疗功效,特别是对于白血病,因为白血病中转化的细胞通常是天冬酰胺营养缺陷的。
3.2 精氨酸 静态细胞可以从瓜氨酸合成精氨酸(作为尿素循环的一部分),但是由于精氨酸琥珀酸合成酶1(ASS1)的沉默,一些黑色素瘤和肝细胞或前列腺癌是精氨酸营养缺陷型。饮食中精氨酸的缺乏或通过精氨酸降解酶精氨酸脱亚氨酶(ADI)的治疗可以靶向癌细胞的这种精氨酸依赖性。ADI对精氨酸的抑制作用已被证明在黑色素瘤和肝细胞癌的临床前模型中是有效的。值得注意的是,通过降低精氨酸的全身水平来抑制肿瘤进展的另一种方法是肝细胞分泌精氨酸酶1(ARG1),这种酶是在荷黑素瘤小鼠肝脏自噬被抑制后发生的。精氨酸是一氧化氮(NO)合酶的底物,因此会影响全身性NO水平。NO在慢性炎症条件下发挥免疫作用并具有致癌作用,但是尚不清楚饮食中精氨酸的剥夺是否能降低NO水平从而规避这种作用。另外,如果NO在免疫细胞活化中的作用对于肿瘤免疫至关重要,则NO或其前体精氨酸将不是癌症治疗的理想靶标。
3.3 胱氨酸 胱氨酸在维持细胞氧化还原平衡中具有重要作用,因为它是半胱氨酸的前体,半胱氨酸是抗氧化剂谷胱甘肽(GSH)的组成部分。但是,与半胱氨酸不同,胱氨酸在血浆中含量很高,并通过半胱氨酸-谷氨酸逆转运蛋白xCT(SLC7A11)导入细胞。胱氨酸剥夺抑制了肿瘤的生长,并且在三种荷瘤小鼠模型中已证明可提高其存活率:EGFR突变非小细胞肺癌(NSCLC)异种移植、前列腺异种移植和遗传性白血病(TCL1- Tg:Trp53 -/-)模型。尽管这些研究通过酶促降解作用来减少胱氨酸的药理作用,但限制胱氨酸的全身消耗,可通过饮食限制达到类似的结果。从机制上讲,半胱氨酸消耗会剥夺细胞中的半胱氨酸,并因此剥夺抗氧化剂GSH的含量。这损害了细胞对氧化损伤作出反应的能力,这在癌细胞中特别高,并且细胞死于肥大病。小鼠长期胱氨酸耗尽(长达50天)后,健康组织中缺乏毒性,突显了肿瘤特异性作用。
3.4 叶酸 叶酸是核苷酸合成所必需的维生素(B9),因此对于所有细胞类型都是必不可少的。快速增殖的细胞(例如肠上皮细胞、造血细胞和肿瘤细胞)消耗大量叶酸,以满足其对用于DNA复制和基因表达的新合成核苷酸的需求。膳食补充叶酸超过70年前已被证明加速了急性淋巴细胞白血病(ALL)的生长。这一发现促进了抗叶酸癌症治疗的发展,并强调了叶酸在肿瘤生长中的关键作用。如今,抗叶酸甲氨蝶呤已成为小儿白血病的护理标准,也可用于治疗其他癌症类型,主要是血液肿瘤。抗叶酸靶向一碳代谢并抑制核苷酸的合成,而核苷酸在快速增殖的癌细胞中非常需要。抗叶酸癌症疗法通常是药理学上的,因此很难估计饮食中的叶酸缺乏会导致抑制肿瘤。叶酸剥夺结合膳食尿素补充可抑制Apc min / +小鼠肠道肿瘤的发生和生长。然而,尚需对普通饮食和无叶酸饮食之间的肿瘤负荷进行比较,这对于仅饮食中叶酸缺乏可能具有的抗肿瘤发生作用的任何结论都是至关重要的。
4 其他潜在的营养靶点
还有更多的营养物质,包括其他氨基酸和脂肪酸,对于癌细胞的高增殖率是必不可少的。然而,目前尚不清楚饮食中限制这些营养素的可行性或安全性,或是否会抑制肿瘤的生长。这些营养素及其作为饮食调整目标的潜力将在下面讨论。
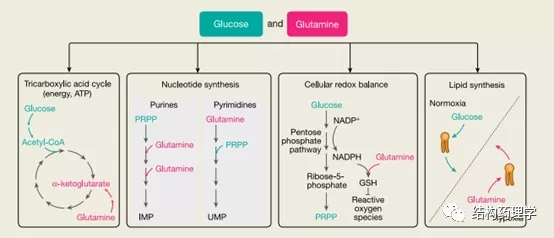
4.1 谷氨酰胺和谷氨酸 谷氨酰胺及其直接下游代谢产物谷氨酸通过几种代谢途径促进癌细胞的增殖。它们助长了TCA循环以生产ATP和NADH。谷氨酰胺是核苷酸生物合成中的关键组成部分(作为嘌呤环中两个氮原子和嘧啶环中一个氮原子的供体),对于谷胱甘肽合成和维持细胞中的氧化还原平衡也是必不可少的。最后,在缺氧条件下,谷氨酰胺和谷氨酸有助于脂质合成。谷氨酰胺酶是谷氨酰胺分解代谢中的第一种酶,可将谷氨酰胺转化为谷氨酸。谷氨酰胺酶的抑制作用已在临床前和临床试验中显示出降低肿瘤生长的作用,但当谷氨酸的供应量过多以绕过该抑制作用时,则不能抑制。因此,在饮食中限制谷氨酰胺而不限制谷氨酸不太可能在癌细胞中引起重大的代谢后果,在某些情况下天冬酰胺也可以抵消谷氨酰胺的消耗(专栏2)。有足够的证据表明谷氨酰胺对于培养中的癌细胞至关重要,但尚不清楚肿瘤是否依赖于体内的谷氨酰胺。谷氨酰胺被认为对转化和未转化的快速增殖细胞都是有条件的。因此,专注于癌细胞特有的谷氨酰胺功能可能是有益的。例如,癌细胞比其他细胞对氧化应激更敏感,因此谷氨酰胺缺失与抗氧化防御能力下降的组合可能对癌细胞有特异性毒性。增加对谷氨酰胺剥夺的抑制作用的特异性的其他方法包括抑制mTOR或天冬氨酸转运蛋白,这将通过阻止允许谷氨酰胺剥夺的癌细胞存活的代谢重新连接而增强肿瘤抑制。当考虑将饮食中的谷氨酰胺剥夺作为加强治疗的手段时,重要的是要考虑肿瘤环境中的谷氨酰胺水平。例如,当血液中的谷氨酰胺减少但胶质母细胞瘤小鼠的小脑没有减少时,它对肿瘤负荷没有显着影响,但是当饮食中谷氨酰胺的缺乏导致系统性谷氨酰胺减少时,包括髓母细胞瘤小鼠的小脑和脑脊髓液显着减少,该治疗可提高生存率。由于降低脑肿瘤微环境中的谷氨酰胺水平特别具有挑战性,因为基质细胞会分泌谷氨酰胺,因此在肿瘤部位进行谷氨酰胺测量是准确解释这些肿瘤模型中涉及谷氨酰胺耗竭体内实验的关键。在增殖表达癌基因KRAS的乳腺上皮细胞和癌细胞中,谷氨酸脱氢酶(GLUD1)抑制了谷氨酸向α-酮戊二酸的转化,并且谷氨酸通过细胞质酶天冬氨酸转氨酶(GOT1)传 导至天冬氨酸合成代谢( l-天冬氨酸+ 2-氧代戊二酸↔草酰乙酸+l-谷氨酸)。这改善了人胰管腺癌(PDAC)细胞中的氧化还原平衡,并有助于其增殖。在肺腺癌中,谷氨酸在维持细胞内抗氧化剂水平方面的作用既包括对谷胱甘肽的直接作用,也包括通过谷氨酸-胱氨酸逆转运蛋白xCT导入胱氨酸间接促进谷胱甘肽生物合成的作用。胶质瘤细胞还通过xCT反转运蛋白分泌谷氨酸,这得益于进口胱氨酸的抗氧化作用。这种神经胶质瘤依赖性分泌导致肿瘤周围液体中的谷氨酸水平显着增加,这对肿瘤环境中的健康神经元有毒,并且是导致神经胶质瘤患者癫痫发作的原因。尽管以xCT转运蛋白为靶标已显示出临床成功,并且显示谷氨酸有助于神经胶质瘤的生长,但尚不清楚是否可以通过饮食限制谷氨酸的摄入来减少肿瘤周围液中谷氨酸的含量。
4.2 天冬氨酸 天冬氨酸是蛋白质合成、尿素循环、苹果酸-天冬氨酸穿梭和核酸合成所必需的。在低氧条件下,低水平的天冬氨酸可能会限制生长,这在肿瘤中很常见,因为天冬氨酸的合成取决于细胞呼吸。确实,低氧细胞中的天冬氨酸水平较低,而天冬氨酸是体内肿瘤中的限制性代谢产物。电子传输链的抑制剂通过依赖呼吸的线粒体酶GOT2阻断天冬氨酸的合成。在这种条件下,细胞利用胞质酶GOT1合成天冬氨酸,从而实现蛋白质和核酸的生物合成。通过过表达外源性天冬酰胺酶将天冬氨酸的细胞水平提高,该酶将天冬酰胺转化为天冬氨酸或天冬氨酸转运蛋白SLC1A3,可提高体内低氧条件下癌细胞的存活率。值得注意的是,在低氧条件下,天冬氨酸并不是TCA循环通量的主要来源。相反,它有助于嘧啶和嘌呤的生物合成,这是通过核苷补充来拯救低氧细胞中低新天冬氨酸合成的结果。限制天门冬氨酸可被认为是对实体瘤的补充治疗,这些实体瘤的血管化较差且常常缺氧。由于天冬氨酸对于缺氧肿瘤中的核苷酸合成必不可少,因此有必要考虑将天冬氨酸限制与靶向核苷酸生物合成的疗法(例如甲氨蝶呤和氟尿嘧啶)相结合。
4.3 丙氨酸 尽管丙氨酸在胰腺导管腺癌(PDAC)中具有独特的代谢作用,并且可以替代葡萄糖和谷氨酰胺作为主要的TCA循环底物,但它不大可能成为可通过饮食控制的营养素。PDAC细胞使用基质细胞分泌的丙氨酸,从而降低了它们对血液供应的营养的依赖性。由于饮食调整会改变血液中营养的可利用性,但不会改变基质细胞合成非必需氨基酸(如丙氨酸)的能力,因此在这种情况下,饮食方法不太可能受益。
4.4 脂肪酸 脂肪酸氧化(FAO)可以制造的ATP分子是葡萄糖或氨基酸分解代谢的三倍以上。为了了解脂肪酸剥夺是否会影响癌症的生长,重要的是要确定在葡萄糖有限的情况下,癌细胞是否可以为此目的使用脂肪酸,甚至可以作为首选的底物而与葡萄糖的可利用性无关。在部分肿瘤中,FAO是ATP生产的首选过程。一些乳腺癌肿瘤会在代谢压力下或MYC或CPT1C过表达的情况下激活FAO。OxPhos-DLBCL是弥散性大B细胞淋巴瘤(DLBCL)的一种亚型,也具有氧化脂肪酸作为其主要能源的能力,并且对该途径的药理扰动敏感。低脂饮食可以改善肥胖的白血病小鼠的生存,强调FAO对于这些肿瘤的生长至关重要,并暗示脂肪细胞不太可能弥补脂肪酸的不足。高脂饮食通过增加肠道干细胞的数量和功能来增加肠道中腺瘤和癌的数量。高脂饮食允许祖细胞通过激活PPARδ来启动体内异常增殖并在培养物中形成类似于结肠干细胞的菌落。但是,尚未测试限制脂肪酸是否会产生相反的结果,即减少肠道中自发性腺瘤或癌的数量。FAO还通过NADPH供应来支持癌细胞。NADPH是一种限制生长的代谢产物,是氧化还原平衡的关键介质。抑制FAO会引起活性氧(ROS)积累并阻止神经胶质瘤细胞的增殖,而诱导FAO会通过AMPK信号传导增加NADPH的产生和癌细胞的存活。总之,这些发现表明剥夺患者的营养脂肪酸,以饿死特定类型的癌症可能有治疗潜力。这些发现还增加了高脂生酮饮食可能在一部分癌症中产生不利的促癌作用的可能性。因此,目前尚不清楚哪种癌症类型或哪些患者(具有多种饮食习惯和BMI)从低脂或高脂饮食中受益最大。
总结
本文详细讨论了多种营养的饮食限制,包括葡萄糖、果糖和氨基酸,并描述了每种营养对细胞代谢及其与信号传导途径相互作用的影响。然后,概述了如何利用其他饮食干预措施,例如营养补充或药理学上的营养消耗来进行癌症治疗。此外还探索了其他潜在目标。最后,针对特定患者量身定制的饮食和疗法未来组合的潜力提出了观点。但是,尽管本文所述的许多代谢产物的饮食操作已显示出明显的临床前益处,并且其中一些已在临床试验中显示出成效,但对于癌症患者而言,仍然没有明确的指南或建议的饮食调整方案。因此,本篇综述提出应该在临床上对一些饮食干预措施进行测试,以早日验证其治疗价值。这些措施包括减少葡萄糖的消耗,并可能的补充特定营养素,因为这些是可行且安全的饮食调整方法,能够很容易地从临床上具体情况评估它们的益处。此外,还需开展进一步的研究工作,引起更多的关注和发现,即通过改变饮食来增强癌症治疗反应的潜力以及提供给癌症患者的饮食建议,这也可能会导致癌症患者治疗方式的转变。
本文于2020年3月25日在线发表于Nature,第一作者是Naama Kanarek和Boryana Petrova,通讯作者为NaamaKanarek,通讯单位是美国波士顿儿童医院病理科和美国哈佛医学院。
原文链接:https://doi.org/10.1038/s41586-020-2124-0