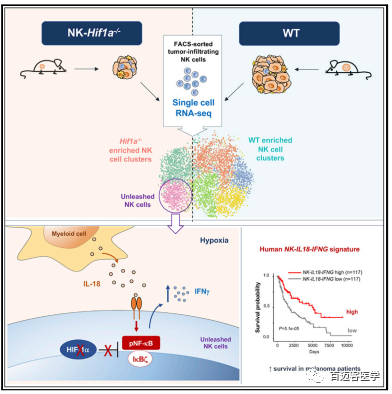
肿瘤浸润NK细胞的单细胞RNA测序显示:抑制转录因子HIF-1α可释放NK细胞的抗肿瘤活性
英文题目:Single-Cell RNA Sequencing of Tumor-Infiltrating NK Cells Reveals that Inhibition of Transcription Factor HIF-1a Unleashes NK Cell Activity
研究背景
自然杀伤(NK)细胞是机体重要的免疫细胞,能有效杀伤多种肿瘤靶细胞。激活NK受体的信号整合后可激活NK细胞,但这些受体会被潜在靶细胞上的特异性抑制受体分子MHC-1所抑制。因此,当MHC-1低表达时,NK细胞能有效杀伤肿瘤细胞。然而,在实体肿瘤中,肿瘤浸润的NK细胞常常表现出功能失调,激活受体表达水平降低而抑制受体水平升高,导致γ干扰素(IFN-γ)不足,不能正常发挥功能。这种功能障碍是否存在于所有的肿瘤浸润NK细胞,或是否存在分子异质性,至今尚未得到的解决。而如何预防和克服肿瘤组织中的NK细胞功能障碍,充分发挥NK细胞的抗肿瘤潜能,仍是一个具有挑战性的课题。
肿瘤微环境中存在的细胞和因子可以驱动免疫抑制,促进肿瘤的发展和转移。缺氧是实体肿瘤的常见特征。在低氧胁迫下,肿瘤细胞、基质细胞和免疫细胞通过分泌趋化因子来富集免疫抑制细胞(如骨髓来源的抑制细胞:2型巨噬细胞和调节性T细胞),从而抑制免疫细胞功能。细胞通过上调转录因子HIF-1α来适应缺氧,HIF-1α调控许多过程中的基因表达,如葡萄糖代谢、细胞增殖、生存和血管生成。在免疫系统中,已证明HIF-1α在许多不同的细胞类型中都有表达,并且能够促进血管生成及调节细胞的分化和功能。HIF-1α在实体瘤中非常常见,但尚不清楚HIF-1α在细胞水平上是如何调控NK细胞信号转导和抗肿瘤效应的。
本文通过敲除模型鼠中NK细胞中的Hif1a基因及使用HIF-1α抑制剂对人NK细胞进行长期培养,对肿瘤浸润NK细胞的单细胞RNA测序分析证明了在NK细胞中抑制HIF-1α可以增强其抗肿瘤活性。
研究方法
研究结果
1. 缺乏hif1a的NK细胞表现出强大的抗肿瘤活性和有效抑制肿瘤生长
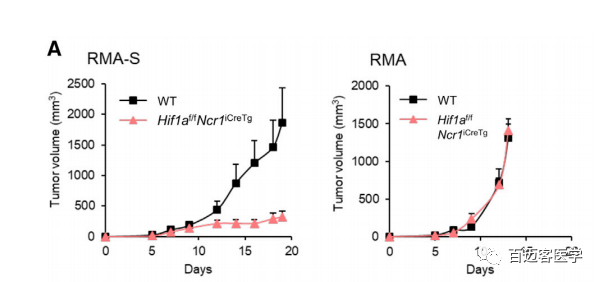
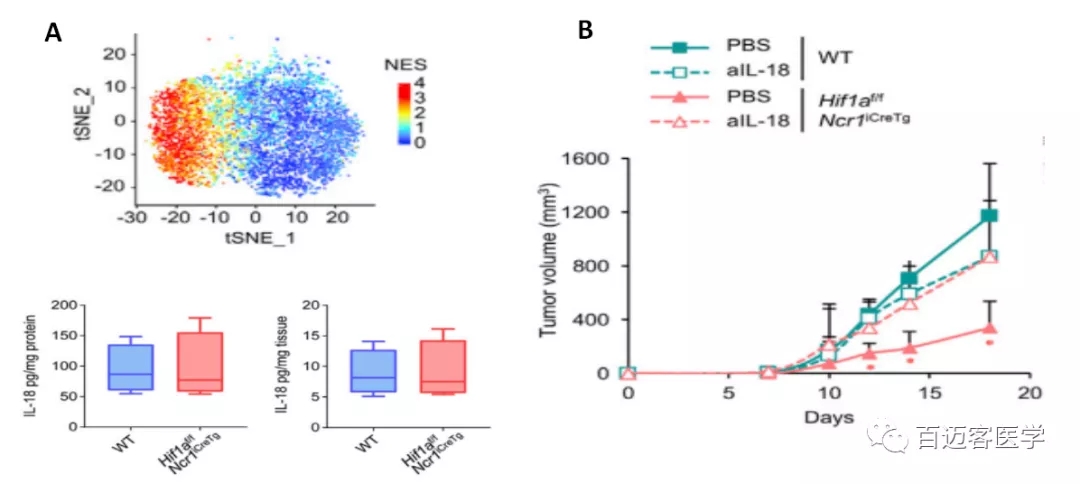
为了探究HIF-1α在长时间暴露于缺氧环境和实体肿瘤组织中NK细胞中的作用,构建NKp46+细胞中缺失Hif1a的模型鼠(Hif1af/fNcr1iCreTg),其他免疫细胞具有相似Hif1a表达量的小鼠作为野生型(WT)对照,皮下注射106个RMA-S淋巴瘤细胞,MHC I缺陷型导致WT小鼠肿瘤生长,模型鼠的肿瘤尺寸明显较小,而MHC I表达型肿瘤尺寸没有明显变化(图1A)。这表明HIF-1a在调节NK细胞抗肿瘤活性中具有重要作用。
图1. RMA-S细胞(MHC缺陷型,左)和RMA细胞(MHC表达型,右)的肿瘤尺寸
2. 肿瘤浸润NK细胞的高通量ScRNA-Seq揭示在Hif1af/fNcr1iCreTg模型鼠中存在一个明显的NK效应亚群
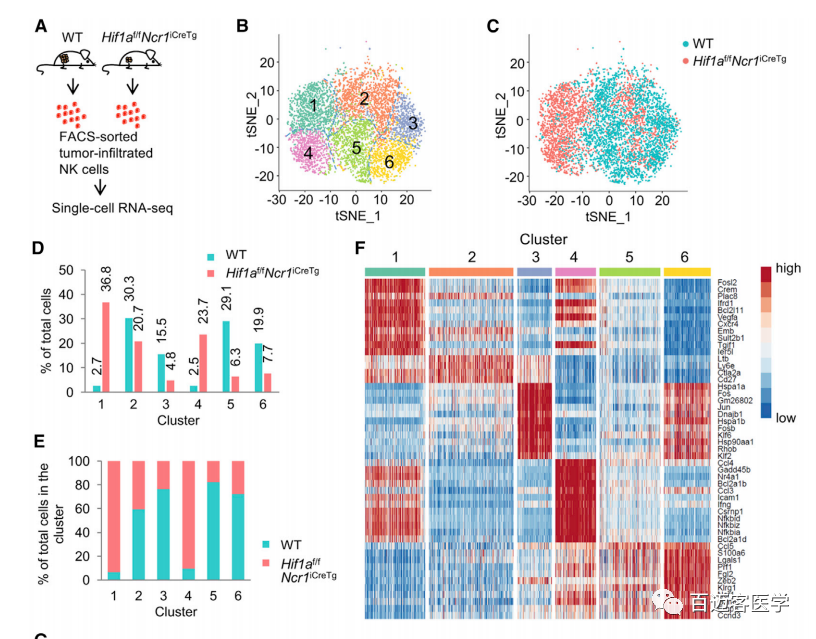
对5721个NK单细胞(3075个WT,2646个Hif1a-/-NK 细胞)进行scRNA-seq(图2A),聚类分析结果显示为6个不同类群(图2B),Hif1a-/- 和 WT NK细胞簇间分布具有明显差异(图2C),1簇和4簇中90%以上的细胞为Hif1a-/-NK细胞,而WT NK细胞大部分分布在2、3、5、6簇内(图2D)。在Hif1a-/-NK细胞中细胞因子IFN-γ (Ifng)和激活标记物CD69 (Cd69)的转录本明显增多(4簇,图2E),在WT NK细胞中虽然4簇占细胞总数的比例<10%,但在这些细胞中也表现出Hif1a低表达。在WT NK细胞中,Hif1a及其靶基因的低表达均与Ifng的转录本增加相关联。这充分说明HIF-1α对NK细胞活化和效应功能的调控起消极作用。
图2. A. WT和Hif1af/fNcr1iCreTg鼠注射RMA-S细胞两周后,进行单细胞RNA测序
B. 对5721个NK细胞进行聚类分析,得到6个不同亚群
C. Hif1a-/- 和 WT NK细胞在总细胞中的分布
D. Hif1a-/- 和 WT NK细胞所占百分比
E. Ifng和Cd69在4簇中高表达
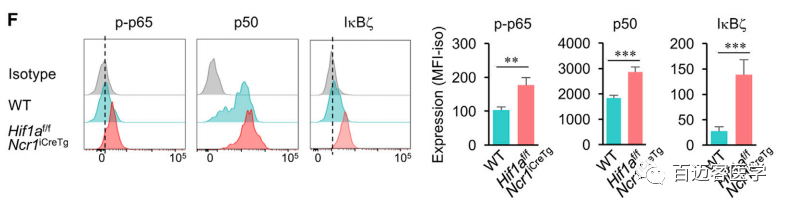
对WT和Hif1a-/-肿瘤浸润NK细胞间差异表达转录本的通路进行分析,发现在Hif1a-/-NK细胞中NF-κB途径及涉及NF-κB活性通路的富集,同样存在于1簇和4簇中。重要的是,NF-κB激活的富集与Ifng基因的高表达相关,这与之前由Bezman等人报道的NK细胞激活信号一致。为证明这一点,使用流式细胞仪检测磷酸化p65 (p-p65)、p50和IκBɝ的表达(图2F),结果证实了p-p65和p50的增加,以及IκBz的诱导,因此HIF-1a的激活负调控肿瘤微环境中NK细胞中NF-κB的活性及其靶基因的表达,阻碍其效应功能的获得和维持。
图2.F. 流式细胞仪检测磷酸化p65 (p-p65)、p50和IκBɝ的表达量
3. Hif1a -/- NK细胞的抗肿瘤活性依赖于来自骨髓细胞的IL-18
为了探究肿瘤浸润NK细胞中增强NF-κB活性的驱动因素, 分析了来自整个肿瘤组织的细胞因子和趋化因子转录谱。与scRNA-seq数据一致,Ifng是缺失Hif1a的模型鼠和WT小鼠肿瘤组织中上调最高的转录本,与Ifng一样,编码细胞因子IL-18的mRNA在缺失Hif1a的模型鼠肿瘤组织中也检测到较高的丰度(图3A),之前也有研究报道过IL-18可以诱导NK细胞中IkBz的表达和IFN-γ的产生。接下来,通过使用注射mAb消除IL-18来研究IL-18在RMA-S肿瘤控制中的作用(图3B),结果表明,HIF-1a的缺失增强了NK细胞对IL-18的反应,而IL-18在Hif1af/fNcr1iCreTg小鼠中是控制肿瘤生长所必需的。
图3.A.IL-18基因在肿瘤浸润NK细胞中的表达(上)及缺失Hif1a的模型鼠和WT小鼠中IL-18蛋白的含量(下)
B.肿瘤生长曲线图
4. 抑制小鼠NK细胞中的HIF-1α可导致效应功能增强和细胞代谢增加
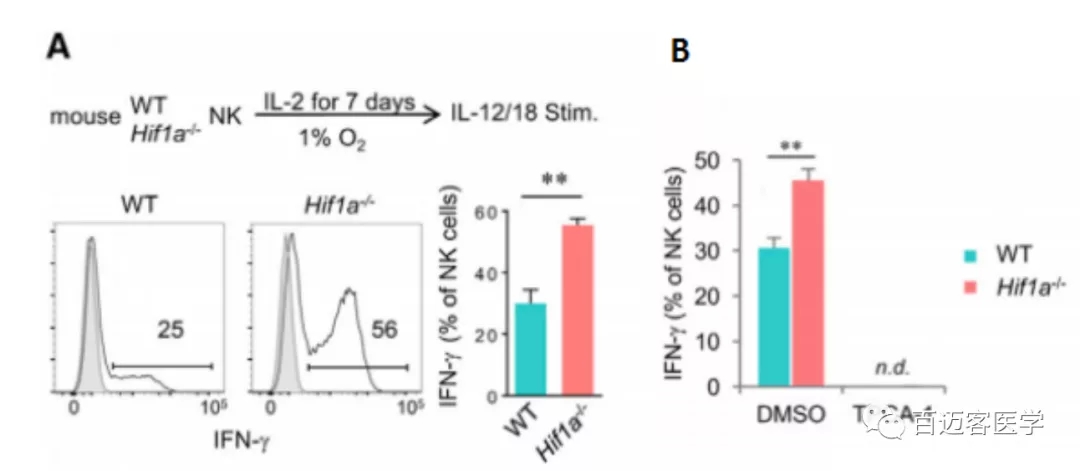
为了进一步证实在Hif1a-/-细胞中IL -18诱导效应功能的机制,模拟缺氧肿瘤微环境在体外培养Hif1a-/- 和 WT NK细胞7天,用IL-12和IL-18刺激后,Hif1a-/-NK细胞比WT NK细胞产生了更多的IFN-γ(图4A)。药理抑制剂TPCA-1对NF-κB激活有抑制作用,在不影响细胞活力完全阻止IFN-γ的产生(图4B)。证实了其需要下游的IL-18R来生产IFN-γ,除了IFN-γ,TPC A-1还影响了细胞毒性效应物颗粒酶B和穿孔素的表达,表明NF-κB通路参与了IL-18介导的NK细胞多种效应物功能的调控。
图4.A IL-12和IL-18刺激后,Hif1a-/-NK细胞比WT NK细胞产生了更多的IFN-γ
B药理抑制剂TPCA-1完全阻止IFN-γ的产生
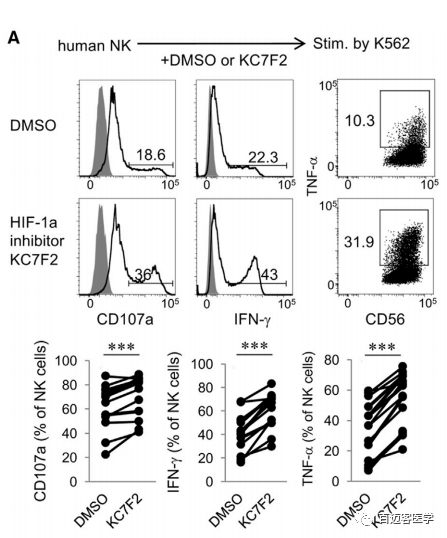
5. 在激活的人类NK细胞中抑制HIF-1α可导致效应反应增强
为了研究抑制HIF-1a是否以同样的方式增强人NK细胞的效应功能,用小分子化合物KC7F2(已报道具有抑制HIF-1a蛋白的稳定及其靶基因的转录功能)处理纯化的人外周血NK细胞。用KC7F2处理人NK细胞7天后,在IL-2存在的情况下,细胞脱粒以及IFN-γ和TNF-α(肿瘤坏死因子)的产生显著增强了,这些发现说明了HIF-1a抑制剂诱导人NK细胞提高功能的的潜力。为了研究HIF-1a是否会影响癌症患者NK细胞的抗肿瘤反应,分析了已发表数据集的单个NK细胞浸润非小细胞肺癌(NSCLC)和肿瘤周围组织的转录谱,我们观察到与肿瘤周围NK细胞相比,肿瘤浸润NK细胞高表达HIF1A与其靶基因表达升高和IFNG转录降低相关,NK- il18 - ifng信号降低,进一步支持了NK细胞在肿瘤中的消极调控,这与单个NK细胞中HIF1A的表达呈负相关。
图5.KC7F2处理人NK细胞7天后,细胞脱粒以及IFN-γ和TNF-α的产生显著增强
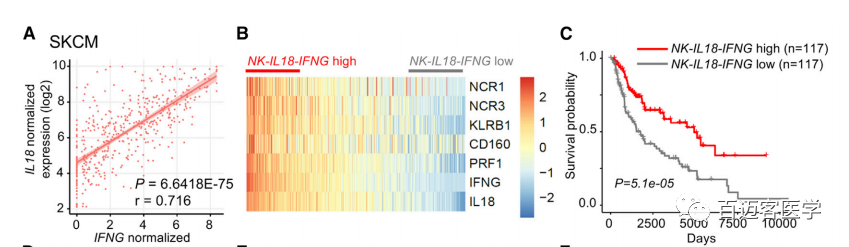
6. 一个NK-IL18-IFNGhigh信号预测着在不同癌症实体中总体存活率的提高
研究发现,在HIF-1a缺失的情况下,肿瘤微环境中IL-18的存在导致NK细胞反应增强,表现为NF-κB激活和Ifng表达,从而导致肿瘤生长减缓。因此,NK细胞中NK- il18 - ifng标记与HIF1A表达呈负相关。因此,我们的目的是分析在人类肿瘤样本中NK-IL18-IFNG的整体特征是否可能预测癌症患者的生存率提高。对自于469名皮肤黑色素瘤(SKCM)患者样本的分析显示,在SKCM肿瘤中IL18和IFNG基因表达呈正相关(图6)。NK-IL18-IFNGhigh信号与患者总体生存率相关,在乳腺癌(乳腺癌浸润性癌[BRCA],n = 1093)和宫颈癌(宫颈癌鳞状细胞癌[CESC],n = 304)患者中也发现了类似的相关性。
图6.SKCM肿瘤中IL18和IFNG基因表达呈正相关
总结
NK细胞在实体肿瘤中表现为不活跃的功能失调状态,在肿瘤微环境中诱导NK细胞活性的新策略有助于改进现有的NK细胞治疗方法。研究表明,在肿瘤微环境中,转录因子HIF-1a具有免疫检查的作用从而抑制NK细胞。NK细胞中Hif1a的缺失和HIF-1a抑制剂的使用释放了高效应功能,这种高效应功能主要表现在肿瘤反应性小鼠和人NK细胞中IFN-γ的产生。因此,选择性抑制NK细胞中的HIF-1a可能是改善NK细胞治疗实体瘤的一种有前景的策略。