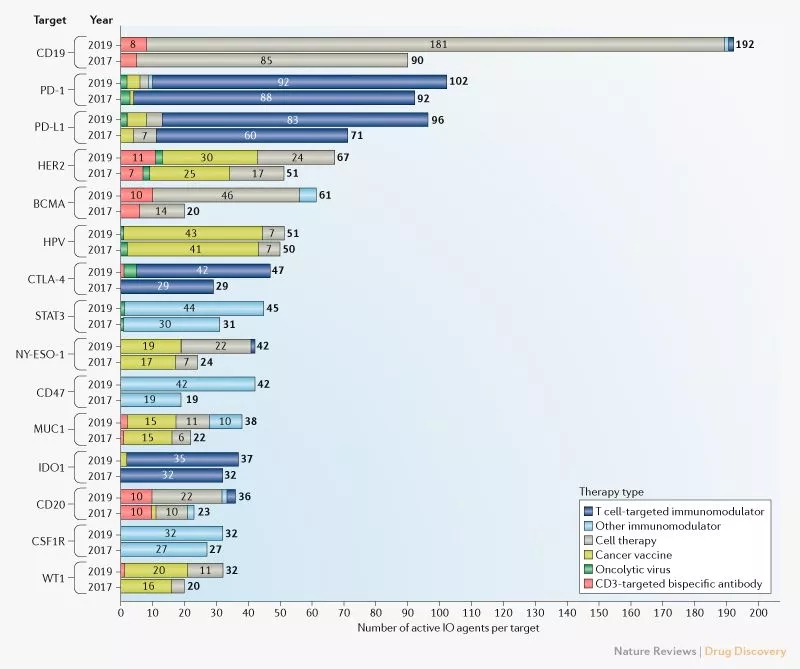
去年9月,美国癌症研究所(CRI)在Nature Reviews Drug Discovery上发表的一篇名为Immuno-oncology drug development goes global的研究论文,对肿瘤免疫治疗领域药物研发的全球概况进行了表述,在近两年时间内,CD19已超越PD-1和PD-L1,成为最热门的免疫肿瘤学靶点,随着CD19靶点的持续火热,靶向CD19产品的多样性也得到丰富,CAR-T、双抗、单抗、ADC等疗法都得到相应的开发。
▲ Top 15肿瘤免疫药物靶点
自CAR-T疗法发展伊始,CD19一直是最受欢迎的靶点,CD19-CAR-T疗法已在血液肿瘤中取得了巨大的成效。随着两款靶向CD19的CAR-T疗法--Kymriah和Yescarta相继获批上市,针对该靶点CAR-T疗法的开发热度被推向了高峰。
而预计在不久后,这个领域将又迎来4款CD19-CAR-T疗法。去年底,吉利德旗下的Kite和百时美施贵宝分别向FDA递交了其CD19-CAR-T疗法-KTE-X19(用于治疗复发或难治性套细胞淋巴瘤--MCL)和lisocabtagene maraleucel(用于治疗R/R BLBCL成人患者)的BLA。国内速度也很快,目前已有公司药企申请上市。2月24日,国家药品监督管理局(NMPA)已正式受理了复星凯特的益基利仑赛注射液的新药上市申请(NDA),用于治疗二线或以上系统性治疗后用于治疗R/R BLBCL成人患者。前两天(6月30日),药明巨诺也已向NMPA申报了CD19-CAR-T疗法JWCAR029{瑞基仑赛注射液(暂定)}的上市申请,适应症为复发难治淋巴瘤。随着新兴玩家的不断加入以及后续产品上市的推进已,该领域的市场竞争已进入白热化。
比之CD19-CAR-T火热的布局,虽然CD19单抗的赛道较为冷清,但已有CD19单抗走进市场的大门了。6 月 11 日, Viela Bio公司的抗 CD19 单抗(inebilizumab-cdon)已经获FDA 批准上市,用以治疗成人视神经脊髓炎谱系疾病 (NMOSD)。
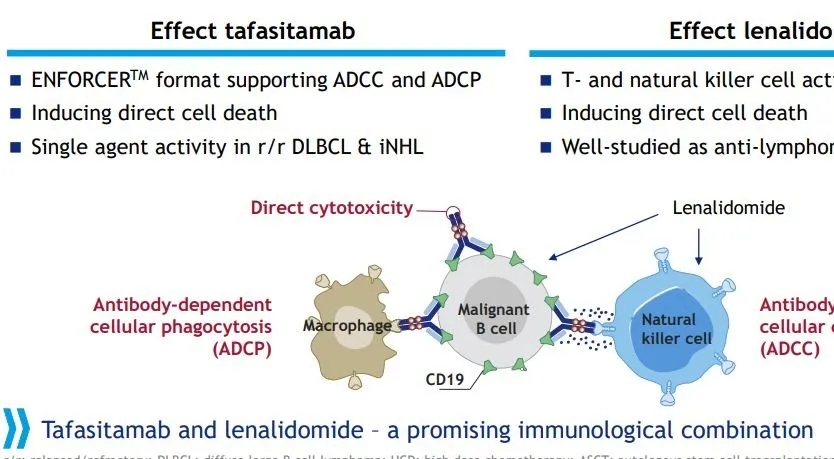
而另一款上市在即的CD19 单抗来自MorphoSys公司的tafasitamab,tafasitamab为靶向CD19的人源化Fc结构域优化的单克隆抗体,最初由Xencor公司开发。此后MorphoSys从该公司获得了开发和商业化Tafasitamab的全球独家授权。
MorphoSys对Tafasitamab的Fc端进行修饰,增强了抗体依赖性细胞介导的细胞毒作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP),以此改进杀伤肿瘤细胞的关键机制,在临床前模型中已验证通过结合CD19的tafasitamab可直接诱导癌细胞凋亡。
此前,在一项评估tafasitamab与那度胺组合治疗R/R DLBCL安全性和有效性的II期研究中,其总缓解率(ORR)为60%、完全缓解率(CR)为43%;中位随访17.3个月时,中位无进展生存期(PFS)为12.1个月;中位缓解持续时间(DOR)为21.7个月。中位随访19.6个月时,12个月生存率为73.3%。此外,在另一项为验证其联合治疗效果的Re-MIND的研究中,与来那度胺单药治疗相比,tafasitamab+来那度胺组合疗法临床优势显著,其ORR :67.1% (vs 34.2%),CR:39.5%( vs 11.8%)。
目前,tafasitamab的在美(2020年3月2日)和欧洲(2020年5月20日)的上市申请已获FDA和EMA受理,与来那度胺联合用于复发或难治性弥漫性大B细胞淋巴瘤(r/r DLBCL)患者的治疗。tafasitamab一并获得了FDA的优先审查权,由原先标准审查的10个月缩短至6个月。2020年1月14日,MorphoSys和Incyte达成9亿美元预付款+11亿美元里程碑付款的合作协议,以共同进行Tafasitamab的全球开发和商业化,MorphoSys和Incyte将在美国联合商业化,并且分摊收益和成本,Incyte拥有美国之外市场的独家商业化权利。
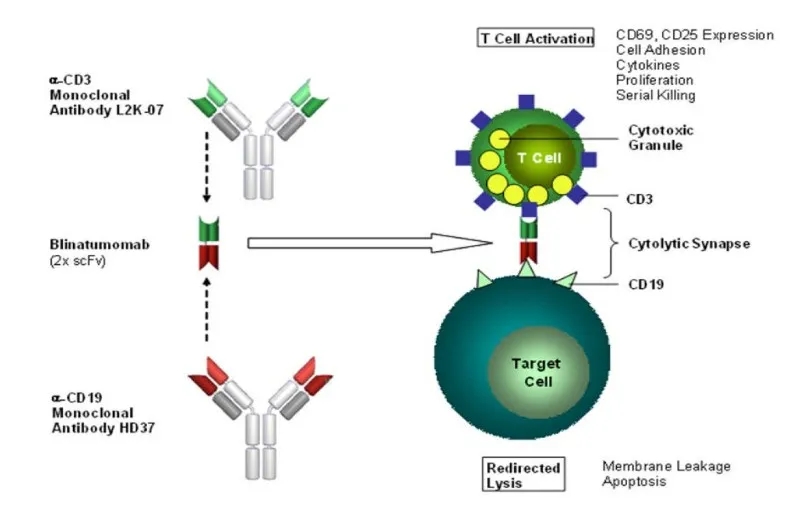
事实上,靶向CD19的药物开发中双抗是最早的。早在2014年,首个靶向CD19药物Blincyto(Blinatumomab)获得FDA批准上市。
Blincyto为Amgen基于BiTE®技术开发的同时向靶向CD3和CD19的双特异性抗体药,用于治疗急性B淋巴细胞白血病。去年10月,Blinatumomab也已在国内申报上市。
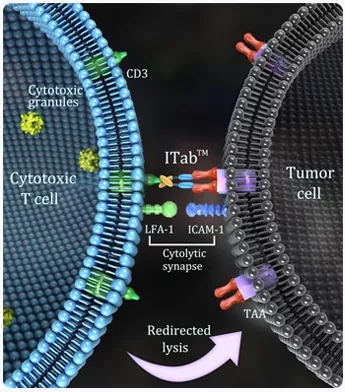
▲Blinatumomab双抗药物原理
另一款处于还处于在研的CD3×CD19双抗--A-319来自于健能隆,A-319基于健能隆自主研发的免疫治疗抗体平台(ITabTM)设计开发。A-319借助两个功能区分别与B肿瘤细胞表面抗原CD19及T细胞抗原CD3结合,在T细胞和肿瘤细胞之间形成突触,从而激活T细胞并引起肿瘤细胞溶胞而死亡。2018年11月,A-319的IND获得NMPA批准,2019年4月,A-319正式开始临床试验。
ITab 作用机理
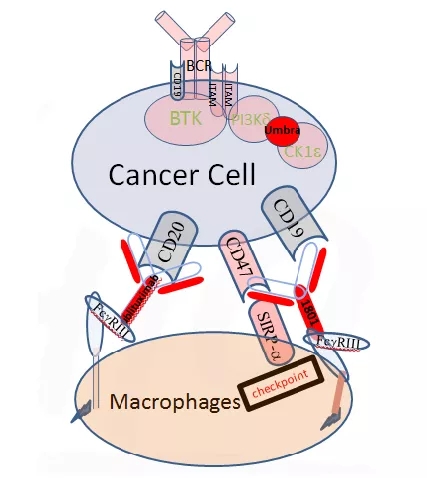
CD47×CD19
TG-1801是目前首个启动Ⅰ期临床的抗CD47/CD19双特异性抗体,是一种完全人源化的IgG1。TG-1801除了保有常规CD47单抗的有利特征外,还添加了双特异性功能,提高了其特异性和安全性。TG-1801能有效提供抗B细胞肿瘤吞噬的活性,避免了与之前靶向CD47通路药物相关的毒性问题。此外,CD47和CD19的共同靶向不仅增强了预期安全性,而且通过保留其IgG1 Fc的功能,该试剂还可以诱导抗体依赖性细胞毒性(ADCC),提供抗肿瘤活性的第二机制。
2019年6月17日,TG Therapeutics宣布,TG-1801的临床前数据得到的新的结果。该公司首次在抗CD47/CD19双特异性抗体中,显示TG-1801与ublituximab(公司的抗CD20单克隆抗体)和umbralisib(公司的PI3K-delta抑制剂)联合应用的协同效应。
此外,罗氏的4-1BB/CD19双抗--RO7227166也在Ⅰ期临床阶段,用于治疗难治性/复发性非霍奇金淋巴瘤。Oxis生物科技与明尼苏达大学共济会癌症中心合作开展的CD19/CD22双特异抗体OXS-1550治疗白血病和淋巴瘤的Ⅰ/Ⅱ期临床研究。
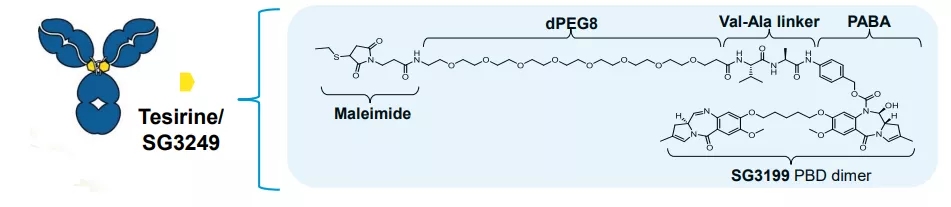
ADC--Loncastuximab tesirine
Loncastuximab tesirine是由靶向CD19的人源化单克隆抗体与细胞毒素-吡咯并苯并二氮杂(PBD)二聚体偶联而成的抗体-药物偶联物(ADC),当与表达CD19的癌细胞结合时,loncastuximab tesirine就被癌细胞内吞吸收,随后释放毒性弹头,杀死癌细胞。目前,ADCT-402正在进行治疗R/R DLBCL的Ⅱ期临床试验。
▲ ADCT-402结构
除了作为单药进行临床试验,目前loncastuximab tesirine还在进行与ibrutinib联用治疗R/R DLBCL或套细胞淋巴瘤(MCL)的Ⅰb期临床试验及与Durvalumab联用治疗R/RDLBCL、MCL及滤泡性淋巴瘤(follicular lymphoma)的Ⅰb期临床试验。日前,ADCT-402已被FDA授予治疗R/R DLBCL和MCL的孤儿药指定。
近日(2020年1月10日)ADC Therapeutics公布了loncastuximab tesirine 在(ADCT-402)治疗复发性或难治性弥漫性大B细胞淋巴瘤(r/r DLBCL)患者中Ⅱ期临床试验已经超过其主要终点,总缓解率(ORR)为45.5%(66/145),包括20%完全缓解和25.5%部分缓解,显示可控的毒性。
以上小编仅介绍了几款靶向CD19的CAR-T、双抗、单抗、ADC等疗法进展最快的代表性产品,其他在研的亦有不少,但从目前对CD19靶点布局的形势来看,开发热度基本可以比肩PD-1,而可以预见的是,随着肿瘤患者从CD19靶向药治疗中的受益面扩大,药企们对CD19的钟爱程度也不会消减。
虽然2014年就有靶向CD19药物获批上市,但没有使得CD19受到足够重视,得以广泛开发应用,CAR技术的成功让CD19一站成名,全球各大药企都已投入到CAR-T疗法的开发当中。现在CD19单抗也紧跟上老大哥的步伐,即将与之展开同台竞技,其后联合其他靶标的双抗、ADC的队形也已摆好,即将登上肿瘤免疫治疗的大舞台。
1.10.1038/d41573-019-00167-9