重磅!FDA批准首个iPSC衍生的通用型CAR-T疗法IND申请
7月9日,Fate Therapeutics宣布,美国FDA已经批准首个iPSC来源的同种异体CAR-T细胞疗法FT819的IND申请,用于治疗复发/难治性B细胞恶性肿瘤,包括慢性淋巴细胞白血病(CLL)、急性淋巴细胞白血病(ALL)和非霍奇金淋巴瘤(NHL)。
首个iPSC来源的CAR-T
-
源自克隆主工程iPSC系,使CAR-T细胞可以大量生产和现货供应; -
为了预防移植物抗宿主病(GvHD),其完全消除了T细胞受体(TCR)的表达; -
结合一个新的1XX CAR信号域,它可扩展T细胞的效应功能而不引发衰竭; -
将CAR转基因(靶向CD19的新型1XX CAR)直接插入到T细胞受体α恒定(TRAC)位点,可以促进统一的CAR表达和增强T细胞的效力。
FT819的多中心Ⅰ期临床试验旨在确定FT819的最大耐受剂量,并评估其在297名成年患者(包括三种类型B细胞恶性肿瘤,CLL、ALL和NHL)中的安全性和临床活性。每个适应症将独立注册并评估三种剂量递增的治疗方案:方案A为单剂量FT819;方案B是在IL-2细胞因子支持下的单剂量FT819;和方案C为三种剂量的FT819。对于每种适应症和方案,可能会纳入多达15名患者的剂量扩大组以进一步评估FT819的临床活性。
iPSC:推进细胞疗法产业化的重要支柱
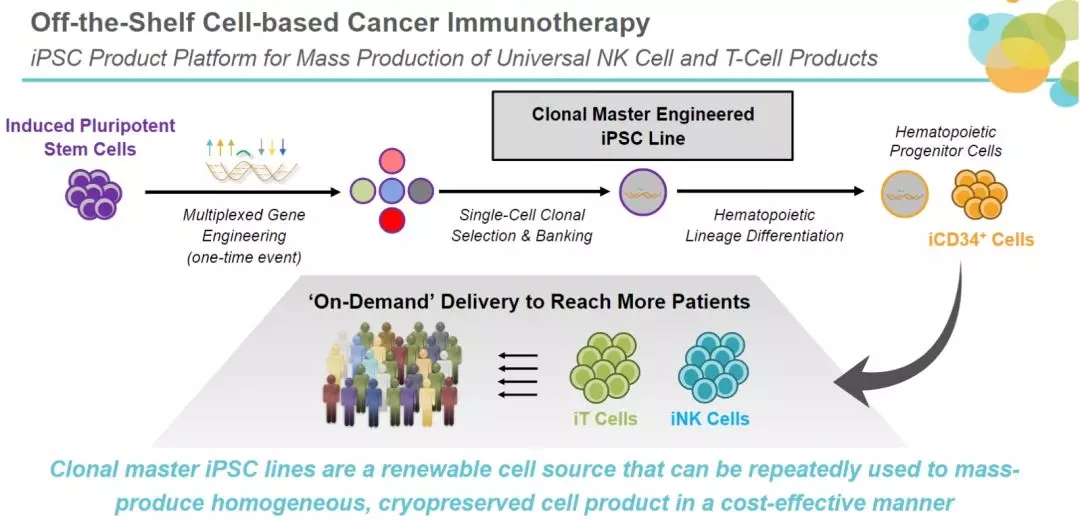
▲ 用于大规模生产通用NK/T细胞产品的iPSC产品平台(图片来源:Fate)
基于其iPSC平台,Fate公司建立了广泛的现货型细胞疗法产品管线,其中主要包括iPSC来源的CAR-T、CAR-NK和NK细胞等疗法,正在血液肿瘤和实体瘤中进行探索。
-
FT596是一种现货型、iPSC衍生的CAR-NK细胞疗法,其具有三种抗肿瘤模式(表达CD19 CAR、新型高亲和力不可裂解的CD16 Fc受体、IL-15RF)。2020年4月2日,Fate宣布已经完成FT596在B细胞淋巴瘤和慢性淋巴细胞白血病的临床研究的首例患者给药。
-
FT500 和 FT516是现货型、iPSC衍生的NK细胞疗法,目前处于临床Ⅰ期。FT500是第一个在美国获批临床的源自克隆主iPSC系的细胞疗法,用于晚期实体瘤患者。FT516在FT500的基础上在细胞表面表达了不可裂解的CD16 Fc受体,从而优化了ADCC,目前正在Ⅰ期临床试验中作为治疗急性髓细胞白血病(AML)的单一疗法,以及与利妥昔单抗(CD20单抗)联合治疗晚期B细胞淋巴瘤。
-
F538是首个CRISPR编辑的、iPSC衍生的现货型NK细胞疗法,其被工程化设计了三种功能成分来增强先天免疫:新型高亲和力不可裂解的CD16 Fc受体、IL-15RF、CD38表达的消除。2020年5月20日,F538获美国FDA批准其IND申请,Ⅰ期临床将评估FT538作为单一疗法(多剂量)治疗AML,以及联合抗CD38单克隆抗体治疗多发性骨髓瘤。
结语
随着现货细胞疗法的发展,利用一个供体为许多患者提供CAR-T等免疫细胞疗法将成为可能,而这将对该领域产生颠覆性的影响。毫无疑问,正如Fate公司所追求的那样,iPSC来源的细胞疗法正在成为热潮。Mesoblast与Cartherics、武田制药公司与京都大学的CiRA(iPS细胞研究与应用中心)、Century Therapeutics等也纷纷致力于此。
同时,这一领域也博得了大型药企的青睐。今年4月初,强生(Johnson & Johnson)旗下杨森(Janssen)生物就与Fate Therapeutics达成了高达31亿美元的合作协议,该合作将利用Fate公司的iPSC产品平台和杨森公司专有的肿瘤抗原binders来创建新型CAR-NK和CAR-T细胞候选产品,用于血液系统恶性肿瘤和实体瘤。
随着技术的发展,我们有理由相信,像iPSC这样来源的现货型细胞治疗将成为未来细胞疗法领域的重要方向,有望为更多患者提供可获得的治疗途径。
参考资料:
https://www.streetinsider.com/dr/news.php?id=17097583&gfv=1&from=groupmessage
Fate公司官网