【Nature子刊】弗吉尼亚大学李辉团队:鉴定出胶质母细胞瘤的致癌基因,致命性脑瘤治疗有希望
导言:胶质母细胞瘤(GBM)是最为常见且最致命的脑部肿瘤,这种肿瘤生长速度快,70%~80%患者病程在3~6个月,病程超过1年者仅10%。近日,美国弗吉尼亚大学李辉团队鉴定出了胶质母细胞瘤的一个重要致癌基因,为这种致命的癌症揭示了一个新的治疗靶点。
癌基因对癌细胞的生存至关重要。没有它们,癌细胞就会死亡。科学家们已经开发出许多癌症的针对性治疗方法,而这些癌症都具有类似的“癌基因成瘾性”。癌基因成瘾是指肿瘤细胞依赖过度活跃的基因或途径以实现其生长和存活。近日,有科学家鉴定出了胶质母细胞瘤(GBM)的一个重要致癌基因,有望成为这种致命性脑瘤的一个新治疗靶点。
这项研究由美国弗吉尼亚大学医学院和癌症中心的李辉教授领导,并发表在《自然通讯》上,题目为“A cytoskeleton regulator AVIL drives tumorigenesis in glioblastoma”
李辉教授说:“胶质母细胞瘤是最致命的癌症之一。然而不幸的是,这种疾病目前还没有有效的治疗方法。目前的标准选择还是放疗结合替莫唑胺,尽管只能延长2.5个月的生存期,也被认为是一个巨大的成功。显然,我们迫切需要更深入的研究和新的治疗靶点。我们发现的这个新的致癌基因或许是胶质母细胞瘤的致命弱点,其特异的靶向性可能成为治疗该病的有效途径。”
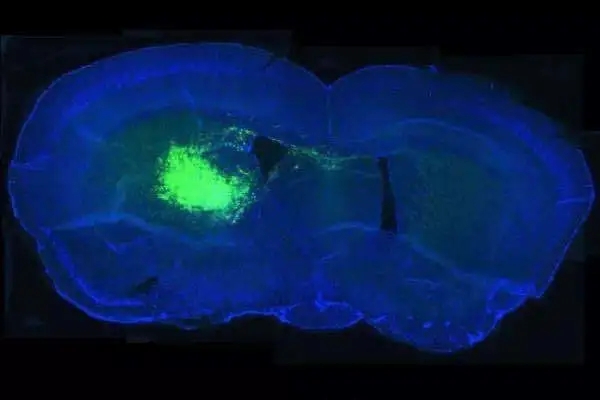
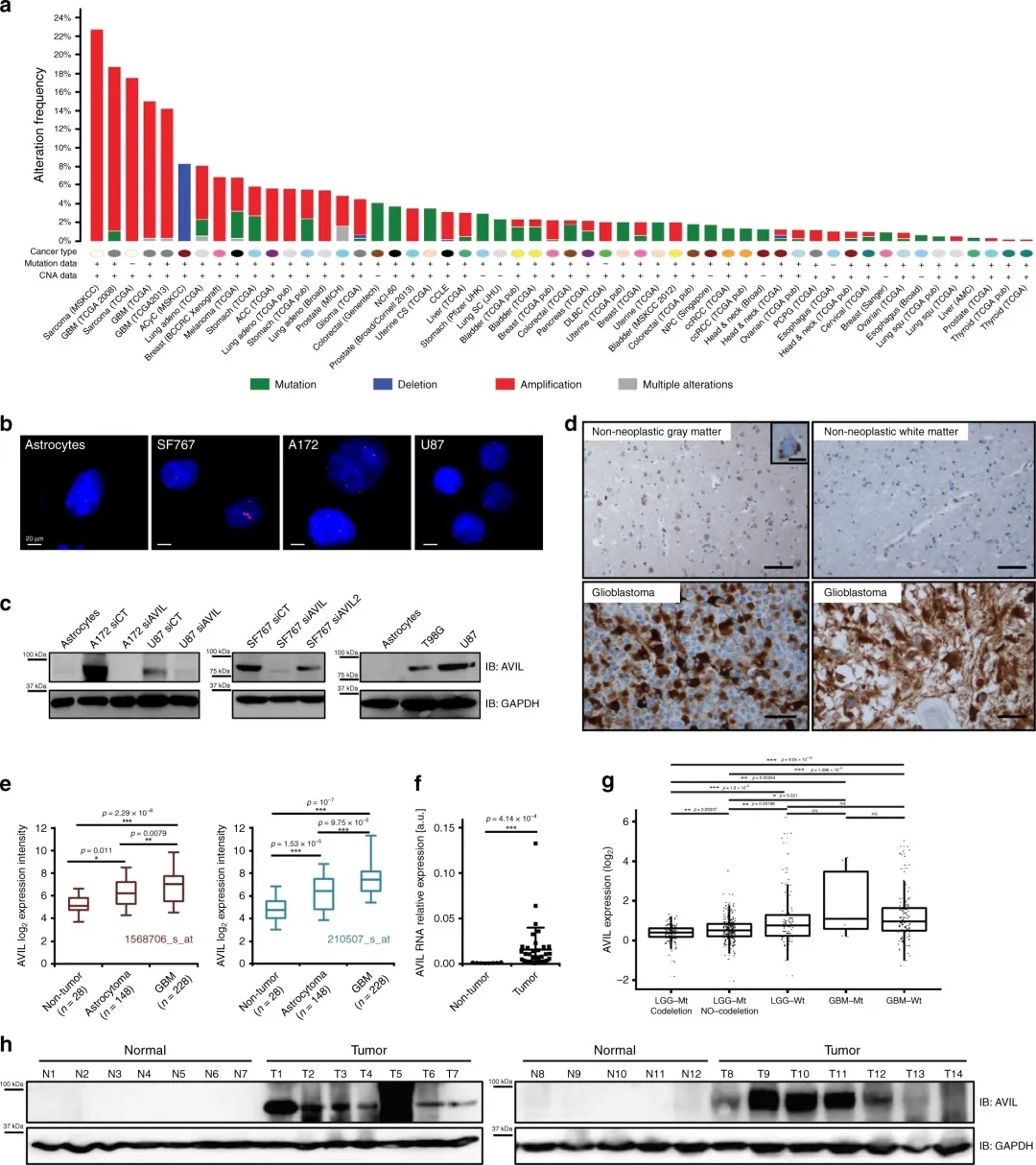
AVIL在胶质母细胞瘤中过表达
癌基因AVIL通过调节F-肌动蛋白来调节细胞骨架,从而负责维持细胞的大小和形状,但是该基因可以通过多种因素诱导而过表达,这就引起了癌细胞的形成和扩散。研究人员发现, AVIL基因在所有的胶质母细胞瘤细胞和临床样本中都有过表达现象,并且在胶质母细胞瘤干细胞中的表达水平更高,但在正常细胞和组织中几乎不表达。
AVIL在胶质母细胞瘤中过表达
AVIL是真正的致癌基因
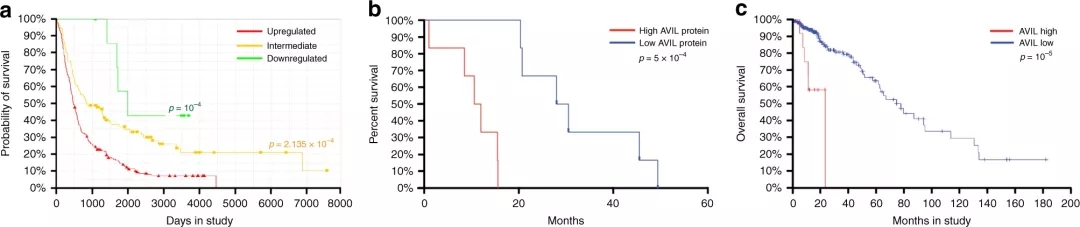
之后,研究人员发现,通过沉默该基因,可以清除胶质母细胞瘤细胞,抑制小鼠体内异种移植的肿瘤细胞,但对正常对照细胞没有影响。研究还发现,在临床上,AVIL的高表达与患者预后不良相关。这些发现和经典的转化试验证明,AVIL是真正的癌基因。阻断该基因的活性,可以完全破坏实验室小鼠的胶质母细胞瘤,但不会对健康细胞产生影响。这表明,靶向该基因可能是一种有效的治疗选择。
AVIL过表达与患者的临床预后较差有关
复杂的鉴定过程
正如李辉及其同事所做的那样,鉴定癌基因是开发治疗方法的重要一步。但是鉴定致癌基因非常困难。因为细胞内部的环境非常复杂,所以很难确定其中的因果关系。
当李辉和他的团队有了第一次发现,当时他们并没有从事胶质母细胞瘤的研究。相反,他们正在研究一种罕见的儿童癌症,称为横纹肌肉瘤。与成人的癌症相比,儿童癌症通常更容易研究并且涉及的突变更少。在2016年,李辉团队在《美国国家科学院院刊》(PNAS)上发表了“Fusion transcriptome profiling provides insights into alveolar rhabdomyosarcoma”一文,从干细胞肌肉分化发生的融合基因事件入手,分析了横纹肌肉瘤细胞的起源,这是首次从融合基因的角度来研究肿瘤细胞的起源。
在后来的研究当中,他们发现了AVIL基因的异常。这促使他们转而研究成人癌症,以了解该基因是否可能在其中起作用。结果也确实是这样。研究人员得出结论,该基因在胶质母细胞瘤中起着“关键作用” 。
李辉团队认为,他们的方法可用于发现其他致癌基因,并有望为各种癌症带来新的治疗方法。
他们还表示:“在这个时代,许多人认为所有重要的癌基因都被发现了,但如今,我们又发现了一种新型的强大癌基因,并阐明了其信号传导途径,所有这些发现都始于研究儿科癌症的结构变异。过去,许多癌症方面的重大发现也源于对儿童肿瘤的研究。我们认为这是一种可以用于寻找其他成人癌症新发现的策略。”
李辉教授
参考:
【1】Xie, Z., Janczyk, P.Ł., Zhang, Y. et al. A cytoskeleton regulator AVIL drives tumorigenesis in glioblastoma. Nat Commun 11, 3457 (2020). https://doi.org/10.1038/s41467-020-17279-1
【2】https://medicalxpress.com/news/2020-07-scientists-id-gene-responsible-deadly.html
【3】https://www.nature.com/articles/s41467-020-17279-1
【4】https://mip.haodf.com/zhuanjiaguandian/1134101071.htm
【5】https://www.pnas.org/content/113/46/13126
【6】http://www.ebiotrade.com/newsf/2016-11/2016111113752246.htm