胃癌是世界上发病率最高的恶性肿瘤,不论性别,其发病率均占各种癌症的首位。而中国,又是胃癌高发大国,在胃癌高发的亚洲地区,由于人口基数的问题,中国贡献了东南亚地区绝大部分胃癌患者。
Claudin 蛋白是组成细胞间紧密连接的一种跨膜蛋白,它的功能主要是调节屏障结构的渗透性。其中Claudin 18.2 是一个高度特异性的细胞表面分子,在正常的组织中仅表达在分化的胃粘膜上皮细胞上,在原发胃癌及转移癌症中大部分都表达。除此之外,肺癌,胰腺癌,卵巢癌中也能观察到18.2 分子的激活表达。作为一个高度特异,及细胞膜表面表达的蛋白,18.2 当之无愧成为单克隆抗体药物的理想靶点
2016年,Ganymed 在ASCO 会上公布了Claudin 18.2 新型首创抗体 Zolbetuximab(IMAB362) 联合或不联合化疗用药EOX治疗Claudin18.2 阳性胃癌以及胃食管交界腺癌时,显著延长患者的中位总生存期。自此之后,Claudin 18.2 一举成为热门靶点, 成为抗肿瘤药物里浓墨重彩的一笔。
除了安斯泰来黑马级别的IMAB362已经进入临床三期阶段,国内也有三家Claudin 18.2 抗体申报临床。2019年12月4日,科济生物宣布人源化18.2 抗体用于治疗Claudin 18.2 阳性实体瘤患者的临床试验;2020年4月13日,奥赛康药业宣布Claudin18.2人源兔抗体ASK589的临床申请获得NMPA受理;2020年4月20日,创胜集团宣布苏州子公司迈博斯生物开发的人源化单克隆抗体(TST001)获得美国食品药品监督管理局颁发的临床试验批件。除此之外,国内还有多家制药企业在进行Claudin 18.2 靶向药物的开发, Claudin 18.2 的研发热度不亚于PD1,因此如何更快的获得更好的抗体,在第一梯队上获得一席之地尤为重要。
3. Claudin 18.2 重组蛋白的研发挑战以及恺佧生物的对策
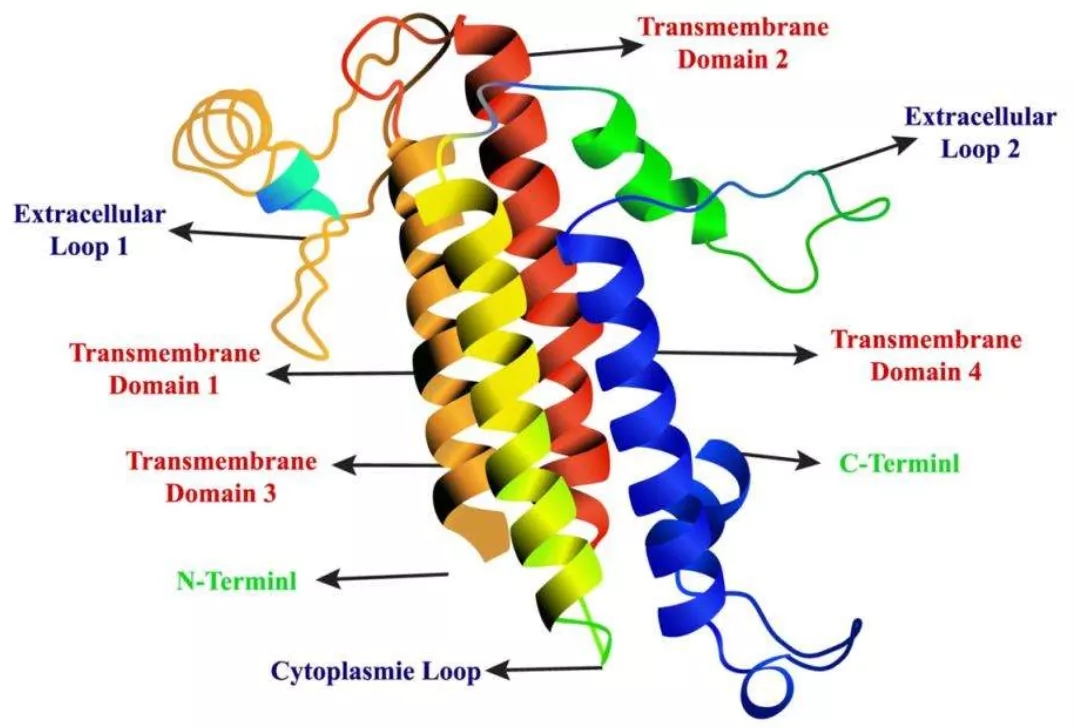
从蛋白本身来讲,18.2 具有4个跨膜结构域,两个胞外环,NH2端和COOH端位于胞内。传统的单次跨膜蛋白例如PD-1,PD-L1,只需表达胞外结构域(ECD)区即可保持完整的构象。但多次跨膜蛋白的胞外环(Loop)不是一个独立的结构域(Domain), 如果仅仅表胞外段,不能维持一个正确的构象,需要跨膜段的束缚才会保持正确的构象。这给蛋白表达大大增加了难度。因此,大多数Claudin18.2 的抗体还是来自于细胞系和DNA 免疫,当然也包括Claudin 家族的其他成员以及GPCR。
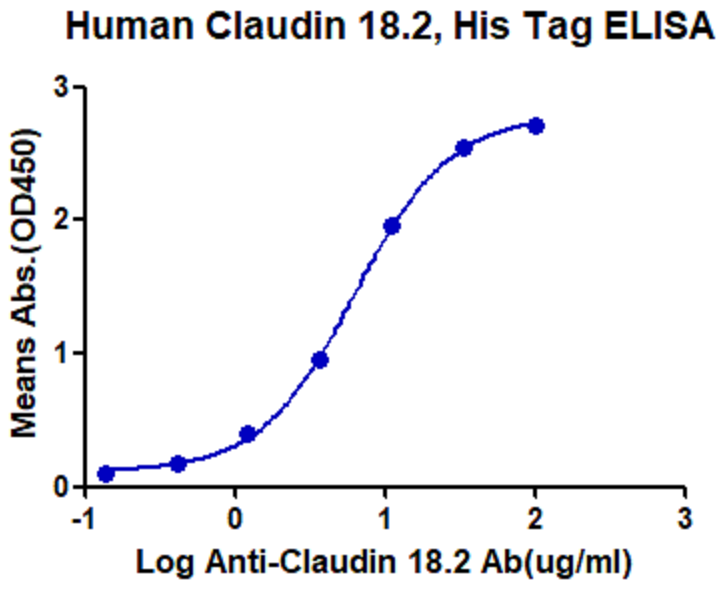
恺佧生物基于结构约束(structure constraints)及建模(structure modeling)设计了展示Claudin18.2膜蛋白功能结构域和表位的重组蛋白,该蛋白完整的展示了蛋白的两个胞外环。适用于Claudin 18.2 的QC放行等试验。通过ELISA 实验验证,Claudin 18.2 重组蛋白和IMAB362 有良好的结合曲线。
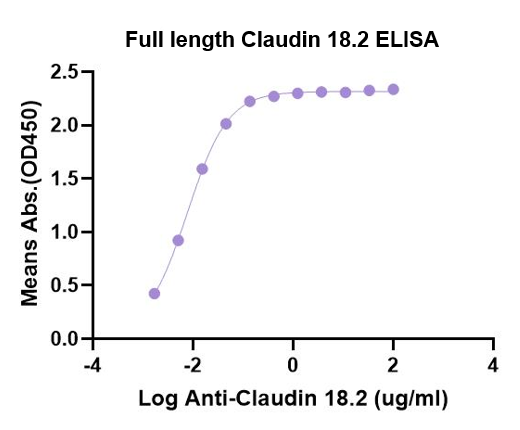
除此之外,恺佧生物通过特殊的表达手段,成功的获得了天然全长的Claudin18.2 蛋白,所谓全长,即具有完整的跨膜段,胞外段和胞内片段,不突变,不替换,不剪辑。全长18.2 蛋白的产生可以替换传统的免疫方式,获得抗体。通过ELISA 实验验证,全长Claudin 18.2 蛋白和IMAB362 也能很好的结合,且具有更高的亲和力
产品信息:

目前国内多家抗体药研发药公司已采用恺佧公司的Claudin 18.2 用于QC放行和临床申报。
恺佧生物(Kactus Biosystems)是一家以研发为驱动的创新型蛋白抗体类国际化生物高科技公司,主要专注于免疫治疗和诊断市场。恺佧生物聚焦于全球创新药研发企业客户,提供基于结构设计的功能靶点蛋白特别是膜蛋白类CRO服务和目录产品。恺佧生物主要创始团队来自于世界一流的企业和研究机构并有多年生物医药行业经验的科学家和商业管理人士。