独家原创|CD47 相关信号通路及其与相关疾病关系的研究进展
专家介绍:徐寒梅
中国药科大学生命科学与技术学院教授,博士生导师,海洋药学教研室主任,江苏省合成多肽药物发现与评价研究工程中心主任。近 5 年以来,先后主持:国家自然科学基金,国家“863”高科技发展计划,国家“十一五”、“十二五”、“重大新药创制”科技重大专项,江苏省校企合作前瞻性研究等项目,近 5 年带领课题组(包括南京大学、武汉大学、广州药学院、医药企业)获得国家资助 3 800 余万元,并带领团队成功申报多个 1 类新药临床批件。因与企业合作抗肿瘤多肽研究的表现获得内蒙古自治区“杰出创新引进人才”奖,“草原英才”,近 5 年先后获得江苏省“青蓝工程”优秀骨干教师,中青年学术带头人,南京市领军人才等奖励和称号,因为产学研合作的表现被内蒙古自治区政府聘为科技特派员,被教育部“蓝火工程”聘为泰州市科技特派员。
CD47 相关信号通路及其与相关疾病关系的研究进展
葛闯 , 胡加亮 , 徐寒梅 *
(中国药科大学 江苏省合成多肽药物发现与评价工程研究中心,江苏 南京 211198)
[摘要]CD47 是一种在细胞表面普遍表达的糖蛋白,能与多种胞内外蛋白如凝血栓蛋白 1(TSP1)和信号调节蛋白 α(SIRPα)发生相互作用,参与多种信号通路的调控,这些信号通路在多种疾病如肿瘤、心血管疾病和自身免疫性疾病的发生和发展过程中起着重要的作用。通过重点阐述 CD47 的结构、表达、与其他蛋白的相互作用、相关的信号通路以及其与疾病的关系,以期为靶向 CD47 的治疗策略的开发提供帮助。
整合素相关蛋白 CD47 最初发现于无 Rh 抗原性溶血性贫血患者体内,其血红细胞缺乏CD47。前期研究发现,CD47 与整合素 αvβ3,αⅡbβ3 和 α2β1 相互作用,调节整合素功能和调节细胞对含有精氨酸-甘氨酸-天冬氨酸的胞外基质蛋白的应答,因而被称作整合素相关蛋白。CD47 在多种肿瘤中表达升高,如卵巢癌、白血病、乳腺癌、结肠癌、膀胱癌、胶质母细胞瘤、肝细胞癌和前列腺肿瘤等。研究表明,抗 CD47 抗体能够刺激巨噬细胞清除肿瘤细胞,因而 CD47 成为近年来研究的热点。
CD47 通过与胞外、胞内以及其他的跨膜蛋白的横向相互作用发挥不同的功能,介导了不同的信号转导通路,这些信号通路在肿瘤、血管类疾病、自体免疫性疾病等多种疾病中发挥着不同作用。
1CD47 结构、表达与相互作用
1.1 结构
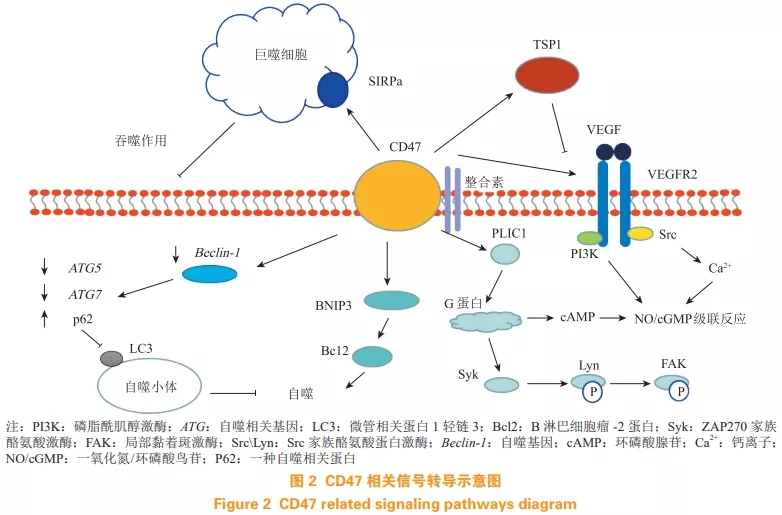
CD47 属于免疫球蛋白超家族,有 2 种异构体,一种含有 N 糖基化修饰,另一种在其 64 位和 79 位丝氨酸含有糖胺聚糖修饰。CD47 结构包含 3 个部分,N 末端胞外免疫球蛋白多变(IgV)结构域、高度疏水的 5 次跨膜片段和 1 个短的多变 C 末端胞内段,如图 1 所示。
CD47 通过胞外段 IgV 结构域与其配体凝血栓蛋白 1(thrombospondin 1,TSP1)和信号调节蛋白 α(signal regulatory protein alpha,SIRPα)相互作用,IgV 结构域被 N 糖基化和 O-连接型糖胺聚糖修饰,糖胺聚糖修饰是 CD47 与 TSP 相互作用所必需的。IgV 结构域上的氨基酸残基 Cys33 与跨膜区最后一个胞外环上的氨基酸残基 Cys263 之间存在长二硫键,这一二硫键对于 CD47 配体的结合、信号转导以及定位到脂筏都是必要的。胞内段存在 4 种可变剪接体形式,根据基因结构、多肽序列不同,分为Ⅰ型、Ⅱ型、Ⅲ型和Ⅳ型,氨基酸数量从 3~36 个不等。Ⅱ型是目前最主要的、表达最多的异构体,其次是Ⅳ型,Ⅳ型主要在脑部和外周神经系统表达,而 I 型只在角质细胞中显著表达,Ⅲ型主要与记忆巩固相关。
1.2 表达
CD47 在几乎所有的细胞表面都有表达,包括红细胞和血小板,其表达水平因机体的免疫状态或病理状态不同而改变。CD47在多种肿瘤中表达较高,并且通过阻断CD47 能够增强肿瘤的吞噬作用。Xu 等发现抗 CD47 治疗可增加巨噬细胞的吞噬功能,降低肿瘤重量,并抑制骨肉瘤异种移植模型中的自发转移。Zhang 等发现阻断 CD47 可增强巨噬细胞对肿瘤细胞的吞噬作用,减轻肿瘤负荷,提高胶质母细胞瘤患者的存活率。同样地,Yoshida等也发现通过阻断 CD47 能增强巨噬细胞对胃癌细胞的吞噬作用。以上均表明 CD47 可能是肿瘤细胞的一个重要生存信号分子,与肿瘤发生发展密切相关。在免疫应答过程中,CD47 在 CD4 效应 T 细胞表面表达升高,防止记忆性 T 细胞被巨噬细胞清除,延长生存周期。同样,造血干细胞(hematopoietic stem cells,HSCs)表面 CD47 高表达也使其免受巨噬细胞吞噬,而当 CD47 在 CD34+ CD38-HSCs 表面表达选择性下调时,就有可能发生噬血细胞综合征(hemophagocytic lymphohistiocytosis,HLH)。
1.3相互作用
CD47 通过胞外 IgV 结构域主要与 3 种胞外配体相互作用,分别为 CD47-TSP1、CD47-SIRPα 及CD47-CD47。由于 CD47 胞内结构域较小,只有有限的几种胞内信号蛋白与 CD47 相互作用,主要是促凋亡调节蛋白(BCL2/adenovirus E1B 19 kDaprotein-interacting protein 3,BNIP3)以及连接整合素相关蛋白和细胞骨架蛋白(protein-linking integrinassociated protein and cytoskeleton,PLIC)。而 CD47 与其他跨膜蛋白的横向相互作用可能在CD47 的信号转导通路中发挥着重要作用,如整合素 αvβ3、血管内皮细胞生长因子受体 2(vascular endothelial growth factor receptor 2,VEGFR2)、Rh血型抗原肽复合物、CD47、自杀相关因子(factor associated suicide,Fas)、CD14 等。
1.3.1 胞外相互作用 首先被发现的 CD47 内源性配体就是 TSP1。TSP1 属于 TSP 家族成员之一,这一家族除了 TSP1 之外,还包括 TSP2 ~TSP5。TSP1是一种瞬时表达的细胞基质蛋白,在不同环境中,通过与细胞表面受体或其他的胞外基质成分相结合调节细胞功能。TSP1 结构很大,包含多种结构域,使其能与多种细胞表面受体和胞外基质相互作用,包括整合素(主要是 β1 和 β3)、CD47、CD36、硫酸乙酰肝素蛋白多糖、低密度脂蛋白相关蛋白 1 和极低密度脂蛋白受体等。TSP1 通过其碳末端结合 结 构 域(C-terminal binding domain)上的 VVM 序列与 CD47 相结合,进而影响多种细胞功能,如细胞迁移和黏附、细胞增殖和凋亡、调节血管生成和炎症反应等。
第 2 个被发现的内源性配体是 SIRPα。SIRPα属于免疫球蛋白超家族,是一种跨膜蛋白,表达在骨髓细胞表面,如单核细胞、巨噬细胞、粒细胞和CD4 阳性树突状细胞,以及在中枢神经系统神经元细胞中以不同水平表达。SIRPα 在吞噬细胞表面表达水平似乎非常稳定,不会受到炎症水平的影响,而 CD47 的表达却随不同的免疫状态或疾病的改变而改变。SIRPα 胞外 N 末端包含 3 个 Ig 样结构域,1 个单一的跨膜结构域,胞浆 C 末端含有 4 个酪氨酸残基,带有 2 个免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motif,ITIM),ITIM 是酪氨酸磷酸酶 SHP(src-homology domain 2-containing protein tyrosine phosphatase)-1和 SHP-2 的结合位点,ITIM 介导 SHP-1 和 SHP-2 的募集和激活,使得磷酸化蛋白底物去磷酸化,从而影响胞内信号通路转导,如抑制生长因子受体和其他的一些促酪氨酸激酶活性受体的信号转导。SIRPα 通过其 N 末端 IgV 结构域与 CD47 的 IgV 结构域结合,SIRPα 与 CD47 之间的相互作用在控制细胞吞噬中发挥作用,能够产生一种“不要吃我”的信号。
除了与 TSP1 和 SIRPα 结合,也有研究表明,细胞间发生黏附需要 CD47 的存在而并不需要其配体,表明 2 个细胞上 CD47 的 IgV 结构域也存在着同型结合。不过这种 CD47 与 CD47 相互作用能否产生信号转导还缺乏足够的证据。
1.3.2 膜表面相互作用 CD47 首先被发现与整合素 αvβ3 存在相互作用,后续又发现其与多种整合素亚型相互作用,如 αⅡbβ3、α2β1、αLβ2、和 α4β1。CD47 通过其 IgV 结构域与整合素 αvβ3 发生相互作用,激活整合素,从而引发后续的胞内信号转导,而并不依赖其跨膜结构域。CD47 与这些整合素发生结合,相互作用,能够改变整合素信号靶点,如黏着斑激酶和桩蛋白,并且 CD47-整合素复合体还与三聚体 G 蛋白相关,参与调控 cAMP 信号转导。
CD47 能够与血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)以及 VEGFR2 发生相互作用。而 TSP1 能够通过 CD47 抑制 VEGF 下游信号级联通路。此外,免疫共沉淀和荧光共振能量转移表明,CD47 能够与 VEGFR2 直接发生相互作用,不过这种相互作用会因 TSP1 和 CD47 结合以及VEGF 与 VEGFR2 结合而被破坏,从而抑制 VEGFR2信号转导过程。
在红细胞中,CD47 与 Rh 抗原复合体相互作用,形成复合体,这一复合体通过锚定蛋白与细胞骨架上的血影蛋白连接,有助于维持红细胞形态和氨的运输,不过 CD47 在其中的功能尚不清楚。
在 T 细胞中,Fas 被发现与 CD47 发生横向相互作用。只有在表达 CD47 的细胞中,通过激活 Fas 才能够引起细胞凋亡。CD47 与 Fas 的相互作用对于 Fas 下游的信号通路包括 caspase-7 和聚腺苷酸二磷酸 核糖转移酶(poly ADP-ribose polymerase,PARP)裂解都是必要的。
1.3.3 胞内相互作用 将 CD47 跨膜结构域和 C 末端尾巴作为酵母双杂交系统诱饵,从人类淋巴细胞cDNA文库中筛选,发现BNIP3是其胞浆结合配体。反向抑制 BNIP3 能够抑制 CD47 介导的细胞凋亡,而用TSP1激活CD47能够诱导BNIP3转移到线粒体,导致细胞死亡,而 SIRPα 与 CD47 结合并不能引起 BNIP3 转移。
利用 CD47 胞浆尾巴的整合素相关蛋白-2(integrin associated protein-2,IAP2) 和 IAP4 剪切异构体作为酵母双杂交系统诱饵鉴别出了另外2 种泛素相关蛋白作为 CD47 胞浆结合配体,分别是连接整合素相关蛋白和细胞骨架蛋白 PLIC1 和 PLIC2,后续研究发现 PLIC1 结合 G 蛋白 βγ 亚基(Gβγ),从而使 CD47 与三聚体 G 蛋白相结合,调节其下游信号通路。
2CD47 相关信号通路
在胞外与 CD47 相互作用的配体分别是 TSP1、SIRPα 和 CD47 自身。其中,目前对 CD47 自身的同型相互作用参与的信号转导知之甚少。因此,目前 CD47 主要参与的信号通路可以按胞外与之相互作用的配体大致分为 2 个方面,即 TSP1 和 SIRPα分别与 CD47 相互作用参与调控的信号通路,如图2 所示。
2.1 CD47/TSP-1 相关通路
2.1.1 调控 G 蛋白通路 CD47 与整合素形成的复合体可通过其胞内配体 PLIC1 与三聚体 G 蛋白相互作用,形成 CD47-整合素-G 蛋白复合体。CD47 的5 个跨膜结构域与其配体整合素的 2 个 TM 片段形成一个临时的 7 次跨膜复合体(7TMS),7TMS 能够激活 G 蛋白。不同的整合素配体以及具有不同胞浆尾巴的 CD47 异构体都能够使 7TMS 复合体具有激活特异性三聚体 G 蛋白的功能。G 蛋白可以介导 CD47 多种细胞效应,如 CD47 相关的血小板激活需要 G 蛋白激活 Syk 激酶,从而诱导 Lyn 和 FAK 磷酸化。CD47-整合素-G 蛋白复合体的另一成分是胆固醇。去除胆固醇不会影响整合素亲和性,但会降低 CD47 刺激细胞黏附到玻连蛋白的能力。因此,虽然细胞基本的扩散机制与胆固醇无关,但是胆固醇似乎对保持功能性的 CD47-整合素-G 蛋白复合体起着必要的作用。
2.1.2 调控 NO/cGMP 信号通路 在血管细胞中,内皮一氧化氮合酶(endothelial NO synthase,eNOs)是主要的一氧化氮(NO)合酶异构体,它能将 L精氨酸转变成 L-瓜氨酸并释放 NO。eNOs 活性受到机械刺激和循环因子如 VEGF 和乙酰胆碱的调控。VEGF 通过内皮细胞上的 VEGFR2 激活 PI3K,后者激活蛋白激酶 B(protein kinase B,PKB,又称为 Akt),Akt 磷酸化 eNOs 上的第 1177 位丝氨酸,使其激活。同时活化的 VEGFR2 募集 Src 并诱导Ca2+ 信号通路,进一步激活 eNOs。产生的 NO 结合靶细胞中可溶性鸟苷酸环化酶(soluble guanylatecyclase,sGC)的血红素结构,增加其酶催化活性,导致胞内 cGMP 积聚,cGMP 激活 cGMP 依赖性激酶 1(cGMP-dependent protein kinase,cGK1), 后者磷酸化肌球蛋白轻链激酶并抑制其活性,使得肌球蛋白轻链脱磷酸化而引起平滑肌松弛。TSP1能够与 CD47 结合,破坏 CD47 与 VEGFR2 复合体,抑制 VEGFR2 激活,进而影响下游信号通路。
2.1.3 调控细胞生存 TSP1 与 CD47 结合能够诱导BNIP3 转移到线粒体,BNIP3 跨膜结构域插入到线粒体膜,引起线粒体通透性转换孔打开,释放细胞色素 C,导致细胞死亡。缺乏 CD47 有助于细胞通过激活保护性的自噬通路促进其生存。自噬是一种维持内环境稳定的分解代谢机制,是胞质溶胶和细胞器被隔离到双层膜的小泡中,由此运送到溶酶体/空泡中降解,并因此形成的大分子进行再循环的一个过程。轻度的自噬可以防止细胞被不利因素损害,有助于其生存。缺乏 CD47 的细胞受到辐射时,beclin-1、ATG5、 ATG7 表达升高,p62 表达降低,LC3 表达升高,自噬小体形成增多,激活保护性自噬。其中 Beclin-1 也能够与 Bcl-2/Bcl-xL 结合构成复合体,从而自噬的激活过程将会受到抑制,因此,Beclin-1与Bcl-2相互作用可直接控制自噬与凋亡。
2.2CD47/SIRPα 相关通路
2.2.1 调控吞噬作用 CD47 作为一种自体的识别分子,或者是作为一种“不要吃我”的信号分子,能够与巨噬细胞表面的 SIRPα 相互作用,防止肿瘤细胞和红细胞被清除。这种防止巨噬细胞吞噬的机制涉及到 SIRPα 的抑制性信号通路,其中部分是通过 SHP-1 来抑制巨噬细胞吞噬作用。
此外,有研究发现,CD47-SIRPα 相互作用在红细胞清除方面的功能可能要更为复杂。人体红细胞的衰老似乎与 CD47 的构象改变有关,可能是依赖于氧化修饰,其能够将分子从“不要吃我”转变为“吃我”的结构。因此,CD47 不仅是一种“不要吃我”的信号,也可能是作为一种调节红细胞清除的开关。因此,CD47 或者 SIRPα 表达异常或相互作用受到干扰都会改变巨噬细胞的吞噬作用,破坏红细胞的体内稳态。
2.2.2 调节树突状细胞和 T 细胞体内稳态 有研究发现,SIRPα 变异小鼠的脾脏 CD4+DC 细胞数量减少,半衰期降低,脾脏中 CD4+T 细胞数量减少,T 细胞聚集区域变小 。表明 CD47 与 SIRPα 相互作用对于调节树突状(DC)细胞和 T 细胞体内稳态具有重要的作用。此外有研究发现,DC 细胞和 T 细胞应答在多种水平上受到 CD47 与 SIRPα 相互作用的影响,CD47 与 SIRPα 相互作用受到干扰会使得 DC细胞功能受损,尤其是在诱导辅助性 T 细胞 Th1、Th2、Th17 和自然杀伤性 T 细 胞(natural killer Tcell,NKT)应答方面 。
3CD47 相关信号通路与疾病的关系
3.1 癌症
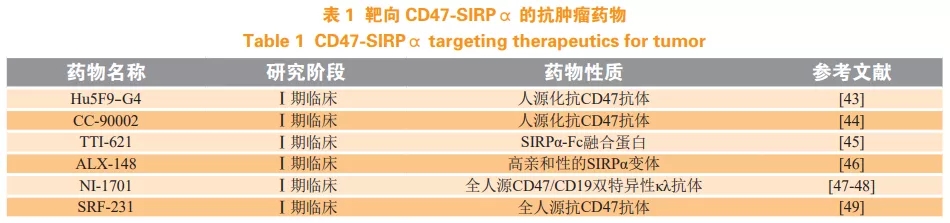
CD47 在多种肿瘤细胞表面高表达,其作为一种“不要吃我”的信号分子,与巨噬细胞表面SIRPα相互作用,从而使肿瘤细胞避免被吞噬清除,增强肿瘤生存能力。因此,靶向 CD47-SIRPα相互作用可能成为肿瘤治疗的一种新策略。目前抗肿瘤治疗主要靶向 CD47-SIRPα 轴,多种治疗药物已处于临床研究阶段,包括常规抗体,融合蛋白和双特异性分子,分别阻断 CD47 或SIRPα(见表 1)。
3.2 心血管疾病
心血管疾病主要的临床表现包括卒中、黄斑变性、外周血管病、高血压、心脏和其他关键器官衰竭、心脏病、伤口愈合不良等。其病因主要是急性或亚急性血流量下降并伴随组织低灌注,而血管细胞内 NO 信号通路受损是导致心血管疾病的关键因素。在衰老过程中,内源性 NO 合成减少而 TSP1表达升高。如前所述,TSP1 和 CD47 相互作用能够抑制 NO/cGMP 信号通路,因此抑制 TSP1-CD47 相互作用能够改善 NO 信号通路,减轻心血管疾病的发生。
Kojima 等采用 CD47 阻断抗体 MIAP410,发现体外可诱导病变的、死亡的与即将死亡的平滑肌细胞和巨噬细胞被清除,并在几种不同的动脉粥样硬化小鼠中,利用抗 CD47 抗体阻断 CD47,从而显著地阻止动脉斑块堆积,使病变血管组织的清除恢复正常。
3.3自身免疫性疾病
有研究表明,SIRPα 和 CD47 与 Th1 细胞或Th17 细胞相关的自身免疫性疾病的形成有关,如实验性变态反应性脑脊髓炎(experimental autoimmuneencephalomyelitis,EAE)、细菌或胶原诱导的关节炎、接触性超敏反应、结肠炎、克罗恩病等。如前所述,CD47-SIRPα 相互作用对 DC 细胞的功能具有调节作用,尤其是迁移和抗原呈递,其对于激活自身反应性 Th1 细胞和 Th17 细胞是必须的。在关节炎、结肠炎和克罗恩病中,干扰 CD47-SIRPα 相互作用能够抑制病情,然而在EAE中却会加重自身免疫和相关疾病。研究表明,SIRPα缺失小鼠或者给予抗SIRPα抗体(P84)能够显著减轻Ⅱ型胶原型关节炎小鼠的炎症水平、骨侵蚀和关节炎症状。
3.4 噬血细胞综合征
HLH 典型特征之一就是噬血细胞作用增强,主要是由于细胞毒性 T 淋巴细胞(cytotoxic lymphocyte,CTL)和 NK 细胞清除病原功能受损,导致巨噬细胞过度增殖,噬血细胞增多。CD47 在 HLH 的CD34+CD38-HSCs 中表达下调,巨噬细胞对其吞噬作用增强,从而发生噬血细胞综合征。
4 结语与展望
CD47 与其 2 个配体 TSP1 和 SIRPα 相互作用,参与多种信号通路,参与机体多种生理功能及病理过程的发生发展,因此靶向 CD47 为疾病的治疗提供了一种新的方法。目前,靶向 CD47 的治疗主要还是集中在抗肿瘤领域,治疗策略主要有阻断抗体、重组融合蛋白、反义 RNA、小分子抑制剂,其中阻断抗体和重组融合蛋白研究较多,主要是分别靶向 CD47 及其 2 个配体 SIRPα 和 TSP1。目前国际上处于 I 期临床的靶向 CD47 的抗肿瘤药物包括Hu5F9-G4、CC-90002、TTI-621、ALX148 等, 其中 TTI-621 是可溶性重组 SIRPα-Fc 融合蛋白,其穿透能力和组织分布性较好,与红细胞的亲和力也更低,安全性更高。国内走在前列的是宜明昂科生物的 IMM01,目前已获得临床试验受理。小分子抑制剂,如多肽,体内半衰期较短,且容易酶解,难以发挥治疗作用,但其可用于设计有效稳定的模拟肽,如 TSP-1 的模拟肽,可用于识别其受体 CD36。反义 RNA 能够阻断 CD47 mRNA 翻译,从而抑制CD47 蛋白表达,也有望成为靶向 CD47 的有效手段。总之,CD47 不仅是目前肿瘤领域研究的热点,在其他多种疾病中也扮演着重要作用,开发靶向 CD47 药物有望为疾病的治疗提供新的策略。