Immunity:胞内结构域改造可使CAR-T更持久
作为一种新型疗法,CAR-T细胞治疗在多种非实体瘤中都收获了不错的效果,但仍存在一些缺陷和不足。例如,在B细胞恶性肿瘤中,约有10%-20%的患者未能取得完全缓解(CR),在取得完全缓解的患者当中,又有约30%-50%的患者在不到1年的时间内复发。在实体瘤中,CAR-T疗法的情况更加不容乐观,大部分实体瘤患者对CAR-T疗法的响应率实际上是很低的。
为了能够使输入体内的细胞尽可能多的发挥疗效,如何使CAR-T细胞变得更持久(persistence)是目前该领域研究的重点之一。来自上海科技大学的HaopengWang、中国科学院大学的Chenqi Xu以及复旦大学附属眼耳鼻喉科医院的Haitao Wu等人对此进行了研究,科研成果于2020年8月5日发表在Cell旗下期刊Immunity上,论文题目为《Chimeric Antigen ReceptorDesigned to Prevent Ubiquitination and Downregulation Showed Durable AntitumorEfficacy》。
在对T细胞受体(TCR)的研究中,科学家早已观察到这样的现象:在抗原与TCR结合后,TCR会发生泛素化并导致其蛋白水平下调,而抑制TCR的泛素化过程则会大大增强T细胞的活性,那么CAR在受到抗原刺激之后是否也会经历泛素化并导致CAR-T的活性受到影响?这篇论文从CAR的泛素化修饰入手,找到了激活CAR-T活性的办法。
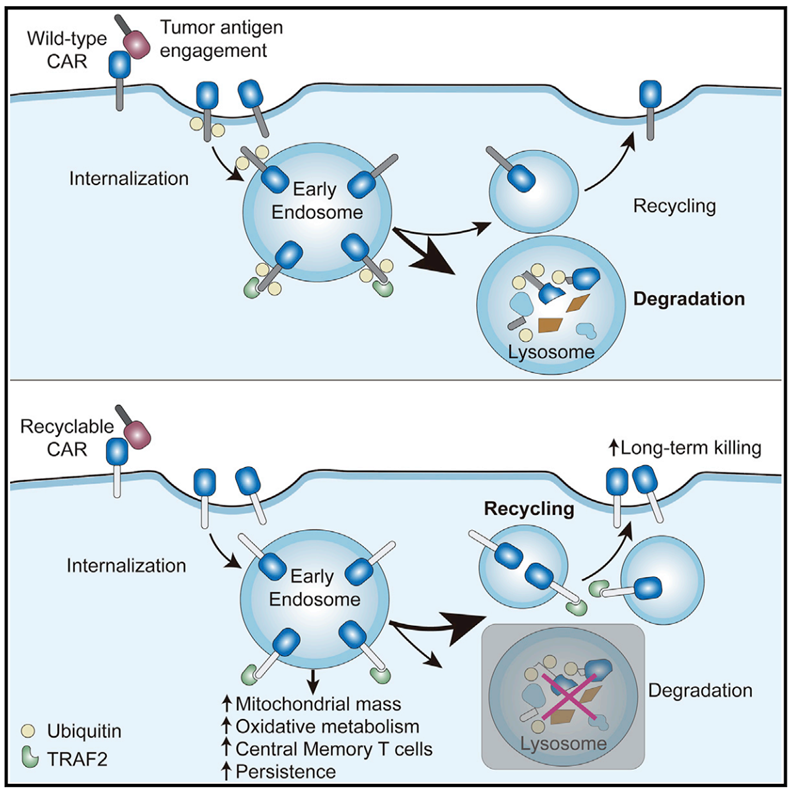
论文的Graphical Abstract如下图所示。当CAR-T细胞表面的CAR受到抗原刺激后,其胞内结构域会发生泛素化修饰,泛素化修饰后的CAR被内化(internalization)之后会通过溶酶体途径降解,这将大大降低CAR-T细胞的活性,而无泛素化修饰的CAR被内化之后仍然会回到细胞表面。研究人员发现,将CAR胞内结构域的泛素化位点(赖氨酸残疾)突变掉之后可以成功阻断CAR被泛素化、内化进而导致溶酶体降解的这个过程,从而提高CAR-T对肿瘤细胞的杀伤效果。
论文当中代表性的Figure如下:
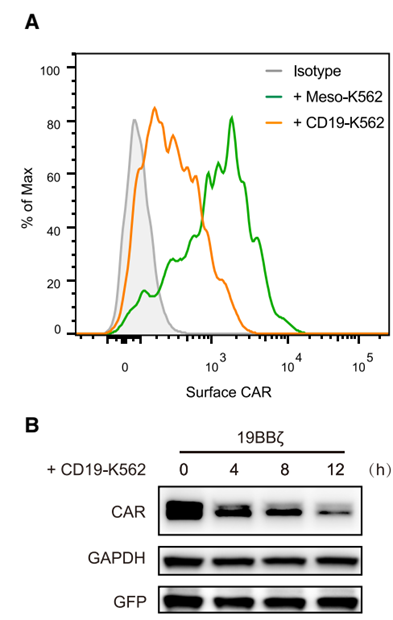
(1) 抗原激活CAR-T细胞导致CAR表达下调
将表达19z CAR的CAR-T细胞与过表达CD19的K562细胞共同培养过夜,使用流式细胞仪检测CAR-T细胞表面19z CAR的蛋白水平,并使用Western Blot检测CAR-T细胞中19z CAR蛋白的整体表达水平,可以看到在CD19刺激之后,不仅CAR-T细胞表面的CAR蛋白水平下降,细胞整体水平上CAR的蛋白水平也发生了下调:
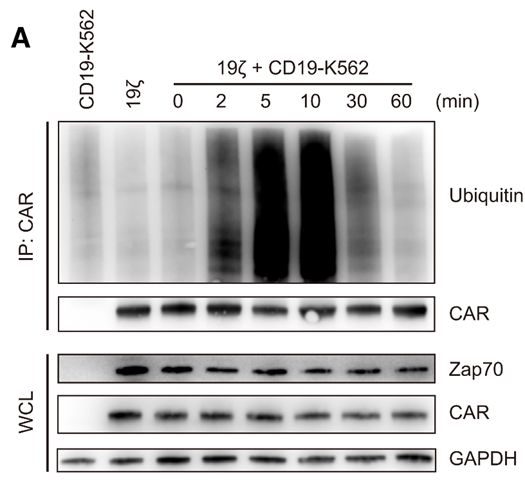
(2)激活的CAR被多泛素化修饰并降解
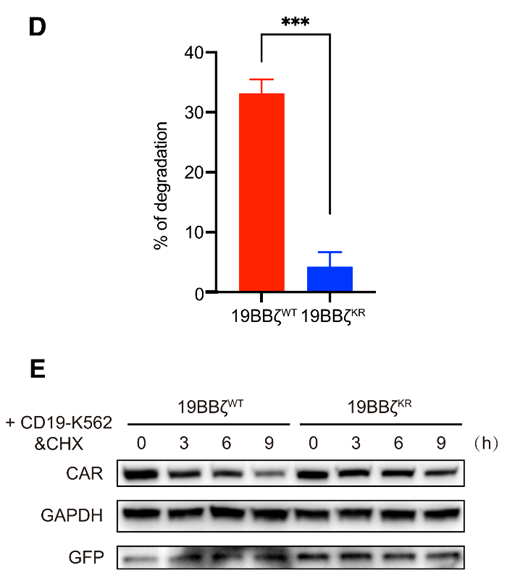
在CD19-K562刺激之后,CAR-T细胞中的19z CAR泛素化水平在10min内便升到了相当高的水平,且其蛋白量逐渐降低;蛋白泛素化主要发生在lysine残基上,将 19z CAR胞内的lysine全部突变为arginine之后(即19BB zKR),CAR的稳定性显著增加。
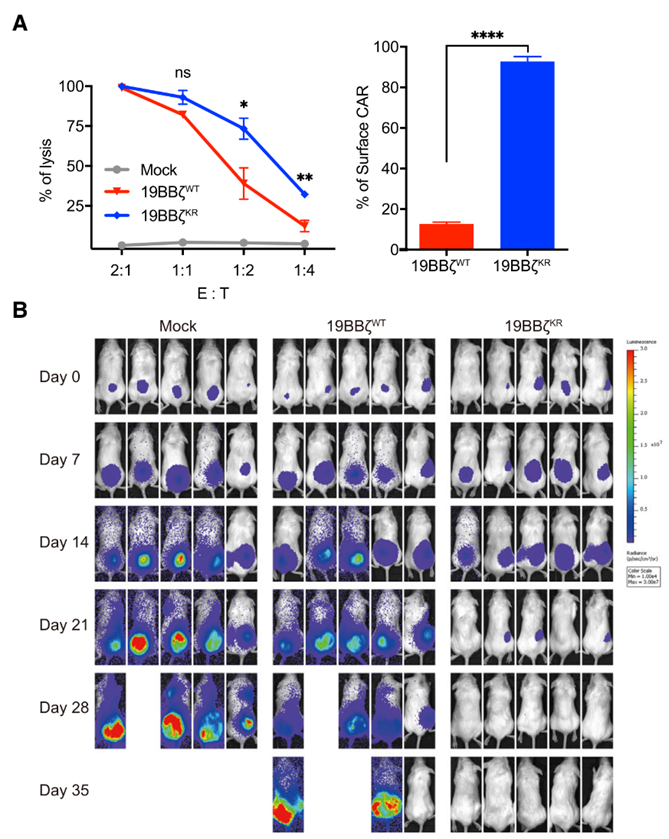
(3)19BBz CARKR-T细胞杀伤肿瘤的活性远高于19BBz CARWT-T细胞
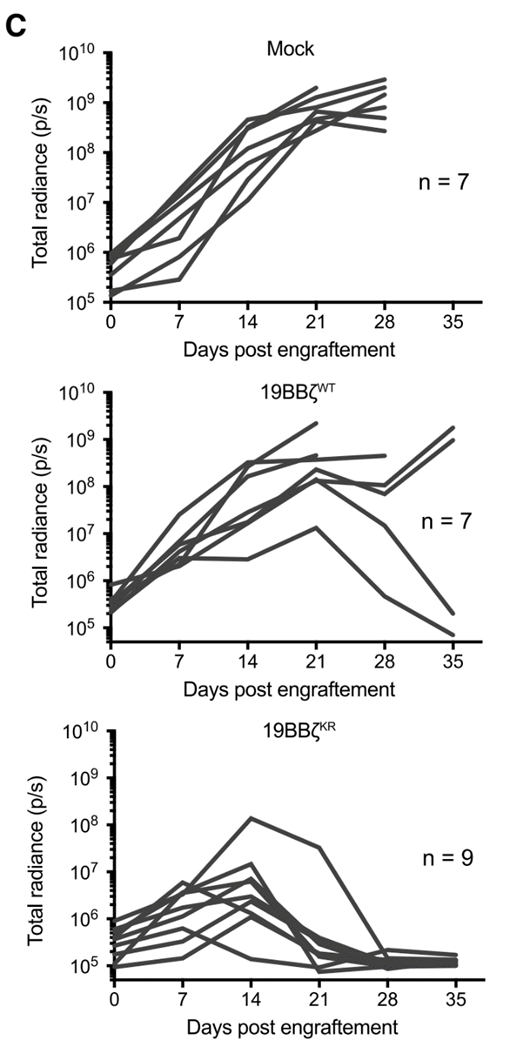
不管是细胞实验(A)还是小鼠模型(B)中,都观察到19BBz CARKR-T细胞对肿瘤细胞的杀伤活性要远高于未经改造的19BBz CARWT-T细胞:
在输注35天内对小鼠体内肿瘤细胞的荧光信号进行定量,可以明显看到改造后的19BBz CARKR-T细胞对肿瘤细胞的杀伤效果更为持久:
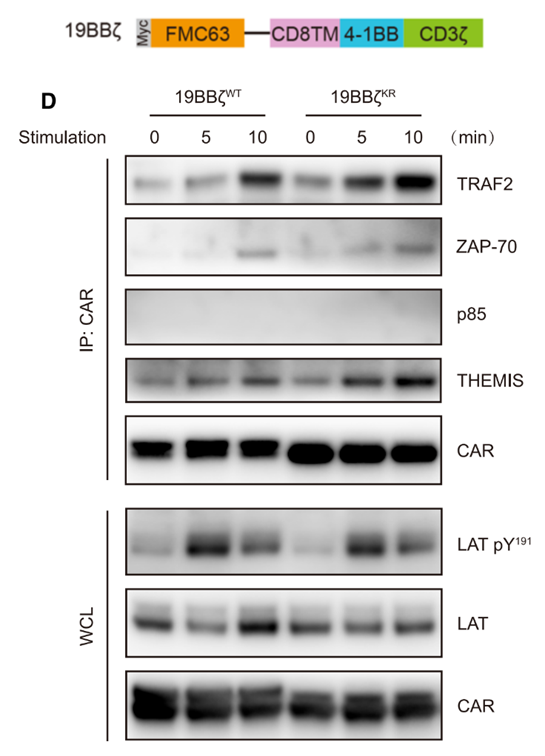
(4)19BBz CARKR-T细胞下游信号通路的激活程度要高于19BBz CARWT-T细胞
前人研究表明,常用的CAR共刺激信号4-1BB可以在CAR受到抗原刺激后招募下游脚手架蛋白TRAF2,TRAF2再与其它蛋白结合向下游传递激活信号。本研究所使用的CAR包含一个4-1BB共刺激结构域(如下图所示)。数据显示,在接受抗原刺激后,4-1BB与TRAF2蛋白的结合增强,且lysine突变的19BBz CARKR 与TRAF2的结合要强于未经改造的19BBz CARWT,说明改造之后的19BBz CARKR 可以向下游传递更强的激活信号。
本文到此结束,感谢各位读者支持。