近年来,随着多款重磅抗体药物的专利陆续失效,生物类似药的研发热潮迭起,国内外竞争激烈。尤其随着肿瘤免疫疗法的异军突起,肿瘤类的生物药研发进一步受到挑战。然而,受制于地域收入水平及医疗条件的差异,生物类似药注定将在提高药物可及性方面发挥重要作用。
2020年8月14日,复宏汉霖宣布,公司自主研发的注射用曲妥珠单抗汉曲优®(HLX02)正式获得国家药监局(NMPA)批准,而在不久前,该产品(欧盟商品名:Zercepac®)已正式获得欧盟委员会批准,由此成为首个中欧双批的国产单抗生物类似药,开辟了中国医药企业参与单抗生物类似药“世界杯”比赛的先河。作为国内抗体药物领军企业,复宏汉霖是如何从激烈的生物类似药赛道中突出重围,同时应对下一代药物的冲击,其破局之道为何?笔者且以刚刚获批的HLX02汉曲优®为代表的HER2靶点相关药物揭示复宏汉霖在生物类似药领域的突破之路。
质量是药物开发的生命线,也是企业在重重竞争中突出重围的关键所在。就复宏汉霖而言,公司自成立之初即以国际化的标准进行高质量的生物类似药开发,在质量对比研究、临床前研究和临床试验中均与原研药进行了头对头的比较,对质量的高标准要求在一定程度上为产品的获批按下了“加速键”。
根据2015年NMPA发布的《生物类似药研发与评价技术指导原则(试行)》,通过比对试验研究证实临床相似的,可以考虑外推至参照药的其他适应症。汉曲优®获得和原研一样的适应症和通用名,获批主要基于对一系列研究数据的审查,包括质量对比研究、临床前研究及临床研究(包括1期和国际多中心3期临床研究)相关数据。这些数据证明了汉曲优®与参照药(赫赛汀®)高度相似,在产品质量、药理学、药代动力学、药效动力学、毒理学、免疫原性、安全性和有效性等方面与原研曲妥珠单抗没有临床意义上的差异。根据国家医疗保障局发布的《基本医疗保险用药管理暂行办法》,《国家基本医疗保险、工伤保险和生育保险药品目录》(“药品目录”)按通用名进行管理,药品目录内药品的同通用名药品自动属于基本医疗保险基金支付范围,这将极大地增进生物类似药的可及性。
今年2月,复宏汉霖基于曲妥珠类似药HLX02汉曲优®研究撰写的"Demonstrating Analytical Similarity of Trastuzumab Biosimilar HLX02 to Herceptin® with a Panel of Sensitive and Orthogonal Methods Including a Novel FcγRIIIa Affinity Chromatography Technology"一文在生物药领域老牌权威杂志BioDrugs上成功发表。此次HLX02相似性分析依据NMPA、EMA、美国FDA和人用药品注册技术要求国际协调会(ICH)发布的生物类似药相似性分析指南,利用国际先进的质量源于设计(QbD)理念,由复宏汉霖团队利用50多种正交、先进的方法对HLX02、欧洲市售原研曲妥珠单抗和中国市售原研曲妥珠单抗进行了头对头的分析相似性评估,并首次将Tosoh Fcγ受体IIIa(FcγRIIIa)亲和色谱技术创新性地应用于曲妥珠单抗的相似性分析。与表面等离振子共振相比,FcγRIIIa亲和层析对曲妥珠单抗的FcγRIIIa亲和力变化表现出更高的敏感性,在生物相似性评估中的展现出强大作用。

该研究结果证实了汉曲优®与原研药赫赛汀®在结构和功能上的高度相似性,且汉曲优®更相似于具有高FcγRIIIa亲和力的赫赛汀®,与该产品在临床研究中展现的疗效和安全性保持了高度一致。
作为复宏汉霖践行产品国际化开发战略的重要成果,汉曲优®与原研药开展了“头对头”的国际多中心(中国大陆、乌克兰、波兰和菲律宾)3期临床试验。在2019年11月22日至11月24日于新加坡举行的2019年欧洲肿瘤学会亚洲分会ESMO-Asia年会上,复宏汉霖分享了汉曲优®的3期研究进展。
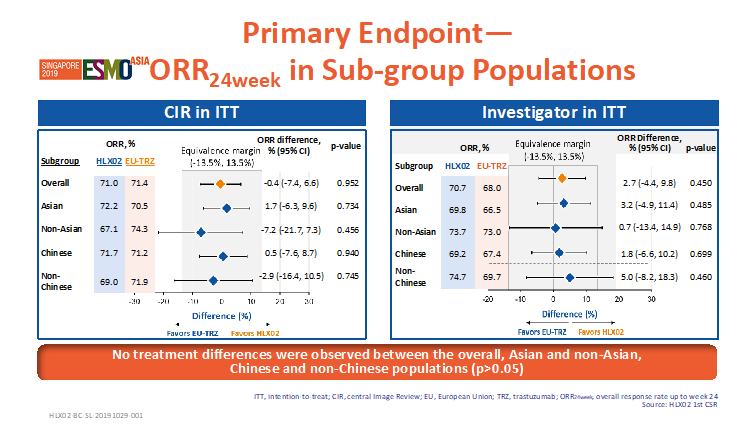
根据截至到2018年11月27日的数据,共649例患者被随机分配到两个治疗组(HLX02组=324;原研组=325)。HLX02组24周的最佳总缓解率为71.0%,原研组为71.4%,两组间无统计学差异。24周的ORR组间差异为-0.4%,其95%置信区间 (-7.4%, 6.6%) 在预设等效区间内(-13.5%,+13.5%),HLX02和原研曲妥珠单抗(欧洲市售)疗效等效性成立。除此之外,亚组(亚洲 vs. 非亚洲,中国vs.非中国)分析显示,HLX02组与原研组24周的ORR在不同人群中无统计学差异(p>0.05),进一步验证了HLX02与原研曲妥珠单抗(欧洲市售)的疗效相似性。
2019年,汉曲优®的中欧上市申报相继取得重要进展。2019年4月,汉曲优®获得中国国家药品监督管理局(NMPA)上市申请受理并在随后被纳入优先审评程序,成为首个在中国申报新药上市的国产曲妥珠单抗,在同类竞品中取得先发优势。2019年6月,复宏汉霖联合其商务合作伙伴全球性制药公司Accord Healthcare(总部位于英国)共同向欧洲药品管理局(EMA)递交的汉曲优®的上市销售许可申请正式获得受理。其实,早在研究开发早期,复宏汉霖已经初步确立HLX02的国际化开发战略,并不断探索其出海之路。
复宏汉霖针对汉曲优®前瞻性地开展了国际商业化布局,一路积极开拓海外市场,主要包括——授予Accord在欧洲、中东、北非地区和部分独联体国家共计70余个国家的独家商业化权利;授予世界一流制药企业Cipla在亚太和拉丁美洲地区部分新兴国家市场的开发和商业化权利;授予总部位于中国香港的雅各臣药业在中国香港及中国澳门的独家商业化权利。2020年3月31日,复宏汉霖宣布与全球性生物技术公司Mabxience签订独家许可协议,授予其在阿根廷、乌拉圭及巴拉圭针对注射用曲妥珠单抗HLX02在肿瘤治疗领域的开发及商业化独家权利。
2020年4月,HLX02汉曲优®原液(DS)和制剂(DP)生产线顺利通过欧盟GMP生产现场检查,成为首个在欧盟报产并获受理的“中国籍”生物类似药,公司徐汇生产基地也由此成为国内首个获得欧盟GMP认证用于生产自主研发抗体生物药的GMP工厂。这意味着复宏汉霖具备了符合欧盟标准的商业化生产基地和质量管理体系,打破了国产单抗生物药在海外上市的GMP壁垒,为汉曲优®进军国际市场奠定了生产基础。
基于高度的相似性和严格的质量控制体系,2020年5月30日,欧洲药品管理局EMA CHMP(人用医药产品委员会)发布积极审评意见,推荐批准HLX02(欧盟商品名:Zercepac®)的上市销售许可申请。2020年7月27日,欧盟委员会(European Commission,EC)正式批准Zercepac®于欧盟上市,用于治疗HER2阳性早期乳腺癌、转移性乳腺癌以及未经治疗的HER2阳性转移性胃癌或胃/食管交界处腺癌。EMA公布的最终审评决定显示,“依照欧盟对生物类似药的要求,Zercepac®具有与参照药Herceptin®高度相似的结构、纯度和生物活性。此外,HER2阳性转移性乳腺癌患者的临床研究结果显示,Zercepac®与Herceptin®的临床疗效等效。这些数据足以证明Zercepac®与参照药对于获批适应症具有相似的疗效和安全性。”
乳腺癌居全球女性恶性肿瘤之首,汉曲优®的原研药赫赛汀自1998年在美国上市,长期以来被公认为HER2阳性乳腺癌、胃癌治疗的“金标准”药物,在复发转移晚期乳腺癌一线治疗、手术乳腺癌的辅助治疗、乳腺癌术前新辅助治疗和转移性胃癌等均占比重要用药地位。2019年,赫赛汀在国内销售额超过40亿元,居国内所有抗体药物销售额之首。
近年来HER2阳性乳腺癌治疗得到显著进展,复宏汉霖在快速推动高品质曲妥珠生物类似药开发的同时,也针对HER2靶点展开了广泛的产品布局,如公司管线中的帕妥珠单抗生物类似药HLX11和创新型抗HER2靶点单抗HLX22。
公司自主开发的帕妥珠单抗HLX11可通过与曲妥珠单抗和化疗联合,用于HER2阳性、局部晚期、炎性或早期乳腺癌患者(直径>2 cm或淋巴结阳性)的新辅助治疗,及作为早期乳腺癌整体治疗方案的一部分,用于具有高复发风险 HER2阳性早期乳腺癌患者的辅助治疗。通过与曲妥珠单抗和多西他赛联合,HLX11可用于 HER2 阳性、转移性或不可切除的局部复发性乳腺癌患者的治疗。针对转移性疾病,患者既往未接受过抗 HER2 治疗或者化疗,帕妥珠单抗+曲妥珠单抗+化疗治疗的已经成为新一代乳腺癌治疗的金标准,可显著延长无进展生存期、提高生存率及提升缓解率,为患者带来了更显著的生存获益。
图3. 曲妥珠与帕妥珠成为辅助治疗及转移后的HER2阳性乳腺治疗的金标准
值得一提的是,复宏汉霖自主研发的创新型抗HER2单抗HLX22可以靶向曲妥珠以及帕妥珠以外的HER2结构域,有望在乳腺癌、胃癌的治疗中发挥更强的协同作用。未来,HLX11有望与HLX02、HLX22联合应用于HER2阳性乳腺癌和胃癌及更广泛的治疗领域,打造更高效的联合治疗方案,以质高价优的生物药,造福全球更多病患。
复宏汉霖作为中国领先的生物制药公司,一直致力于为全球患者提供质高价优的创新生物药,产品管线丰富完善,质量管理体系健全。特别值得注意的是,公司的产品开发策略紧密结合中国国情,从生物类似药开发中汲取经验,逐步搭建完善自主的技术平台,进而过渡到创新型单抗产品,凭借高质量的药物研发以及前瞻性的国际化布局在激烈的竞争中脱颖而出,值得其他公司借鉴。
1. Demonstrating Analytical Similarity of Trastuzumab Biosimilar HLX02 to Herceptin® with a Panel of Sensitive and Orthogonal Methods Including a Novel FcγRIIIa Afnity Chromatography Technology
2. Pertuzumab, Trastuzumab, and Docetaxel in HER2-Positive Metastatic Breast Cancer