《自然》子刊综述:免疫疗法治疗“癌症之王”效果不佳,如何才能获得突破?
那么,是什么因素导致癌症免疫疗法在胰腺癌面前“无功而返”,又有什么方法能够打破目前的僵局。近日《自然》子刊Nature Immunology上发表的一篇综述对这一问题进行了深入的剖析。今天,药明康德内容团队将与读者分享这篇综述的精彩内容。
历史的教训和潜在的希望
胰腺癌调节抗肿瘤免疫反应的主要因素
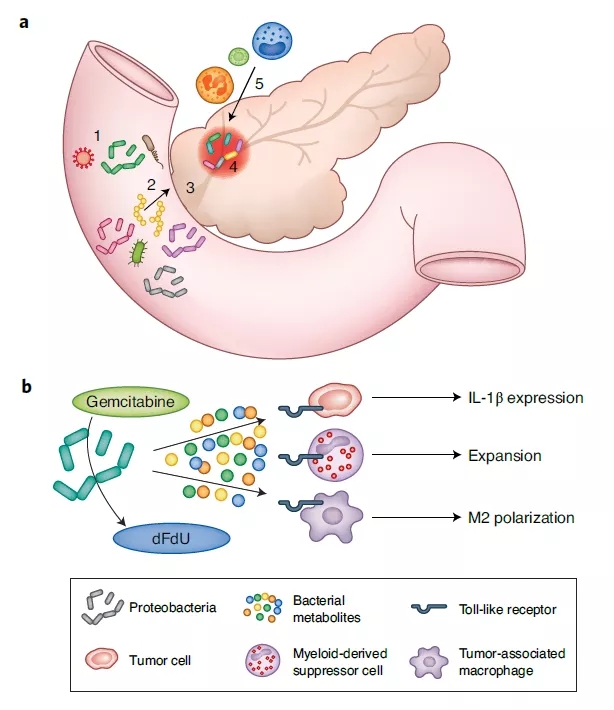
胰腺癌的独特之处在于它具有多重逃避T细胞抗肿瘤免疫反应的机制。除了改变肿瘤周围的细胞基质,为T细胞迁移设置生化和物理障碍以外。胰腺癌的肿瘤微环境中还存在着重要的免疫抑制因素,它们包括多种具有免疫抑制功能的髓系细胞和从肠道迁移到胰腺中的微生物组。
虽然很久以来人们认为正常的胰腺应该是一个无菌的环境,但是已有多项研究表明,肠道细菌能够通过肝胰壶腹(ampulla of Vater)侵入胰腺,而且在胰腺癌患者中的细菌体积会扩展1000倍。这些肿瘤内细菌主要为变形细菌(Proteobateria)。它们不但能够通过酶转化过程让化疗药物失活,而且产生的代谢产物能够通过激活Toll样受体(TLRs),激发具有免疫抑制能力的骨髓来源的抑制性细胞(myeloid-derived suppressor cells, MDSCs),和具有抗炎症作用的M2型肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)的增殖。
除了微生物组的作用以外,胰腺癌的肿瘤也释放多种趋化因子,吸引大量髓系细胞转移到肿瘤微环境中。其中,TAMs在维持肿瘤微环境的免疫抑制特征方面具有主要作用。它们能够促进具有免疫抑制功能的CD4阳性T细胞的分化,从而削弱CD8阳性T细胞的免疫反应。而且在胰腺癌患者中,TAMs能够主动抑制CD8阳性细胞的增生,从而抑制适应症免疫反应。MDSCs也具有终止细胞毒性CD8阳性T细胞增生的能力。
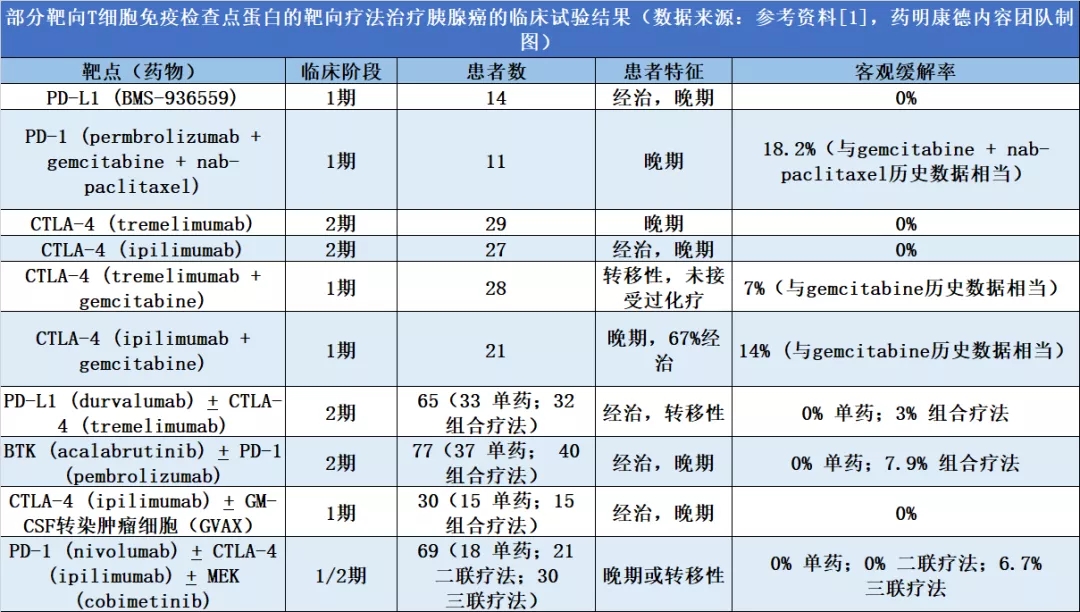
这些多方面的免疫抑制因素,使得单独靶向T细胞免疫检查点蛋白的策略不足以逆转肿瘤微环境的免疫抑制特征。
靶向髓系细胞和微生物组的治疗策略
由于髓系细胞介导着广泛的免疫抑制,因此如何逆转促进免疫耐受的髓系细胞入侵和增殖可能成为发挥检查点抑制剂威力的关键。目前也有多项研究探索将靶向髓系细胞的治疗方法与免疫检查点抑制剂联用的治疗策略。
其中,CD40是在肿瘤微环境的髓系细胞中高度表达的共刺激受体,激活CD40能够刺激树突状细胞的免疫刺激特征,并且将TAMs从辅助肿瘤生长的表型转化为促进肿瘤死亡的表型。CD40激动剂与化疗或T细胞靶向疗法联用,在最近的临床试验中也表现出可喜的效果。
另一个几乎在胰腺癌患者的所有髓系细胞中表达的靶点是CD11b,激活CD11b能够降低TAM的浸润,改善抗原呈现,与基于检查点抑制剂的T细胞疗法联用已经表现出显著效果。
其它有希望的靶点包括BTK、PI3Kγ、RIP1激酶,以及CSF1/CSF1R,CCR2/CXCR2等细胞因子和细胞因子受体。抑制巨噬细胞的BTK、PI3Kγ、RIP1信号通路在临床前模型中能够成功逆转肿瘤微环境的免疫抑制特征。
图片来源:123RF
在靶向胰腺癌的微生物组方面,通过口服抗生素靶向微生物组在实验中表现出逆转髓系细胞介导的免疫抑制的潜力。然而,由于肿瘤内微生物组的成份复杂,靶向微生物组需要对其作用的生物学机制进行更深入的理解。例如,靶向能够降解化疗药物gemcitabine的微生物,在结直肠癌患者中能够提高化疗的效果。理论上如果胰腺癌患者携带同样的微生物,这类靶向疗法同样能够提高化疗对胰腺癌患者的疗效。然而,这一策略的先决条件是胰腺癌的肿瘤内微生物组中包含同样的细菌。
由于我们对胰腺微生物组和疾病进展之间关联的了解还存在局限,早期的研究策略可以采用口服广谱抗生素或噬菌体疗法与癌症免疫疗法联用的策略,在分析疾病应答和/或患者生存的同时,将免疫和微生物组表型变化作为次要终点。另一种策略是免疫疗法与粪便微生物移植联用,长期生存者的粪便微生物移植在动物模型中已经显示出疗效。
发现能够促进免疫疗法和化疗的“好”微生物种类是一个诱人的目标。然而由于微生物组的复杂性,以及微生物组中不同种群之间的相互依赖性,移植单一细菌类型的治疗策略可能不容易成功,而移植包括“支持性”菌种在内的多种细菌可能更有利于有益细菌的定植。
最终,一种理性设计、能够产生协同效应的组合疗法代表着改善胰腺癌患者预后的最好希望。虽然攻克胰腺癌面对的挑战和障碍尤为众多和艰巨,但是具有免疫抑制能力的髓系细胞和微生物组的影响在许多其它类型的癌症中也同样存在。因此,攻克胰腺癌的整合治疗策略可能成为未来的治疗模式,应用于其它对免疫疗法产生耐药性的癌症类型。
参考资料:
[1] Leinwand and Miller. (2020). Regulation and modulation of antitumor immunity in pancreatic cancer. Nature Immunology, https://doi.org/10.1038/s41590-020-0761-y