TGFβ在肿瘤进展和免疫治疗中的作用
TGFβ由癌症细胞,间质成纤维细胞和其他肿瘤微环境的细胞释放,进一步促进癌症发展形成肿瘤的体系结构和抑制抗肿瘤免疫细胞的活动,从而产生免疫抑制环境,阻止或减弱抗癌免疫疗法的疗效。
Derynck, R., Turley, S.J. & Akhurst, R.J. TGFβ biology in cancer progression and immunotherapy. Nat Rev Clin Oncol (2020). https://doi.org/10.1038/s41571-020-0403-1
一、癌症及其微环境
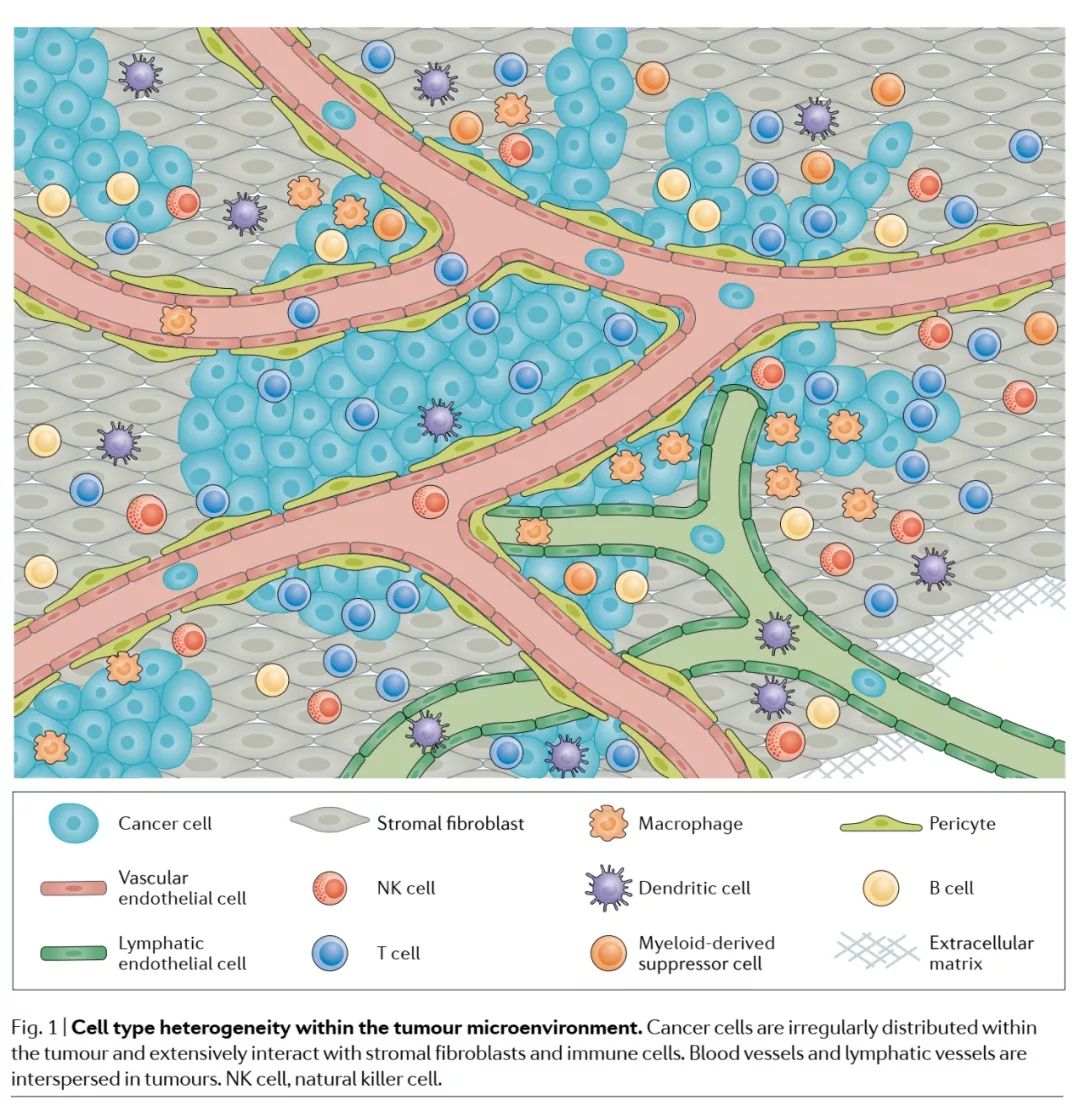
图1 肿瘤微环境中细胞类型的异质性 | 癌细胞不规则地分布在肿瘤内,并广泛地与基质成纤维细胞和免疫细胞相互作用。肿瘤中还散布着血管和淋巴管。
TGF-β通过同时作用于肿瘤微环境中的肿瘤细胞和免疫细胞而促进肿瘤细胞的侵袭和转移。肿瘤细胞响应TGF-β接受EMT。巨噬细胞被暗示从M1-M2表型转变,嗜中性粒细胞响应于TGF-β从N1-N2表型转变。与具有抗肿瘤作用的M1巨噬细胞和N1中性粒细胞相比,M2巨噬细胞和N2中性粒细胞表达和分泌细胞因子和蛋白酶,它们促进基质重构,血管生成,淋巴管生成和EMT。TGF-β还作用于来自Th1-Th2表型的CD4 + T细胞,并促进调节性T细胞(Treg)的分化。
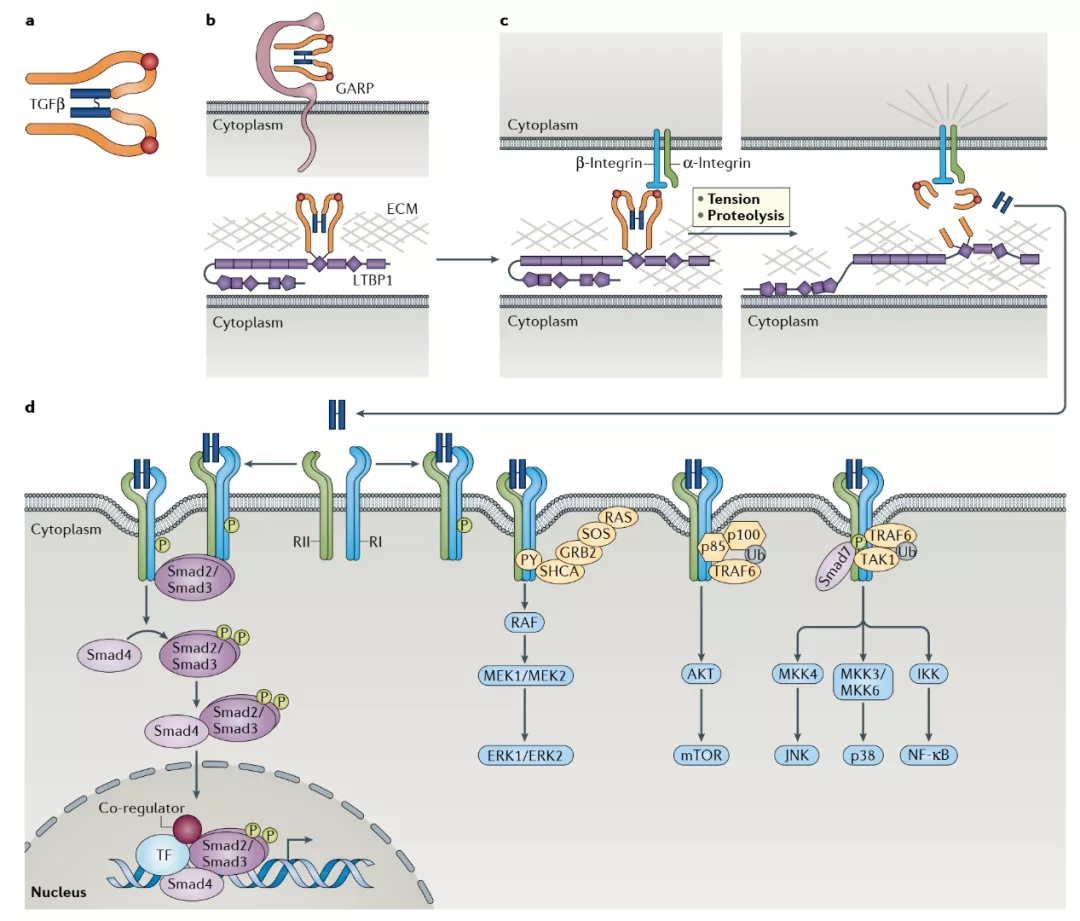
图2 与TGFβ受体和Smad蛋白相关的TGFβ的激活以及信号传导抑制(来源:Nature Reviews Clinical Oncology)
哺乳动物基因组编码三个TGFβs:TGFβ1、TGFβ2和TGFβ3,TGF-β配体在细胞表面结合I型和II型受体。随后,I型受体(ALK5)被II型受体磷酸化。这导致SMAD2和SMAD3磷酸化,与SMAD4形成复合物。一旦从潜伏期相关肽(LAP)潜在的TGF-β结合蛋白(LTBP)复合物中释放出来,TGFβ1的同型二聚体就会与TGF-β受体2(TGFR2)结合,然后募集并激活TGFR1。然后,活性TGFR1使Smad2和Smad3磷酸化,后者与Smad4形成复合物并易位至细胞核。该复合物的Smad3组分直接与基因启动子结合,以诱导纤维化分子的转录,包括α-平滑肌肌动蛋白(α-SMA),I型胶原和基质金属蛋白酶组织抑制剂(TIMP),它们可诱导成肌纤维细胞活化和基质沉积。
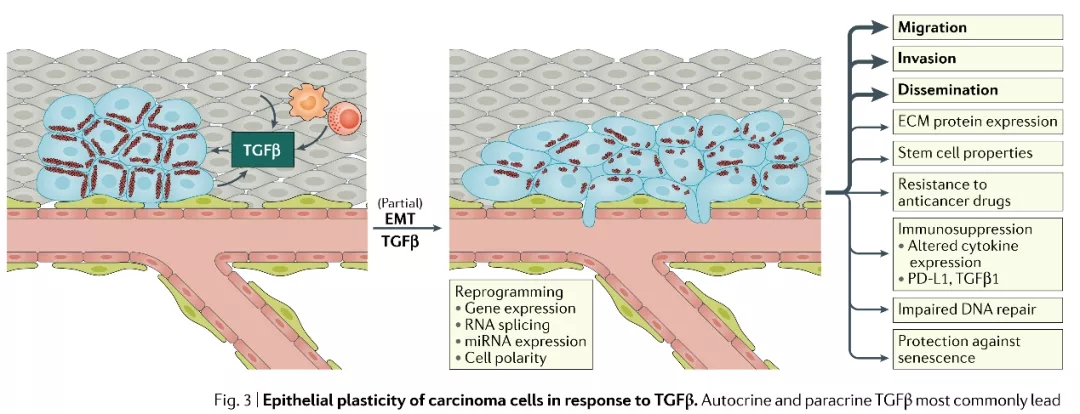
图4 TGFβ对癌细胞上皮可塑性的影响(来源:Nature Reviews Clinical Oncology)
三、TGFβ对肿瘤细胞生物学行为的影响
自分泌和旁分泌TGFβ最常见的是导致部分上皮-间质转化(EMT),这一过程涉及基因表达模式的广泛重编程以及细胞极性的转换。EMT相关的这些变化使细胞定向迁移和侵袭成为了可能,这是癌细胞扩散的先决条件。伴随着EMT相关的变化,癌细胞还能够获得干细胞样特性(stem cell-like characteristics),包括对治疗的耐药性增加、免疫抑制配体的表达和释放增加、阻止衰老的能力增加以及DNA修复能力降低(进而增强基因组的不稳定性)。
四、TGFβ对免疫细胞群的作用
TGFβ信号传导对协调先天免疫和适应性免疫的关键细胞类型展现了强大的免疫抑制活性,削弱了肿瘤微环境中固有免疫细胞的抗肿瘤潜能。因此,抑制TGFβ信号有望增强髓系细胞和淋巴细胞的抗肿瘤反应。
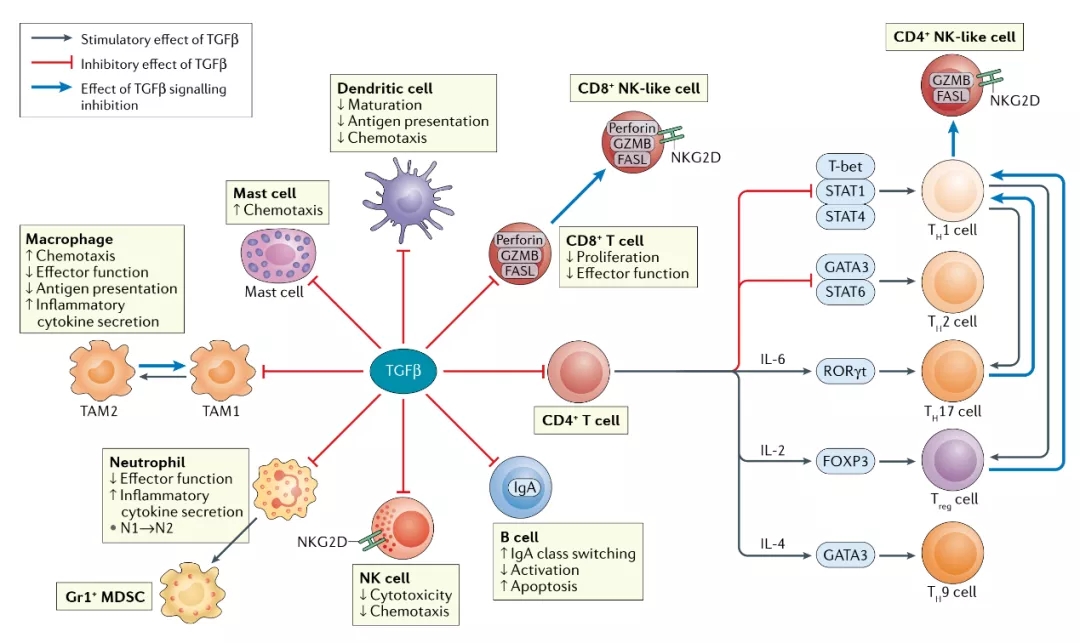
图5 TGFβ对免疫细胞群的作用 | TGFβ信号传导对不同的免疫细胞类型有重要影响,能够刺激或抑制多种免疫细胞的活性。TGFβ信号传导的药理和/或遗传抑制也可以影响特定的细胞类型。
在先天免疫细胞中,NK细胞在抗肿瘤免疫的早期和晚期都表现出抑制肿瘤的功能。这类细胞激活型受体(NKG2D)与癌细胞上的MICA或MICB蛋白结合能够诱导NK细胞激活、产生细胞因子、脱粒,以及释放细胞毒性潜能。然而,TGFβ1可直接或间接抑制NKG2D的表达。
TGFβ还能影响肿瘤内的髓系细胞类型,包括MDSCs、巨噬细胞(macrophages)和中性粒细胞(neutrophils)。这些细胞在肿瘤生长的早期积累,以响应由肿瘤细胞产生的趋化因子和细胞因子(包括TGFβ)。虽然巨噬细胞和中性粒细胞的进化是为了清除感染源和受损细胞,但在癌症发展期间,它们响应由癌细胞和/或肿瘤微环境中的其它细胞释放的因子(如TGFβ),发展出了促肿瘤表型,分别为M2样表型和N2样表型。MDSCs可抑制NK细胞的活性,并有助于TGFβ的转移作用。TGFβ还可抑制DCs细胞和其它髓系细胞的抗原递呈,促进免疫抑制活性。
TGFβ对适应性免疫系统中CD8+T细胞介导的抗肿瘤免疫反应也有抑制作用,这可以通过直接影响CD8+T细胞或间接影响控制CD8+T细胞功能的的辅助细胞来实现。
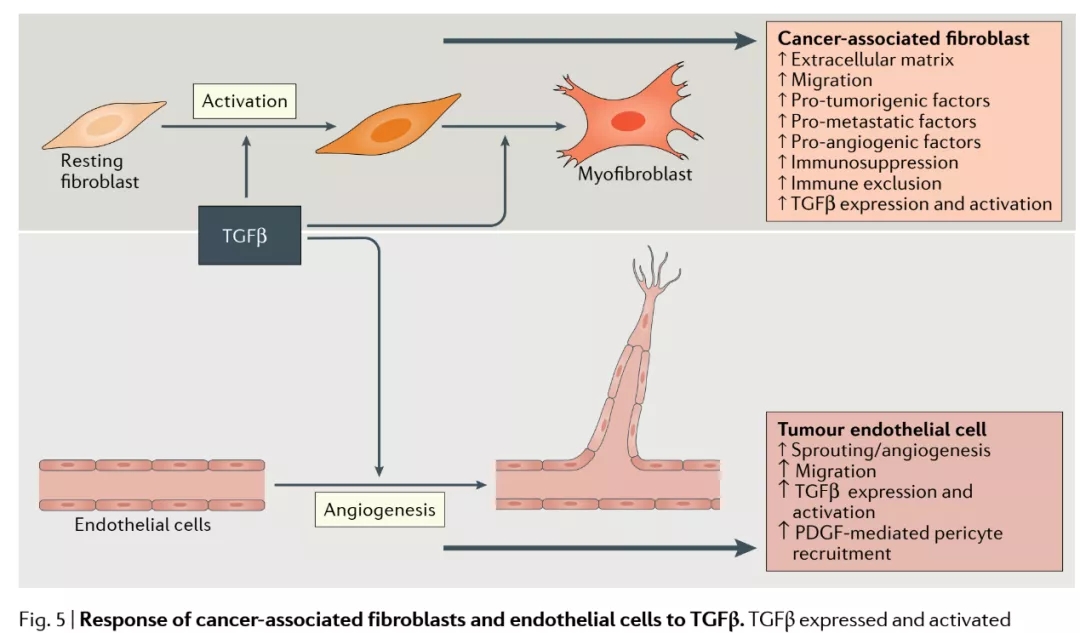
在肿瘤微环境中,肿瘤细胞或其他细胞表达和激活TGF因子,通过对肿瘤相关成纤维细胞和血管生成的作用,促进肿瘤进展
五、TGFβ抑制剂
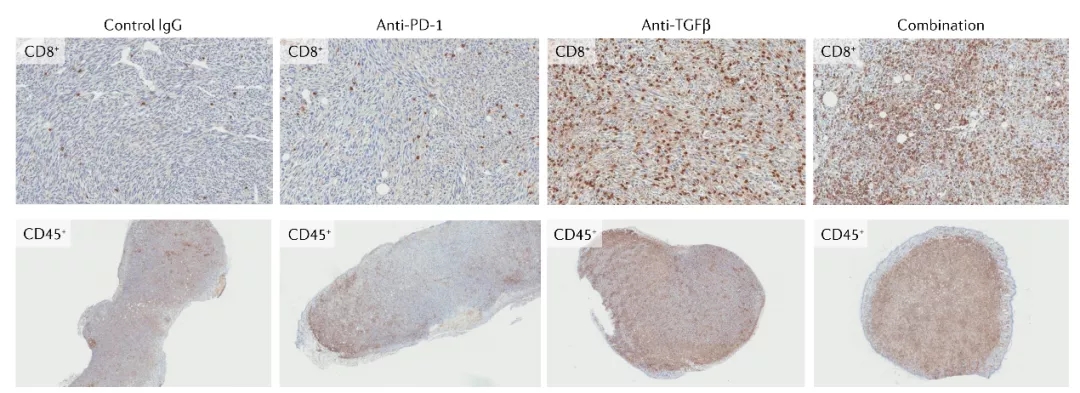
在本模型中,抗pd -1治疗导致CD8+和CD45+细胞增多,主要分布在肿瘤皮质内,向肿瘤核心浸润较少。相比之下,抗tgf治疗使得CD8+和CD45+细胞在整个肿瘤浸润更加均匀。两种药物协同作用,导致60%的肿瘤完全排斥和获得持久免疫(未显示)。
一系列抑制TGFβ信号传导的候选药物/疗法已被开发出来,且正在接受评估,其中一些已经在临床试验中进行测试(表1)。
大部分抑制TGFβ 信号传导的候选药物/疗法属于以下4大类:
1)抑制TGFβ受体激酶的小分子, 这些抑制剂主要阻止ATP与TGF受体结合,从而阻断TGF载体对Smad2和Smad3的激活。如Galunisertib/Lilly及其下一代衍生物LY3200882(NCT02937272、NCT4031872)、vactosertib/Medpacto以及PF-06952229 /Pfizer(NCT03685591);目前的TGF抑制因子受体激酶抑制剂缺乏特异性和较差的药代动力学特性使得制定临床研究给药策略显得困难。并且与其他通路的小分子抑制剂一样,TGFβ受体激酶抑制剂也同样会诱导肿瘤发生耐药突变, 短期治疗计划和/或“药物假期”,通常与靶向治疗一起使用,可能避免获得这种耐药性。因此,大多数galunisertib或其新一代衍生物的临床试验都涉及两周的药物治疗和两周的药物治疗。
2)阻止TGFβ与受体结合的中和性抗体具有精密的配体特异性,尽管需要克服TGFβ与其细胞膜表面的配体极高的亲和力(在0.01nm范围),如Fresolimumab及其下一代衍生物SAR439459(NCT03192345)、NIS793 (NCT02947165)、IMC-TR1;于阻断TGFβ1和TGFβ3,但不能隔离TGFβ2的抗体作为单药治疗已完成I期临床评价,但未显示临床疗效
3)TGFβ配体阻断剂(Trap), 这些抑制剂由fc稳定的TβRII细胞外结构域二聚体组成,设计用于阻断TGFβ1和TGFβ3,但不能隔离TGFβ2,AVID200/ Formation Biologics (NCT03834662)(可溶性 FC段链接的TβRII胞外域)、Bintrafusp/Merck KGaA GSK(TβRII胞外域与anti-PD-L1嵌合二聚体,M7824);根据不同的配体结合特异性可以设计出不同的TGFβ阻断剂,通过与β聚糖胞外段结合可以阻断TGFβ2。经过工程技术改造的Trap可以变得更小,同时具有更高的亲和力(100-1000倍)。后者在临床研究中可见散发性角化棘皮瘤,角膜病变,粘膜出血。
4)选择性干扰潜伏态TGFβ复合物激活的药物,如ABBV-151 (NCT03821935)。
值得一提的是,由于TGFβ抑制剂单药治疗临床疗效有限,目前业界正在尝试大量的联合治疗,如联合细胞毒性药物、放疗、免疫检查点抑制剂(如PD-1/PD-L1抗体)、癌症疫苗、过继T细胞转移疗法(如CAR-T)。
考虑到TGFβ信号在非病理生理过程中的作用,系统抑制TGFβ信号传导会伴随不良事件的发生并不令人惊讶。尽管对破坏TGFβ信号传导生理活性可能会导致不良事件的这一担心曾大大阻碍TGFβ抑制剂的开发,但目前TGFβ抑制剂的早期临床试验显示,不良事件一般可控制,且这类疗法在与免疫检查点抑制剂联合使用时,反应显著且持久。未来,瘤内选择性靶向TGFβ抑制剂将大大降低不良事件的严重程度并增加治疗机会。使用双特异性药物抑制TGFβ或使用药物干扰组织表达受限的TGFβ信号传导组成有望带来新疗法。此外,将TGFβ抑制剂与肿瘤靶向CAR-T细胞、病毒载体、纳米颗粒或溶瘤病毒相结合可能会提供额外的机会。
但在我们生成任何结论之前,仍需要对不同器官部位的癌症进行大量研究,以评估恶性和TME细胞的肿瘤结构,遗传和表型异质性及其对TGFβ的反应性,以及对各种联合方案的肿瘤应答产生了何种程度的影响。
参考资料:
[1] Rik Derynck et al. TGFβ biology in cancer progression and immunotherapy. Nature Reviews Clinical Oncology (2020).